Collaborateurs
Coordonnateurs régionaux
PEIFFERT Didier
Institut de Cancérologie de Lorraine (54)
CHEVALIER Cédric
Centre Georges-François Leclerc (21)
KELLER Audrey
Institut de Cancérologie de Strasbourg (67)
KIM Stefano
CHU de Besançon (25)
MARREF Imène
CHU de Dijon (21)
Rédacteurs
ELIAS Bachir
(57)
NOIRCLERC Monique
Groupement Hospitalier Régional Mulhouse-Sud-Alsace (68)
Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 10 décembre 2021.
- Cette référence propose la conduite à tenir devant un carcinome épidermoïde de l'anus. Mélanomes et lymphomes sont exclus. Les adénocarcinomes seront traités comme les cancers du bas rectum.
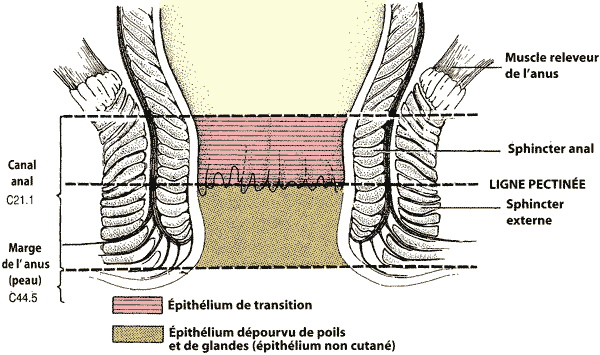
- On distingue deux cas de figure selon que la tumeur siège au niveau du canal anal ou de la marge anale, cette dernière situation étant assimilable à un cancer cutané.
- Identité du patient
- Âge, sexe, état général OMS
- Description de la lésion et situation (canal anal - marge anale)
- Bilan pré-thérapeutique complet
- Compte-rendu anatomo-pathologique (+ statut HPV et surexpression p16)
- Taille de la tumeur et extension ganglionnaire
- Comorbidités, notamment celles qui peuvent interférer sur la prise en charge (sérodiagnostic HIV et immunodéficience)
- Classification TNM.
- Antécédents personnels et familiaux.
- Examen clinique :
- toucher rectal (examen sous AG si besoin)
- palpation du périnée
- aires ganglionnaires inguinales
- examen gynécologique (toucher, spéculum, état cloison recto-vaginale et lésions associées du col)
- anuscopie - rectoscopie avec biopsie (si non faite)
- recherche HPV (col, vagin et canal anal)
- analyse cytologique du frottis du col utérin
- évaluation de la continence.
- Scanner thoraco-abdomino-pelvien avec exploration des régions inguinale et périnéale
- IRM pelvi-périnéale et inguinale
- Bilan biologique avec sérodiagnostic HIV (autorisation) et dosage SCC
- Recherche d'un déficit en DPD si chimiothérapie à base de 5-FU envisagée
- Schéma annoté avec classification TNM et photos si possible
- PET-CT FDG : si ≥ T2 ou N+. En option pour T1N0.
- Bilan spécifique pour un carcinome in situ : si la lésion est suspecte d'infiltration (taille, induration), envisager une nouvelle biopsie et une échographie endo-ano-rectale avant la décision d'exérèse.
- Options :
- échographie endo-ano-rectale
- examen clinique ORL
- PET-CT FDG (T1N0M0)
- Cytoponction ganglionnaire si adénopathies
- anatomo-pathologie :
- recherche p53
- marqueurs tumoraux :
- HPVtc
- dosage SCC.
- Préparation :
- voie veineuse
- options :
- gel d'échographie en endo-rectal (environ 60 cc)
- préparation rectale par suppositoire de DULCOLAX® 1 h avant l'examen.
- Protocole :
- séquences T2 petit champ en coupes de 3 mm :
- sagittal
- axial oblique perpendiculaire à l'axe du canal anal (option : coro oblique, perpendiculaire au précédent si nécessité d'explorer les sphincters)
- séquence axiale T2 grand champ : exploration des ganglions depuis les veines rénales jusqu'aux creux inguinaux inclus
- séquence de diffusion axiale sur le même champ d'exploration
- séquences injectées après gado, LAVA ou VIBE selon la machine de 30 secondes à 3 minutes sur axiales obliques petit champ du T2 précédent ; option coro oblique post gado pour les sphincters si nécessaire.
- séquences T2 petit champ en coupes de 3 mm :
- Option : échoendoscopie endo-anale pour les lésions ≤ T3.
- cTNM correspond à la classification clinique et imagerie excluant usTNM.
- usTNM est utilisé après échographie endocavitaire.
- pTNM est utilisé après examen anatomo-pathologique de la pièce opératoire.
- ypTNM est utilisé après examen anatomo-pathologique de la pièce opératoire et traitement néo-adjuvant.
(AJCC Cancer Staging Manual 8th edition. Editor-in-chief : Mahul B. Amin)
| T - Tumeur primitive | |
| Tx | Tumeur primitive non évaluable |
| T0 | Pas de signe de tumeur primitive |
| Tis | Carcinome in situ, maladie de Bowen, lésion intra-épithéliale squameuse de haut grade, néoplasie intra-épithéliale du canal anal (AIN II-III) |
| T1 | Tumeur ≤ 2 cm dans sa plus grande dimension |
| T2 | Tumeur >2 cm et ≤ 5 cm dans sa plus grande dimension |
| T3 | Tumeur de plus de 5 cm dans sa plus grande dimension |
| T4 | Tumeur envahissant un ou plusieurs organes de voisinage |
| N - Ganglion | |
| Nx | Ganglions non évalués |
| N0 | Absence de ganglion métastatique |
| N1a | Métastases ganglionnaires inguinales et/ou dans le mésorectum et/ou iliaque interne |
| N1b | Métastases ganglionnaires iliaques externes |
| N1c | Métastases ganglionnaires iliaques externes et inguinales, dans le mésorectum et/ou iliaques internes |
| M - Métastase | |
| M0 | Pas de métastase à distance |
| M1 | Présence de métastases à distance (y compris adénopathies autres que celles citées en N1c) |
(Giovannini, 2001 ; Magdeburg, 1999 ; Otto, 2009)
- Après discussion avec des experts d'autres régions qui utilisent aussi largement cette technique, nous pensons que les petites tumeurs peuvent bénéficier de ce staging. Le but est d'améliorer le classement T2 vs T3.
| usT0 | Pas de tumeur visible |
| usT1 | Atteinte muqueuse et sous-muqueuse sans atteinte du sphincter interne |
| usT2 | Atteinte du sphincter interne ou de la musculeuse rectale sans atteinte du sphincter externe ou de la graisse péri-rectale |
| usT3 | Atteinte du sphincter externe ou de la graisse péri-rectale |
| usT4 | Atteinte d'organe de voisinage |
| usN0 | Pas de ganglion anormal en péri-rectal ou iliaque interne |
| usN1 | Ganglion péri-rectal d'allure métastatique |
| usN2 | Ganglion iliaque interne d'allure métastatique |
| T - Tumeur primitive | |
| Tx | Tumeur primitive non évaluable |
| T0 | Pas de signe de tumeur primitive décelable |
| Tis | Carcinome in situ |
| T1 | Tumeur ≤ 2 cm dans sa plus grande dimension |
| T2 | Tumeur ≥ 2 cm et ≤ 5 cm dans sa plus grande dimension |
| T3 | Tumeur de plus de 5 cm dans sa plus grande dimension |
| T4 | Tumeur envahissant les structures profondes sous-dermiques, par exemple : cartilage, muscle strié ou os |
| N - Ganglion | |
| Nx | Envahissement ganglionnaire non évaluable |
| N0 | Pas d'adénopathie régionale métastatique |
| N1 | Adénopathies régionales métastatiques (ganglions inguinaux homolatéraux) |
| M - Métastase à distance | |
| Mx | Atteinte métastatique à distance non évaluable |
| M0 | Pas de métastase à distance |
| M1 | Présence de métastases à distance (y compris adénopathies autres que celles citées en N1c) |
- Les adénocarcinomes sont traités comme les adénocarcinomes du bas rectum. Les autres histologies sont à discuter au cas par cas en RCP.
- Infections par le VIH
- Personnes ayant des relations sexuelles anales
- Lésions dysplasiques anales ou génitales HPV induites
- Carcinome génital ou ORL HPV induit
- Transplantation d’organe
- Maladies dysimmunitaires : Maladie de Crohn, Lupus…
- Immunodépression acquise ou induite
- Recommandé selon avis d’expert chez les groupes à risque :
- Les personnes vivant avec le VIH
- Les hommes ayant une sexualité anale avec les hommes
- Les patients aux antécédents de cancer génital HPV induit
- Les patients immunodéprimés
- Les modalités de dépistage étant toujours en cours d’évaluation, il peut être proposé un examen proctologique avec anuscopie standard complété éventuellement par une anuscopie haute résolution, cytologie anale et détection de l’HPV.
- Rythme :
- En l’absence d’anomalie tous les 2 ans
- En présence d’anomalies tous les ans voire tous les 6 mois en cas de néoplasies intra-épithéliales de haut grade.
Pas de réponse
ou progression
Classification ?
Radiothérapie
externe
T1 - M0
N1
Traitement des
adénopathies
inguinales
Adénopathies locorégionales ?
Bilan pré-thérapeutique
(M0)
Tis - M0
Résection ?
Chirurgie
conservatrice
R0 =
marges
saines
Radiothérapie externe
Chirurgie conservatrice
R1 =
marges
envahies
Radiochimiothérapie
concomittante
Evaluation clinique
Réponse
incomplète
T2 - T4 M0
Biopsie +
Amputation
abdomino-
périnéale
Surveillance
* Réponse complète : sur examens cliniques itératifs et imagerie
(surtout si adénopathie initiale) et biopsie si indiquée
Examen clinique
à 2, 4 et 6 mois
± biopsie
Réponse
complète *
- Comprenant les ganglions :
- inguinaux
- iliaques externes
- iliaques internes
- péri-rectaux
- présacrés.
Option : ganglions iliaques communs en fonction du bilan d'imagerie et en cas de tumeur ≥ T3 ou ganglions positifs.
- Volume cible qui comprend la marge, le canal anal et les fosses ischio-rectales.
- Accélérateur : haute énergie RX de 6 à 25 MV.
- L'irradiation est réalisée de préférence avec modulation d'intensité (IMRT)
- Si chimiothérapie concomitante, la dose délivrée est soit de 44-45 Gy, soit de 36 Gy à raison de 1,8 à 2 Gy/séance, 5 séances par semaine.
- En l'absence de chimiothérapie : la dose délivrée est de 45 Gy à 50 Gy en 5 semaines.
- Peut se faire sans repos ou après un repos n'excédant pas 15 jours.
- volume cible : tumeur primitive et ganglions envahis
- par radiothérapie
- par curiethérapie interstitielle par Ir 192 sous AG (Pommier, 2013)
- par radiochimiothérapie (option : si 1ère séquence de radiochimiothérapie à faible dose de 36 Gy).
- Dans tous les cas, la dose cumulée à la tumeur ou aux ganglions considérés envahis n'est pas inférieure à 59-60 Gy.
- Pas de boost intégré en dehors d'un essai clinique.
- Dans les cancers du canal anal localement avancés, le traitement de référence est représenté par la radiochimiothérapie concomitante, associant 5-Fluorouracile en perfusion continue et mitomycine C. La capécitabine peut remplacer le 5-Fluorouracile (essai de phase II).
- En l'absence de Mitomycine C disponible, possibilité de CDDP.
- Il n'y a pas de place pour une chimiothérapie d'induction, ni adjuvante hors essais cliniques.
- Essai INTERACT-ION (pour les patients de stade III) : il évalue l'association du DCF modifié + Ezabenlimab (anti-PD1) en induction + adjuvant (NCT04719988).
- En cas de maladie métastatique, une chimiothérapie est proposée.
- Le protocole DCF modifié est le standard actuel en première ligne. le protocole carboplatine / paclitaxel est une option en cas de contre-indication (e.g. insuffisance cardiaque)
- En cas de maladie oligométastatique, une radiochimiothérapie et/ou chirurgie encadrée par la chimiothérapie peut être proposée.
- Chirurgie de dérivation première dans les cancers fistulisés (exemple vagin), occlusifs ou incontinence anale invalidante (en option pour les patients hyperalgiques).
- Chirurgie ganglionnaire : adénectomie avant ou après radiothérapie plus ou moins chimiothérapie (technique du ganglion sentinelle à évaluer).
- Chirurgie de rattrapage de type amputation abdomino-périnéale (récidive confirmée si possible par biopsie), élargie aux fosses ischio-rectales et aux muscles releveurs ± élargie (selon l'extension locorégionale).
- Les cancers de type cutané sont traités par résection chirurgicale si la conservation du sphincter est possible.
- Dans les autres cas, le traitement est identique à celui des cancers du canal anal.
- A discuter en RCP, avec possibilité d'adaptation des doses de radiothérapie et de l'indication de chimiothérapie en tenant compte de l'état général du patient et du score G8 avec consultation auprès de l'oncogériatre.
- Le protocole DCF modifié est le standard actuel en première ligne
- Le protocole carboplatine/paclitaxel est une option en cas de contre-indication au DCF (e.g. insuffisance cardiaque)
- En cas de maladie oligométastatique, une radio(chimio)thérapie et/ou chirurgie encadrée par la chimiothérapie doit être discutée.
- En deuxième ligne, il n’y a pas de standard. Une chimiothérapie peut être proposée (parmi les différents schémas, la réintroduction du DCF modifié, paclitaxel, FOLFIRI, mitomycine C + fluoropyrimidine sont les plus utilisés).
- L’immunothérapie anti-PD1/L1 montre une efficacité limitée. A l’heure actuelle, elle n’est pas indiquée hors essais cliniques.
- Différents essais de combinaison sont en cours. En première ligne, l’essais SCARCE (DCFm ± atezolizumab) a terminé ses inclusions, et les résultats définitifs sont attendus pour fin 2021. L’essai SPARTANA (DCFm + spartalizumab + radiothérapie stéréotaxique) évalue l’intérêt de l’ajout de la radiothérapie en situation métastatique. L’essai POD1UM-303 (carboplatine + taxol + retifanlimab/Placebo) est en cours. En deuxième ligne ou au-delà, l’essai VolaTIL (UCPVax + atezolizumab) évalue l’intérêt de l’association d’un vaccin anti-télomérase et un anti-PDL1.
Justificatifs
- L’étude de phase 2 de confirmation, multicentrique française Epitopes-HPV02, a confirmé l’intérêt du DCF (docetaxel, cisplatine, 5-fluorouracile) en première ligne (Kim, 2018), précédemment observé dans les données préliminaires d’Epitopes-HPV01 (Kim, 2013). L’objectif principal était atteint avec un taux de survie sans progression (SSP) de 47 % à un an. Le taux de réponse était de 86 % avec 44 % de réponse complète. Les données actualisées d’Epitopes-HPV01 et 02 avec 115 patients montrent une SSP médiane de 12,2 mois avec un taux de SSP de 24,5 % à 5 ans, et un taux de survie globale de 44,4 % à 5 ans (Kim, 2020). Dans ses essais, le schéma DCF modifié (docetaxel 40 mg/m2/J1 + cisplatine 40 mg/m2/J1 + 5-FU 1200 mg/m2/24H, J1-J2 ; J1=J15) était nettement moins toxique que le schéma DCF standard (docetaxel 75 mg/m2/J1 + cisplatine 75 mg/m2/J1 + 5-FU 750 mg/m2/24H, J1-J5 ; J1=J22) avec 53 % d’effets secondaires de grade 3-4 contre 83 %, et sans aucun cas de neutropénie fébrile contre 14 %. Le protocole DCF modifié est le nouveau standard, notamment pour les patients en bon état général (EGOC-PS 0-1).
- L’étude de phase 2 randomisée non comparative internationale Inter-AACT, a évalué 2 schémas de bi-chimiothérapies, le carboplatine + paclitaxel (CP) et le cisplatine + 5-fluorouracile (CF). Même s’ils n’ont pas atteint leurs objectifs prédéfinis, CP a présenté significativement moins d’évènements indésirables graves, et une tendance à une meilleure survie globale. Le taux de réponse était de 59 % pour CP (12,8 % de réponse complète) et 57,1 % pour CF (17,1 % de réponse complète), et les toxicités grade 3-4 était de 71 % pour CP contre 76 % pour CF (Rao, 2020). Le schéma CP est donc préférable au CF, et il faudra le considérer comme une option thérapeutique en première ligne en cas de contre-indication au DCF (Kim, 2020).
- En deuxième ligne, aucune chimiothérapie n’est validée. Dans l’analyse poolée d’Epitopes-HPV01 et 02, les chimiothérapies montrent une SSP médiane de 4,9 mois, et survie globale médiane de 11 mois (article en soumission). Les possibles schémas de chimiothérapie sont la réintroduction du DCF, paclitaxel, FOLFIRI, ou mitomycine + fluoropyrimidine (Saint, 2020 ; Stouvenot, 2020).
- Les traitements complémentaires ablatifs en cas d’oligométastases doivent être considérés et discutés en RCP. Les données prospectives et rétrospectives en première et en deuxième ligne de traitement sont en faveur d’une ablation des métastases et/ou de la tumeur primitive par voie chirurgicale ou par radiothérapie, après une chimiothérapie d’induction ou dans certains cas, comme un traitement électif sans chimiothérapie préalable (Kim, 2020 ; Eng, 2014).
- L’immunothérapie anti-PD1/L1 a démontré une efficacité limitée dans les différents essais prospectifs en deuxième ligne ou au-delà. Actuellement, les données sont disponibles pour 298 patients traités en monothérapie anti-PD1/L1 (Van K Morris, 2017 ; Ott, 2017 ; Marabelle, 2020 ; Rao, 2020 ; Lonardi, 2020). Le taux de réponse est de 13,4 % avec 3,7 % de réponse complète. La survie globale médiane est d’environ 11 mois.
- Essais cliniques : en L1, l’essai SCARCE (DCFm ± atezolizumab) est en cours et n’a pas montré, pour l'instant, de problème de tolérance dans le bras combinaison. L’essai SPARTANA (DCFm + spartalizumab + radiothérapie stéréotaxique) évalue l’intérêt de l’ajout de la radiothérapie. L’essai POD1UM-303 (aarboplatine + taxol + retifanlimab/placebo) est en cours. En L2, l’essai VolaTIL (UCPVax + atezolizumab) évalue l’intérêt de l’association d’un vaccin anti-télomérase et un anti-PDL1 (Spehner, 2021 ; Kim, 2021).
*Essais cliniques en 1ère ligne : SPARTANA, PODIUM-303
*Essais cliniques en 2ème ligne : VolaTIL
Traitement ablatif
Discussion RCP
Option : Chimiothérapie **
Essais cliniques *
Progression
Régression
Maladie oligométastatique ET
réponse à la chimiothérapie ?
réponse à la chimiothérapie ?
DCF modifié *
Option : Carbo/Taxol *
(e.g. insuffisance cardiaque)
(e.g. insuffisance cardiaque)
M1 ou récidive localement avancée non-résécable
- Eviter les biopsies de principe (risque de radionécrose).
| Examens | 1ère et 2ème année | 3ème à 5ème année | après 5 ans |
| TR | tous les 4 mois | tous les 6 mois | optionnel |
| Examen clinique | |||
| Anuscopie (option) | |||
| Scanner TAP Options : IRM et PET |
tous les 4 mois Pour les tumeurs de stade III la 1ère année |
1/an / |
/ / |
Préambule : le thésaurus de chimiothérapie ci-dessous décrit les protocoles utilisés en cas de radiochimiothérapie.
| 5-Fluorouracile 750 mg/m²/j en perfusion continue de 120 h de J1 à J5 Mitomycine C 15 mg/m² à J2 5-Fluorouracile 750 mg/m²/j en perfusion continue de 120 h de J29 à J33 |
Proposition d'adaptation à J29 selon l'hémogramme :
- Leucocytes entre 3 000 et 3 999/mm³ et/ou plaquettes entre 75 000 et 99 000/mm³ : réduire la dose de 5-Fluorouracile de 33 % (à l'appréciation des prescripteurs).
- Leucocytes entre 2 000 et 3 000/mm³ et/ou plaquettes entre 50 000 et 75 000/mm³ :
réduire la dose de 5-Fluorouracile de 66 % (à l'appréciation des prescripteurs).
Références :
- Bartelink H, Roelofsen F, Eschwege F, Rougier P, et al.
Concomitant radiotherapy and chemotherapy is superior to radiotherapy alone in the treatment of locally advanced anal cancer: results of a phase III randomized trial of the European Organization for Research and Treatment of Cancer Radiotherapy and Gastrointestinal Cooperative Groups.
J Clin Oncol 1997; 15: 2040-9.
| 5-Fluorouracile 1000 mg/m²/j en perfusion continue de 96 h de J1 à J4 Mitomycine C 10 mg/m² à J1 et J29 (sans dépasser 20 mg en dose totale par injection) 5-Fluorouracile 1000 mg/m²/j en perfusion continue de 96 h de J29 à J32 |
Références :
- Bosset JF, Roelofsen F, Morgan DAL et al.
Shortened irradiation scheme, continuous infusion of 5-fluorouracil and fractionation of mitomycin C in locally advanced anal carcinomas. Results of a phase II study of the European Organization for Research and Treatment of Cancer. Radiotherapy and Gastrointestinal Cooperative Groups
Eur J Cancer 2003 ; 39 : 45-51. - Ajani JA, Winter KA, Gunderson LL et al.
Fluorouracil, mitomycin, and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal : a randomized controlled trial.
JAMA, 2008 ; 299 : 1914-21.
| 5-Fluorouracile 800 mg/m² en perfusion continue de 96 h de J1 à J4 Cisplatine 80 mg/m² IV en une heure à J1 (avec hyperhydratation et antiémétiques) |
| Reprise à J29 |
Proposition d'adaptation à J29 :
- En cas de neutropénie, thrombopénie, diarrhée, ou mucite, les doses de 5-Fluorouracile sont ainsi réduites : 25 % pour un grade 2, 50 % pour un grade 3 et arrêter le 5-Fluorouracile en cas de grade 4.
- Le cisplatine n'est pas administré lorsque la créatinine est supérieure à 130 µmol/L, ou s'est élevée de plus de 50 %, ou en cas de toxicité neurologique périphérique de grade 2 à 4.
Référence :
- Peiffert D, Giovannini M, Ducreux M, Michel P, et al.
High-dose radiation therapy and neoadjuvant plus concomitant chemotherapy with 5-fluorouracil and cisplatin in patients with locally advanced squamous-cell anal canal cancer : final results of a phase II study.
Ann Oncol. 2001; 12: 397-404.
| Mitomycine C idem 1a ou 1b. Capécitabine 825 mg/m² matin et soir per os les jours de radiothérapie, excluant les week-ends et les arrêts de traitements éventuels entre les 2 séquences de radiochimiothérapie. |
Référence:
- Glynne-Jones R, Meadows H, Wan S et al.
EXTRA--a multicenter phase II study of chemoradiation using a 5 day per week oral regimen of capecitabine and intravenous mitomycin C in anal cancer.
Int J Radiat Oncol Biol Phys. 2008 Sep 1;72(1):119-26.
| Docétaxel 40 mg/m² IV en 1 h à J1 Cisplatine 40 mg/m² IV en 1h à J1 (avec hyperhydratation et antiémétiques) 5-Fluorouracile « infusionnel » 1200 mg/m²/j en perfusion intraveineuse continue sur 2 jours (de J1 à J2) |
| Reprise à J15 |
Référence:
- Kim S, Jary M, André T et al.
Docetaxel, Cisplatin, and 5-fluorouracil (DCF) chemotherapy in the treatment of metastatic or unresectable locally recurrent anal squamous cell carcinoma: a phase II study of French interdisciplinary GERCOR and FFCD groups (Epitopes-HPV02 study).
BMC Cancer. 2017 ;17:574.
-
ANABASE : Etude de description de la prise en charge et de survie des patients porteurs d'un cancer du canal anal
- Status : Ouvert (24-10-2016 - 30-06-2021)
- Promoteur : Fédération Francophone de Cancérologie Digestive (FFCD)
-
CANAL-IMRT-01 : Etude de phase 2, multicentrique, visant à évaluer la radiothérapie conformationnelle avec modulation d’intensité en étalement continu (SIB-IMRT) associée à une chimiothérapie par 5-FU et mitomycine-C chez des patients atteints d’un cancer du canal anal localement avancé.
- Status : Ouvert (15-12-2015 - 15-12-2020)
- Promoteur : Centre François Baclesse Centre de Lutte Contre le Cancer (CLCC) de Caen
-
CIRCA-HPV : Etude prospective évaluant les caractéristiques intrinsèques de la détection de l’ADN tumoral circulant plasmatique comme test de dépistage de rechute dans les 6 mois suivant le test chez des patients en cours de suivi ayant été traités curativement pour un cancer pelvien HPV-induit
- Status : Ouvert (24-01-2019 - 01-12-2023)
- Promoteur : Institut Curie
-
GASVERT : Fiabilité de l'utilisation du vert d'indocyanine dans l'évaluation du ganglion sentinelle en chirurgie cancérologique.
- Status : Ouvert (29-11-2017 - 29-11-2020)
- Promoteur : Institut de Cancérologie de Lorraine
-
INTERACT-ION : Anti-PD-1 et mDCF suivis d’une chimiothérapie chez les patients atteints d’un carcinome anal épidermoïde de stade III. (INTERACT-ION)
- Statut : Ouvert (20-09-2021 - 05-07-2025)
- Promoteur : Centre Hospitalier Universitaire de Besancon
-
LYNK-002 / MK-7339-002 : Etude de phase II évaluant l’efficacité et la sécurité de l’olaparib en monothérapie, chez des patients précédemment traités, ayant une tumeur solide avancée avec un statut HRRm ou HRD positif
- Status : Ouvert (14-02-2019 - 13-02-2023)
- Promoteur : Merck Sharp & Dohme
-
SCARCE C17-02 : Etude de phase II randomisée évaluant l’efficacité de l’atézolizumab en association avec une chimiothérapie de type DCF (docétaxel, cisplatine et 5-fluorouracile) chez des patients ayant un carcinome du canal anal métastatique ou localement avancé non opérable.
- Status : Ouvert (15-05-2018 - 15-06-2022)
- Promoteur : Groupe Coopérateur Multidisciplinaire en Oncologie (GERCOR)
-
SPARTANA : Etude de phase 2, évaluant le spartalizumab associé au traitement mDCF (docetaxel, cisplatine et 5-fluorouracil) et à la radiothérapie, chez des patients ayant un cancer du canal anal métastatique
- Statut : Ouvert (13-12-2021 - 01-11-2025)
- Promoteur : Centre Hospitalier Universitaire de Besancon
-
VOLATIL : Étude de phase II évaluant l’intérêt d’associer le vaccin UCPVax et l’atezolizumab dans le traitement des cancers HPV positifs
- Status : Ouvert (14-02-2020 - 31-01-2022)
- Promoteur : Centre Hospitalier Universitaire de Besançon
- Ajani JA, Winter KA, Gunderson LL et al.
Fluorouracil, mitomycin, and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal: a randomized controlled trial.
JAMA. 2008;299:1914-21.
- Bartelink H, Roelofsen F, Eschwege F, Rougier P, et al.
Concomitant radiotherapy and chemotherapy is superior to radiotherapy alone in the treatment of locally advanced anal cancer: results of a phase III randomized trial of the European Organization for Research and Treatment of Cancer Radiotherapy and Gastrointestinal Cooperative Groups.
J Clin Oncol 1997; 15: 2040-9.
- Bosset JF, Roelofsen F, Morgan DA et al.
Shortened irradiation scheme, continuous infusion of 5-fluorouracil and fractionation of mitomycin C in locally advanced anal carcinomas. Results of a phase II study of the European Organization for Research and Treatment of Cancer. Radiotherapy and Gastrointestinal Cooperative Groups.
Eur J Cancer. 2003 ;39:45-51.
- Camus M et al.
Which lesions should be biopsied during high-resolution anoscopy? Prospective descriptive study of simple morphological criteria.
J Low Genit Tract Dis 2015.
- Clarke MA, Wentzensen N
Strategies for screening and early detection of anal cancers: A narrative and systematic review and meta-analysis of cytology, HPV testing, and other biomarkers.
Cancer Cytopathol 2018
- Eng C, Chang GJ, You YN et al.
The role of systemic chemotherapy and multidisciplinary management in improving the overall survival of patients with metastatic squamous cell carcinoma of the anal canal.
Oncotarget 2014; 5(22):11133–11142.
- Faivre C, Rougier P, Ducreux M et al.
5-Fluorouracil and cisplatinum combination chemotherapy for metastatic squamous-cell anal cancer.
Bull Cancer 1999, 86 : 861–865.
- Giovannini M, Bardou VJ, Barclay RL et al.
Anal carcinoma : prognostic value of endorectal ultrasound (ERUS). Results of a prospective multicenter study.
Endoscopy 2001; 33:231-6.
- Glynne-Jones R, Meadows H, Wan S et al.
EXTRA--a multicenter phase II study of chemoradiation using a 5 day per week oral regimen of capecitabine and intravenous mitomycin C in anal cancer.
Int J Radiat Oncol Biol Phys. 2008 1;72:119-26.
- Glynne-Jones R, Nilsson PJ, Aschele C et al.
Anal cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up.
Eur J Surg Oncol. 2014 ;40:1165-76.
- Haute Autorité de Santé.
Radiothérapie conformationelle avec modulation d'intensité dans le cancer du canal anal.
Collège de la Haute Autorité de Santé, juillet 2015.
- James RD, Glynne-Jones R, Meadows HM et al.
Mitomycin or cisplatin chemoradiation with or without maintenance chemotherapy for treatment of squamous-cell carcinoma of the anus (ACT II): a randomised, phase 3, open-label, 2 × 2 factorial trial.
Lancet Oncol. 2013 ;14:516-24.
- Kim S, Jary M, André T et al.
Docetaxel, Cisplatin, and 5-fluorouracil (DCF) chemotherapy in the treatment of metastatic or unresectable locally recurrent anal squamous cell carcinoma: a phase II study of French interdisciplinary GERCOR and FFCD groups (Epitopes-HPV02 study).
BMC Cancer. 2017 ;17:574.
- Kim S, François E, André T et al.
Docetaxel, cisplatin, and fluorouracil chemotherapy for metastatic or unresectable locally recurrent anal squamous cell carcinoma (Epitopes-HPV02): a multicentre, single-arm, phase 2 study.
Lancet Oncology 2018; 19(8):1094–1106.
- Kim S, Jary M, Mansi L et al.
DCF (docetaxel, cisplatin and 5-fluorouracil) chemotherapy is a promising treatment for recurrent advanced squamous cell anal carcinoma.
Annals of Oncology 2013; 24(12):3045–3050.
- Kim S, Meurisse A, Spehner L et al.
Pooled analysis of 115 patients from updated data of Epitopes-HPV01 and Epitopes-HPV02 studies in first-line advanced anal squamous cell carcinoma.
Therapeutic Advances in Medical Oncology 2020; 12:1758835920975356.
- Kim S, Spehner L, Cabel L et al.
[Squamous cell anal carcinoma. What's next ?].
Bull Cancer 2021; 108(1):80–89.
- Lonardi S, Pietrantonio F, Prete AA et al.
402MO Final results of the CARACAS study: Randomized phase II trial of avelumab alone or with cetuximab for unresectable, locally advanced or metastatic squamous cell anal carcinoma progressed to at least one line of treatment.
Annals of Oncology 2020; 31:S412.
- Magdeburg B, Fried M, Meyenberger C.
Endoscopic ultrasonography in the diagnosis, staging, and follow-up of anal carcinomas.
Endoscopy 1999;31:259-64.
- Marabelle A, Cassier PA, Fakih M et al.
Pembrolizumab for previously treated advanced anal squamous cell carcinoma: Pooled results from the KEYNOTE-028 and KEYNOTE-158 studies.
JCO 2020; 38(15_suppl):4020–4020.
- Moureau-Zabotto L, Vendrely V, Abramowitz L, Borg C, Francois E, Goere D, Huguet, F, Peiffert D, Siproudhis L, Ducreux M, Bouché O. Anal cancer: French Intergroup
Clinical Practice Guidelines for diagnosis, treatment and follow-up
(SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SNFCP).
Dig Liver Dis. 2017, Aug;49(8):831-840.
- Northover J, Meadows H, Ryan C et al..
In reply to Bosset JF, Pavy JJ, Roelofsen F, Bartelink H. Combined radiotherapy and chemotherapy for anal cancer.
Lancet. 1997 18;349:205-6.
- Ott PA, Piha-Paul SA, Munster P et al.
Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with recurrent carcinoma of the anal canal.
Annals of Oncology 2017; 28(5):1036–1041.
- Otto SD, Lee L, Buhr HJ et al .
Staging anal cancer : prospective comparison of transanal endoscopic ultrasound and magnetic resonance imaging.
J Gastrointest Surg. 2009;13 : 1292-8.
- Peiffert D, Créhange G, Vendrely V et al.
Radiothérapie des cancers du canal anal.
Cancer Radiother. 2016 Sep;20 Suppl:S183-8.
- Peiffert D, Giovannini M, Ducreux M, Michel P, et al.
High-dose radiation therapy and neoadjuvant plus concomitant chemotherapy with 5-fluorouracil and cisplatin in patients with locally advanced squamous-cell anal canal cancer : final results of a phase II study.
Ann Oncol. 2001; 12: 397-404.
- Peiffert D, Tournier-Rangeard L, Gérard JP et al.
Induction chemotherapy and dose intensification of the radiation boost in locally advanced anal canal carcinoma: final analysis of the randomized UNICANCER ACCORD 03 trial.
J Clin Oncol. 2012 ;30:1941-8.
- Pernot S et al.
Comparison of anal cancer screening strategies including standard anoscopy, anal cytology, and HPV genotyping in HIV-positive men who have sex with men.
Br J Cancer 2018.
- Pommier P, Mirabel X, Hannoun-Lévi JM, Malet C et al.
Curiethérapie du canal anal.
Cancer Radiother. 2013 ;17:143-50.
- Rao S, Capdevila J, Gilbert D et al.
LBA42 POD1UM-202: Phase II study of retifanlimab in patients (pts) with squamous carcinoma of the anal canal (SCAC) who progressed following platinum-based chemotherapy.
Annals of Oncology 2020; 31:S1170–S1171.
- Rao S, Sclafani F, Eng C et al.
International Rare Cancers Initiative Multicenter Randomized Phase II Trial of Cisplatin and Fluorouracil Versus Carboplatin and Paclitaxel in Advanced Anal Cancer: InterAAct.
JCO 2020; 38(22):2510–2518.
- Saint A, Evesque L, François E.
Les carcinomes épidermoïdes métastatiques du canal anal : prise en charge actuelle et perspectives.
Bull Cancer 2020; 107(7-8):792–799.
- Spehner L, Boustani J, Cabel L et al.
Present and Future Research on Anal Squamous Cell Carcinoma.
Cancers (Basel) 2021.
- Stouvenot M, Vuitton L, Meurisse A et al.
Prise en charge du carcinome épidermoïde avancé du canal anal.
Hépato-Gastro & Oncologie Digestive, 2020; 27(9): 873–881.
- Van K Morris MD, MD MES, MD HN et al.
Nivolumab for previously treated unresectable metastatic anal cancer (NCI9673): a multicentre, single-arm, phase 2 study.
Lancet Oncology 2017; 18(4):446–453.