Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 27 janvier 2022.
- Cette référence concerne les carcinomes épidermoïdes in situ et invasifs de l'œsophage.
- Elle contient des arbres de décision en fonction de l'extension tumorale (Cf. classifications) ainsi que les principes de prise en charge diagnostique et thérapeutique.
- Réalisé dans le cadre du bilan initial, il repose sur l'interrogatoire, l'examen clinique du patient et l'endoscopie œsophagienne avec biopsies.
- Etat général OMS
- Poids actuel, poids habituel
- % d'amaigrissement
- Degré de dysphagie avec date de début
- Douleurs thoraciques
- Modification de la voix
- Antécédents personnels : reflux gastro-œsophagien ? autre ?
- Consommation d'alcool (g/j) et de tabac (paquet-année).
- Rechercher :
- des adénopathies cervicales et/ou sus-claviculaires
- des signes de cirrhose
- des signes d'artérite
- des signes de neuropathie
- des stigmates d'une insuffisance respiratoire (ongles, cyanose...)
- d'autres tares associées.
- Evaluer l'état dentaire.
- description précise :
- de la position de la tumeur : par rapport aux arcades dentaires et si possible, par rapport à la bouche de Killian
- du pourcentage de circonférence atteinte
- si la lésion est franchissable, description :
- de la longueur de la lésion
- de la position du cardia
- de l'état de l'estomac
- Interrogatoire et examen clinique
- Consultation cardiologique avant radiochimiothérapie et/ou chirurgie.
- Scanner cervico-thoraco-abdomino-pelvien avec injection
- Consultation ORL : recherche
- d'une 2ème localisation
- d'une paralysie récurrentielle
- Fibroscopie bronchique : recherche d'envahissement trachéo-bronchique ou d'une deuxième localisation si un traitement à visée curative est envisagé.
- TEP-TDM au 18F-FDG, en particulier pour les carcinomes épidermoïdes curables pour éliminer une maladie métastatique et pour préciser les champs de radiothérapie.
- Index de masse corporelle (IMC)
| IMC = | Poids (kg) / (Taille x Taille) (en mètre) |
- Index de Buzby ou Nutritional Risk Index (NRI)
| Nutritional Risk Index (NRI) = | 1,519 x albuminémie (g/L) + [41,7 x (poids actuel/poids de forme)] |
Exemple :
Patient pesant 63 kg et ayant un poids de forme de 70 kg et albuminémie = 30g/L.
NRI = 1,519 x 30 + [41,7 x (63/70)] = 83,1.
- Patients répartis en 3 classes :
- absence de dénutrition : NRI >97,5
- dénutrition moyenne : 83,5 ≤ NRI ≤ 97,5
- dénutrition sévère : NRI <83,5
- Consultation diététique systématique : en cas de projet chirurgical, la gastrostomie est à éviter, la jéjunostomie est à privilégier
- Classification OMS de l'état général :
- 0 : capable d'une activité identique à celle précédant la maladie, sans aucune restriction
- 1 : activité physique diminuée mais ambulatoire et capable de mener un travail
- 2 : ambulatoire et capable de prendre soin de soi, incapable de travailler. Alité <50 % de son temps
- 3 : capable de seulement quelques soins personnels. Alité >50 % de son temps
- 4 : incapable de prendre soin de lui-même, alité ou chaise en permanence.
(Stahl, 2005 ; Lightdale, 2005 ; Vazquez-Sequeiros, 2003 ; Van Westreenen, 2004 ; Pimentel-Nunes, 2015)
- Echoendoscopie œsophagienne si cancer non sténosant et non métastatique, éventuellement avec ponction pour déterminer le stade N si celui-ci modifie la stratégie thérapeutique. En cas de lésion superficielle potentiellement résécable en endoscopie, l’échoendoscopie n’est pas nécessaire et un avis en centre expert est préférable d’emblée avec endoscopie haute définition et chromoendoscopie (virtuelle et/ou lugol) (lésion T1) (Pimentel-Nunes, 2015).
- Echographie cervicale et sus-claviculaire + ponction si adénopathie.
- IRM hépatique si examen scanographique douteux.
- Si suspicion de métastase(s) osseuse(s), scintigraphie osseuse sur caméra hybride (acquisition planaire et SPECT/TDM) puis TEP-TDM au 18F-FDG si doute sur la scintigraphie osseuse.
- Scanner cérébral en cas de signe(s) d'appel(s).
Elles s'appliquent uniquement aux carcinomes.
1 - L'œsophage cervical
- Il commence au bord inférieur de l'hypopharynx, au bord inférieur du cartilage cricoïde, et finit à l'entrée dans le thorax (creux sus-sternal), approximativement à 18 cm des incisives supérieures.
2 - L'œsophage intra-thoracique
- Tiers supérieur : de l'orifice supérieur du thorax à la bifurcation trachéale, à 24 cm des incisives supérieures.
- Tiers moyen : sous la bifurcation trachéale, de 24 à 32 cm des incisives supérieures.
- Tiers inférieur : de 32 à 40 cm approximativement des incisives supérieures (incluant l'œsophage abdominal).
3 - La jonction œsogastrique
- Les tumeurs de la jonction œsogastrique sont considérées comme des cancers de l'œsophage sauf si leur épicentre est dans l'estomac à plus de 5 cm de la jonction œsogastrique ou si l'épicentre est gastrique à moins de 5 cm de la jonction œsogastrique mais sans extension œsophagienne.
- Elle est classée à l'aide d'un examen clinique, de l'imagerie, de l'endoscopie (incluant une bronchoscopie) et/ou de l'exploration chirurgicale.
| T | |
| Tx | Le statut tumoral ne peut être évalué |
| T0 | Pas de signe de tumeur primitive |
| Tis | Carcinome in situ ou dysplasie de haut grade |
| T1 | Tumeur envahissant la lamina propria, la muscularis mucosae ou la sous-muqueuse |
| T1a | La tumeur envahit la lamina propria ou la muscularis mucosae |
| T1b | La tumeur envahit la sous-muqueuse |
| T2 | Tumeur envahissant la musculeuse |
| T3 | Tumeur envahissant l'adventice |
| T4 | Tumeur envahissant les structures adjacentes |
| T4a | La tumeur envahit la plèvre, le péricarde, la veine azygos, le diaphragme ou le péritoine |
| T4b | La tumeur envahit d'autres structures adjacentes comme l'aorte, un corps vertébral ou la trachée. |
- Les adénopathies cervicales, thoraciques et abdominales supérieures, y compris cœliaques, sont considérées comme régionales. Seules les adénopathies sus-claviculaires et les adénopathies lombo-aortiques sont considérées comme métastatiques.
| N | |
| Nx | Le statut des ganglions régionaux ne peut être évalué |
| N0 | Pas de signe d'atteinte des ganglions lymphatiques régionaux |
| N1 | Métastases dans 1 à 2 ganglions lymphatiques régionaux |
| N2 | Métastases dans 3 à 6 ganglions lymphatiques régionaux |
| N3 | Métastases dans 7 ganglions régionaux ou plus |
| pN0 | L'examen histologique d'une pièce opératoire de lymphadénectomie incluera habituellement 6 ganglions lymphatiques ou plus. Classer pN0 même si le nombre préconisé de ganglions réséqués n'est pas atteint. |
0
| M | |
| M0 | Pas de métastase à distance |
| M1 | Présence de métastase(s) à distance |
Symbole c : le signe TNM ou cTNM correspond à la classification clinique pré-thérapeutique, résultat de l'examen clinique, de l'imagerie, de l'endoscopie, des biopsies et des autres examens complémentaires.
Symbole y : dans tous les cas où la classification est effectuée durant ou après traitement néo-adjuvant, le cTNM ou le pTNM est précédé du préfixe y.
Symbole p : le pTNM correspond à la classification histologique postopératoire, complétée ou modifiée par les observations supplémentaires recueillies au cours de l'acte chirurgical et de l'examen histopathologique.
| Stades | T | N | M |
| Stade 0 | Tis | N0 | M0 |
| Stade IA | T1a | N0 | M0 |
| Stade IB | T1b | N0 | M0 |
| Stade IIA | T2 | N0 | M0 |
| Stade IIB | T1 | N1 | M0 |
| T3 | N0 | M0 | |
| Stade IIIA | T1 | N2 | M0 |
| T2 | N1 | M0 | |
| Stade IIIB | T2 | N2 | M0 |
| T3 | N1,N2 | M0 | |
| T4a | N0,N1 | M0 | |
| Stade IVA | T4a | N2 | M0 |
| T4b | Tous N | M0 | |
| Tous T | N3 | M0 | |
| Stade IVB | Tous T | Tous N | M1 |
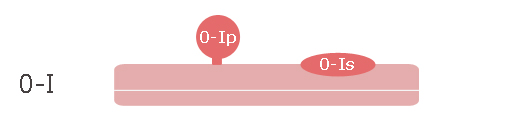
- 0.Ip : lésion en relief, pédiculée
- 0.Is : lésion en relief, sessile


- 0.IIa : lésion plane légèrement surélevée, la hauteur étant inférieure à la hauteur des cuillers d’une pince à biopsie fermée (2,5 mm)
- 0.IIb : lésion plane non surélevée, repérable par son caractère dyschromique

- 0.IIc : lésion plane légèrement déprimée

- 0.III : lésion creusante
- m1 (Tis) : intra-épithélial (= in situ)
- m2 (pT1a) : atteinte de la lamina propria
- m3 (pT1a) : atteinte de la musculaire muqueuse
- sm1 (pT1b) : atteinte du premier tiers de la sous-muqueuse, évaluée à 200 µm pour les lésions épidermoïdes
- sm2 (pT1b) : atteinte du 2ème tiers de la sous-muqueuse
- sm3 (pT1b) : atteinte du 3ème tiers de la sous-muqueuse
La mesure s'effectue depuis la face profonde de la musculaire muqueuse jusqu'à la partie la plus profonde du cancer.
- Données socio-démographiques
- Etat général OMS
- Poids habituel et perte de poids, index de masse corporelle (IMC)
- Antécédents majeurs, en particulier cardiovasculaires et respiratoires
- Si cirrhose, score de Child
- Endoscopie œsophagienne avec localisation exacte de la tumeur (par rapport à la bouche œsophagienne, aux arcades dentaires, au cardia), précision sur la nature de l'endoscopie (chromoendoscopie ou non) et l'anatomo-pathologie (biopsies, type de résection endoscopique)
- Fibroscopie bronchique
- Examen ORL
- Scanner cervico-thoraco-abdomino-pelvien
- TEP-TDM au 18F-FDG si non métastatique
- Compte-rendu anatomo-pathologique (biopsie ou pièce opératoire)
- Compte-rendu opératoire (si patient déjà opéré).
(Endo, 2000 ; Vieth, 2006 ; Cho, 2014)
- La résection muqueuse en monobloc est le traitement de référence en cas de carcinome in situ (Tis de la classification TNM ou T1m1) ou microinvasif (T1m2) bien ou moyennement (grade 1 ou 2) différencié avec absence d'embole lymphatique et/ou veineux.
- Pour être efficace et éviter les récidives locales, la résection doit être effectuée de préférence de manière complète en monobloc.
- La technique de dissection sous-muqueuse (ESD) est la technique de référence. Les meilleures indications sont les cancers intramuqueux classés T1m1 et T1m2 et à la morphologie favorable (0-II) dans la classification de Paris. Le risque d'invasion sous-muqueuse est estimé à :
- 79 % pour les lésions 0-I
- 48 % pour les lésions 0-IIa
- 15 % pour les lésions 0-IIb
- 27 % pour les lésions IIc
- 84 % pour les lésions classées 0-III.
(Endoscopy, 2005)
- Pour les lésions de moins de 10 mm, la résection par mucosectomie reste une option.
- La technique de dissection sous-muqueuse (ESD) est la technique de référence. Les meilleures indications sont les cancers intramuqueux classés T1m1 et T1m2 et à la morphologie favorable (0-II) dans la classification de Paris. Le risque d'invasion sous-muqueuse est estimé à :
- Les critères de succès de la résection sont définis par des marges de résection profondes saines, la limitation de la lésion au niveau de la muqueuse (m1, m2) et le caractère bien ou moyennement différencié en histologie. Si l'examen de la pièce révèle une atteinte au-delà de T1m3 ou des emboles veineux ou lymphatiques, un traitement complémentaire par chirurgie ou par radiochimiothérapie doit être proposé en raison du risque d'extension ganglionnaire (au moins 8 % pour T1m3, 8 à 50 % pour T1sm1).
-
En cas de haut risque chirurgical ou de refus du patient après la consultation chirurgicale, une surveillance peut être envisagée pour les lésions T1m3 ou T1sm1 sans embole, sans budding, bien ou moyennement différenciées.
- type de préparation
- type d’endoscope
- chromoendoscopie
- situation exacte de la lésion par rapport à la bouche œsophagienne, aux arcades dentaires, au cardia. Face, surface, type de résection, marges...
Compte-rendu anatomo-pathologique
- Le compte-rendu doit contenir plusieurs renseignements :
- le type histologique selon l'OMS et le grade de différenciation
- le degré d'infiltration tumorale par rapport à la musculaire muqueuse si elle est clairement identifiée, en se référant à la classification pTNM et à la classification japonaise (de Paris) (Kitagawa, 2017)
- classification histologique :
- pTis = m1 = carcinome in situ
- pT1a = m2 = infiltration de la lamina propria
- pT1a = m3 = infiltration de la musculaire muqueuse sans la franchir
- pT1b = infiltration de la sous-muqueuse : mesurer l'extension tumorale en profondeur au micromètre à partir de la musculaire muqueuse. Une infiltration tumorale inférieure ou égale à 200 µm est classée en sm1 selon la classification japonaise (de Paris).
- l'absence ou la présence d'invasion lymphatique (L+ ou -) et/ou vasculaire (V+ ou -)
- la qualité de l'exérèse profonde (saine, électrocoagulée non interprétable, tumorale)
- la qualité de l'exérèse latérale (saine, non appréciable car électrocoagulée ou mucosectomie fragmentée, en zone lésionnelle (en précisant : zone de carcinome ou de dysplasie)).
(Akiyama, 1994 ; Hofstetter, 2002 ; Hulscher, 2002)
- Cette référence a été élaborée en intégrant la recommandation produite par la Société Française de Chirurgie Digestive (SFCD) et l'Association de Chirurgie Hépatobiliaire et de Transplantation Hépatique (ACHBT) intitulée "Cancérologie digestive : pratiques chirurgicales". Elle a reçu le label INCa-HAS en février 2009. Le texte argumenté des recommandations (version longue) est disponible sur le site de l'INCa ainsi qu'une version synthétique.
- Score ASA
- Etat nutritionnel avec pré-albuminémie
- Exploration fonctionnelle respiratoire et gazométrie
- ECG et avis cardiologique
- Bilan de coagulation
- Bilan hépatique avec albuminémie, score de Child
- Score G8 permettant de sélectionner les patients âgés nécessitant une évaluation oncogériatrique (G8 ≤ 14).
- La prise en charge chirurgicale des carcinomes de l'œsophage relève d'un centre de référence
- Renutrition préopératoire et immunonutrition
- Sevrage alcool/tabac
- Kinésithérapie respiratoire préopératoire
- Œsophagectomie :
- La voie d’abord de l’œsophagectomie doit être adaptée à la localisation du pôle supérieur de la tumeur (marge supérieure de 8 cm) avec curage adapté à la localisation (2 ou 3 champs).
- La possibilité de réaliser un examen extemporané est souhaitable.
- Une voie transthoracique associée à une laparoscopie (double voie : Lewis-Santy) ou à une laparotomie et à une cervicotomie (triple voie : Mac Keown, Akiyama) sont les voies d’abord permettant d’adapter au mieux le curage.
- La voie d’abord transhiatale exclusive ainsi que la thoraco-phréno (± laparotomie) gauche selon Sweet ne sont, par conséquent, pas recommandées pour les carcinomes épidermoïdes de l’œsophage.
- Le pronostic étant corrélé au nombre de ganglions analysés, il est recommandé de prélever 23 ganglions (abdomen et thorax).
- La valeur du nombre de ganglions prélevés disparaît après radiochimiothérapie.
- Œsophagectomie subtotale avec plastie colique.
- Œsophagectomie minimale invasive (laparoscopie et thoracoscopie) est en voie d'évaluation.
- ± Jéjunostomie d'alimentation peropératoire au cours de l'œsophagectomie si elle n'a pas été mise en préopératoire.
- Des critères de qualité ont été définis par l'Institut National du Cancer.
- Visualiser ou télécharger le contenu minimum des comptes-rendus anatomo-pathologiques pour les tumeurs de l’œsophage élaboré par l'INCa en lien avec la Société Française de Pathologie.
Pièces opératoires :
- Classification histologique OMS 2010 :
- Carcinome épidermoïde :
- néoplasie intra-épithéliale de haut grade = carcinome épidermoïde in situ
- carcinome épidermoïde bien différencié
- carcinome épidermoïde moyennement différencié
- carcinome épidermoïde peu différencié.
- Variantes histologiques :
- carcinome verruqueux
- carcinome à cellules fusiformes (ou carcinome sarcomatoïde ou carcinosarcome)
- carcinome basaloïde.
- Carcinome indifférencié (expression en immunohistochimie des marqueurs de différenciation épidermoïde)
- Carcinome épidermoïde :
- Extension tumorale : classification histopathologique pTNM 8ème édition 2017.
- Nécessité d'un état général conservé OMS 0-2.
- Renutrition.
- Mise en état dentaire.
- Évaluation de l'état cardiovasculaire avec ECG.
- Dosage de l'uracilémie si chimiothérapie par 5-FU envisagée.
- Pour le détail des chimiothérapies, voir aussi le thésaurus.
- Nutrition par voie entérale : sonde nasogastrique à privilégier si difficultés alimentaires. Option : Jéjunostomie. Eviter la GEP si le patient est potentiellement opérable.
- Surveillance au minimum hebdomadaire du poids.
- Rx de plus de 10 MV, dosimétrie sur scanner, étalement et fractionnement classiques : 1,8 à 2 Gy/fraction, 5 fractions/semaine.
- Recommandation (tiers inférieur de l'œsophage) : patient 3 heures à jeun avant le scanner dosimétrique et les séances de radiothérapie.
- Volume cible anatomo-clinique (Lazarescu, 2013) : tumeur avec marges de 3 à 5 cm de part et d'autre en hauteur et 1 à 2 cm latéralement et en antéropostérieur ; marges adaptées aux contraintes dosimétriques pour les organes à risque.
- Radiothérapie Conformationnelle en Modulation d'Intensité (RCMI) (non validée par la HAS).
- Scanner 4D (en particulier pour les tiers inférieurs de l'œsophage).
- Réduction du volume cible après 45 à 50 Gy.
(Van Hagen, 2012 ; Shapiro, 2015 ; Mariette, 2014)
- L’essai néerlandais de phase III (Essai CROSS) a inclus des patients avec un cancer de l’œsophage (75 % d’adénocarcinomes et 23 % de carcinomes épidermoïdes) cT1N1 ou cT2-T3 N0-1 M0 (84 % de stade T3, 65 % de stade N1) et randomisés entre radiochimiothérapie néo-adjuvante (41,4 Gy en 23 fractions de 1,8 Gy + carboplatine-paclitaxel hebdomadaire, 5 semaines) suivie d’une chirurgie ou chirurgie seule. Après une médiane de suivi de 84,1 mois, la médiane de survie globale était de 48,6 mois dans le groupe radiochimiothérapie néo-adjuvante puis chirurgie et de 24 mois dans le groupe chirurgie seule.
La médiane de survie pour les carcinomes épidermoïdes était de 81,6 mois dans le groupe radiochimiothérapie + chirurgie versus 21,1 mois dans le groupe chirurgie seule. L'intérêt de la radiochimiothérapie néo-adjuvante n'est pas démontré pour les tumeurs de stade I et II minoritaires (25 %) (Shapiro, 2015).
- L’essai FFCD 9901 a comparé, pour des cancers de l’œsophage de stade I (19 %) et II (53,3 % de stade IIa et 27,7 % de stade IIb), la chirurgie seule à un traitement par radiochimiothérapie suivie de chirurgie (45 Gy en 25 fractions sur 5 semaines avec une chimiothérapie par 5-FU 800 mg/m2 et cisplatine 75 mg/m2). La radiochimiothérapie n’augmente pas le taux de résection R0 ou le taux de survie mais augmente la mortalité (Mariette, 2014).
- Modalités de radiochimiothérapie :
- 41,4 Gy en 23 fractions (5 fractions/semaine) chaque semaine pendant 5 semaines :
- paclitaxel 50 mg/m² avec prémédication
- carboplatine AUC 2.
- 41,4 Gy en 23 fractions (5 fractions/semaine) chaque semaine pendant 5 semaines :
- Adaptation de doses :
- selon hémogramme au jour du traitement : si leucocytes <1 000/mm3 ou plaquettes <50 000/mm3, report d'une semaine jusqu'à récupération
- si neutropénie fébrile ou hémorragie sévère ou transfusion plaquettaire, arrêt de la chimiothérapie
- mucite ou vomissements : report d'une semaine.
Radiothérapie :
- 50,4 Gy en 28 fractions de 1,8 Gy ou 50 Gy en 25 fractions de 2 Gy.
Chimiothérapie :
- 5-Fluorouracile continu + oxaliplatine (FOLFOX modifié).
- Options : se référer au thésaurus.
- Hémogramme avec plaquettes, créatininémie avant chaque cure.
Evaluation de la réponse :
- 6 à 8 semaines après la fin de la radiochimiothérapie, évaluation par fibroscopie œsogastroduodénale et scanographie cervico-thoraco-abdominale. Le patient est considéré comme en réponse complète endoscopique si tout le site tumoral est visible lors de l'endoscopie et qu'il n'y a ni ulcération ni bourgeonnement, ni autre lésion à l'endoscopie. En cas d'anomalie, les lésions doivent être biopsiées. La présence de biopsies positives fera discuter en RCP une chirurgie de rattrapage s'il n'y a pas de signe d'évolution à distance. En cas de doute et avec biopsies négatives, il est conseillé de répéter les biopsies avec un contrôle endoscopique et scanographique.
- Un PET-Scan est souvent utile dans cette situation.
- 60 Gy (à 66 Gy : essai thérapeutique CONCORDE).
- Réduction du volume cible après 44 à 50 Gy.
-
Si maladie résiduelle après une radiochimiothérapie néo-adjuvante antérieure et une résection complète (R0 post-chirurgie), immunothérapie adjuvante par nivolumab dans les 4 à 16 semaines, pendant un an au plus.
- Dans tous les cas, une prise en charge nutritionnelle est indispensable ainsi qu'un sevrage en alcool et tabac.
- Sept situations de prise en charge :
- cancers in situ Tis (m1) ou microinvasif (T1m2, T1m3)
- tumeur invasive à partir du stade T1sm1
- stade T1 ou T2, N0
- stade T1N1, stade T2N1 ou T3N0
- stade T3N1 ou T4 et œsophage cervical ou du tiers supérieur
- cancer de l’œsophage associé à un cancer des voies aéro-digestives supérieures
- maladie métastatique viscérale.
- C'est-à-dire Tis ou T1a selon la classification TNM.
Chirurgie
radiochimiothérapie
Chimiothérapie
-
Soit radiochimiothérapie exclusive : FOLFOX + RT sans dépasser 50,4 Gy (1,8 à 2 Gy/fraction en 25 à 30 fractions).
-
Si persistance tumorale prouvée après la fin de la radiochimiothérapie ou récidive locorégionale après une réponse apparemment complète : chirurgie de rattrapage dans un centre spécialisé.
-
Soit radiochimiothérapie néo-adjuvante suivie d’une chirurgie dans un centre expert, puis immunothérapie adjuvante par nivolumab en cas de résidu tumoral et résection R0.
- Radiochimiothérapie concomitante de première intention.
- En cas d’envahissement trachéo-bronchique ou de fistule, discuter la pose d’une prothèse œsophagienne et trachéo-bronchique et la réalisation d’une chimiothérapie préalable.
- Discuter résection dans un centre expert en l’absence de réponse complète, si une résection R0 est a priori possible.
- Pas de standard.
- Décision pluridisciplinaire en RCP dépendant de la taille, de l'extension et du pronostic des lésions. Si les 2 lésions sont curables, envisager le traitement curatif des 2 lésions.
- Elle a pour objectif :
- la poursuite du sevrage alcoolo-tabagique
- la recherche d'une 2ème localisation ORL ou œsophagienne
- la surveillance de l'état nutritionnel
- La recherche systématique de métastases à distance n'a pas d'intérêt démontré.
- Surveillance clinique : poids, examen clinique, dysphagie.
- Sevrage alcool/tabac.
- Endoscopie œsophagienne annuelle.
- Examen ORL annuel, à la recherche d'un cancer métachrone.
- Autres examens complémentaires seulement si signes d'appel ou facteurs de risque.
En cas de traitement curatif, surveillance par scanner tous les 4 à 6 mois et endoscopie annuelle avec coloration vitale ou virtuelle.
- Radiothérapie 50,4 Gy + 6 cures de FOLFOX modifié à 14 jours d'intervalle (3 cures pendant la radiothérapie débutant à J1, et 3 cures après la radiothérapie)
- FOLFOX modifié :
| Oxaliplatine 85 mg/m² à J1 Acide folinique 200 mg/m² à J1 5-Fluorouracile en bolus 400 mg/m2 à J1 5-Fluorouracile continu 800 mg/m2/jour à J1 et J2 |
(protocole du RTOG dit Herskovic, avec radiothérapie 50,4 Gy)
| 5-Fluorouracile 1 000 mg/m²/jour en perfusion continue de 96 h de J1 à J4 Cisplatine 75 mg/m² à J1 (avec hyperhydratation et antiémétiques) en 1 à 2 heures (ou 1 mg/min) Reprise à J29 ou à J22
|
- Schéma original d'Herskovic : chimiothérapie seminae 1, 5, 8 et 11
| Semaines | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Rayons | X | X | X | X | X | ||||||
| Chimiothérapie | X | X | X | X |
- Variante de Minsky : essai INT 123 (même efficacité et moins de reports de
traitement) : la chimiothérapie est effectuée au cours des semaines 1, 5, 9 et 12.
(selon publication de Minsky ci-dessus)
- Toxicité de grade 3-4 dans l'intercure
- Report d'une semaine
- Reprise lorsque la toxicité a diminué à un grade 2 ou moins.
- Modifications selon toxicité hématologique à la reprise de la cure
- Leucocytes >3 000/mm³ et plaquettes >75 000/mm³ : pleines doses
- Leucocytes entre 2 000/mm³ et 3 000/mm³, ou plaquettes entre 75 000/mm³ et 100 000/mm³ : demi doses de 5-Fluorouracile et de Cisplatine (poursuite de la radiothérapie à l'identique)
- Leucocytes <2 000/mm³ ou plaquettes <75 000/mm³ : interruption de la chimiothérapie et de la radiothérapie jusqu'à régression de la toxicité.
- Toxicité hématologique dans l'intercure
- Si leucocytes <1 000/mm³ ou plaquettes < 75 000/mm³ au nadir, réduction de dose de 25 % pour le 5-Fluorouracile et pour le Cisplatine.
- Toxicité rénale
- Si clearance à la créatinine entre 55 et 65 mL/min ou créatininémie entre 16 mg/L (141 μmol/L) et 20 mg/L (177 μmol/L) : réduction de dose de 50 % du Cisplatine
- Si clearance à la créatinine <55 mL/min : arrêt du Cisplatine et du 5-Fluorouracile jusqu'à amélioration de la fonction rénale. Poursuite de la radiothérapie.
- Mucite sévère grade 3-4
- Réduction de 25 % du 5-Fluorouracile pour le cycle suivant
- Interruption du 5-Fluorouracile pour le cycle s'il est en cours.
| 5-Fluorouracile 1000 mg/m²/jour en perfusion continue de 96 h de J2 à J5, Mitomycine C 10 mg/m² à J2 (dose maximale de 18 mg). 5-Fluorouracile continu 1000 mg/m²/jour en perfusion continue de 96 h de J29 à J32 -> Une seule dose de Mitomycine en tout ; pas de reprise de chimiothérapie après J32 |
Adaptations à J29
- Leucocytes entre 3 000 et 3 999/mm³ et/ou plaquettes entre 50 000 et
99 000/mm³ : réduire la dose de 5-Fluorouracile de 50 % - Leucocytes <3 000/mm³ ou plaquettes <50 000/mm³ : report d'une semaine
- Report d'une semaine si mucite
| Paclitaxel 50 mg/m² à J1, J8, J15, J22, J29 et J35, Carboplatine AUC 2. |
- 2 cures préopératoires de 5-Fluorouracile + Cisplatine
- Chirurgie si possible 3 à 5 semaines après le début de la dernière cure
- Critères d'adaptation de doses non publiés
| 5-Fluorouracile 1 000 mg/m²/jour en perfusion continue de J1 à J4 Cisplatine 80 mg/m² à J1 en 1 à 2 heures (avec hyperhydratation et antiémétiques) Reprise à J22 |
| Cisplatine 100 mg/m² IV à J1 en 2 heures (avec hyperhydratation et antiémétiques) 5-Fluorouracile 1000 mg/m²/jour en perfusion continue de J1 à J5 Nouvelle cure à J22 |
- A J22
- Si leucocytes <4 000/mm³ ou plaquettes <100 000/mm³ ou créatinine >15 mg/L : report d'une semaine, puis au besoin d'une 2ème, puis d'une 3ème semaine (maxi 3 semaines).
- Selon le nadir
- Leucocytes >999 et plaquettes >49 999/mm³: 100 % de 5-Fluorouracile et de Cisplatine
- Leucocytes <1 000 et plaquettes <50 000 : 50 % de 5-Fluorouracile et 75 % de Cisplatine
- Selon la fonction rénale à la 3ème semaine de report
- Si créatinine >29,99 mg/L (265 μmol/L) ou clearance <39,99 mL/mn : arrêt du traitement
- Si créatinine entre 15 et 29 mg/L (132 à 265 μmol/L) ou clearance entre 40 et 69 mL/mn : demi-doses de Cisplatine
- Toxicité muqueuse
- Mucite avec ulcères ou diarrhée de plus de 2 jours : demi-doses de 5-Fluorouracile
- Interactions médicamenteuses du Cisplatine
AINS, aminosides et tous les médicaments néphrotoxiques sont formellement contre-indiqués.
| Vinorelbine 25 mg/m² à J1 et J8 en bolus de 5 à 10 min Cisplatine 80 mg/m² à J1 en 30 min (avec hyper hydratation et antiémétiques), laxatif conseillé avec la vinorelbine, voie veineuse centrale nécessaire. Reprise du cycle à J22 |
| Vinorelbine 25 mg/m² hebdomadaire en bolus de 5 à 10 min (commencer à 20 mg/m² si cirrhose), laxatif conseillé, voie veineuse centrale nécessaire. |
|
Nivolumab 240 mg en 30 minutes toutes les 2 semaines pendant 16 semaines (8 doses),
Puis 480 mg en 30 minutes toutes les 4 semaines à partir de la semaine 17 pendant un an au total.
|
- Arrêt si récidive tumorale ou toxicité inacceptable.
- En cas de toxicité : pas d'adaptation de dose mais interruption ou report du traitement jusqu'à un maximum de 6 semaines.
Kelly RJ, Ajani JA, Kuzdzal J, et al.
Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer.
N Engl J Med. 2021;384(13):1191-1203.
-
BGB-A317-306 : Etude de phase III randomisée en double aveugle évaluant l'efficacité et l'utilisation du Tislelizumab (BGB-A317) en association avec une chimiothérapie de première ligne chez des patients présentant un carcinome épidemoïde de l'oesophage non résécable, localement avancé ou métastatique
- Status : Ouvert (11-12-2018 - 30-03-2021)
- Promoteur : BeiGene
-
CONCORDE - PRODIGE 26 : Essai de phase III randomisé évaluant l’efficacité d’une radiothérapie à dose élevée associée à une chimiothérapie de type FOLFOX-4, chez des patients ayant un cancer de l’oesophage
- Statut : Clos aux inclusions (06-11-2011 - 14-12-2021)
- Promoteur : Fédération Francophone de Cancérologie Digestive - Dijon
-
EDHITO : Etude randomisée contrôlée évaluant l’impact de l’EDucation THérapeutique du PatIent sur la TOxicité des inhibiteurs du checkpoint immunitaire en oncologie
- Statut : Ouvert (11-12-2019 - 11-12-2021)
- Promoteur : Institut de cancérologie de l'Ouest
-
ESOSTRATE - PRODIGE 32 : étude randomisée de phase 2-3 évaluant la chirurgie systématique par rapport à une surveillance simple pouvant être associée à une chirurgie de recours, chez des patients ayant un cancer de œsophage opérable en réponse clinique complète après une radio-chimiothérapie.
- Status : Ouvert (01-08-2015 - 30-03-2023)
- Promoteur : CHU Dijon
-
EXOMA : Etude exploratoire visant à évaluer l’impact d’une analyse du profil génétique par la technique « Next Generation sequencing » (NGS) à haut débit sur la décision thérapeutique chez des patients ayant une tumeur solide
- Statut : Ouvert (12-05-2016 - 26-06-2021)
- Promoteur : Centre Georges François Leclerc
-
FREGAT : Constitution d'une base de données clinico-biologique nationale française des cancers oeso-gastriques
- Status : Ouvert (01-06-2014 - 01-05-2027)
- Promoteur : CHU LILLE
-
KEYNOTE 975 / MK3475-975 : Etude de phase III évaluant l'efficacité et l'innocuité du pembrolizumab (MK-3475) par rapport au placebo chez les patients atteints de cancer de l’œsophage recevant une chimiothérapie définitive
- Statut : Ouvert (11-03-2020 - 21-02-2026)
- Promoteur : Merck Sharp & Dohme
-
MIME : Évaluation de la réponse d’imagerie métabolique multiorgane d’Abemaciclib
- Status : Ouvert (19-12-2018 - 15-10-2021)
- Promoteur : Institute Jules Bordet
-
MK-7902-014-01 / LEAP 14 : Etude randomisée de phase III évaluant l’efficacité et la sécurité du Pembrolizumab (MK-3475) plus Lenvatinib (E7080/MK-7902) plus chimiothérapie en comparaison avec le traitement standard comme traitement de première intention chez des participants atteints de carcinome métastatique de l'oesophage.
- Statut : Ouvert (30-12-2020 - 31-12-2024)
- Promoteur : MSD
- OSAGE : Etude multicentrique de phase I/II de radiochimiothérapie (carboplatine, paclitaxel et radiothérapie) dans les cancers de l’œsophage du sujet âgé
-
ORIENT : Étude de phase III, multicentrique, randomisée, en double aveugle, visant à évaluer l’efficacité et la sécurité du sintilimab versus placebo, associé à une chimiothérapie, dans le traitement de première ligne du carcinome épidermoïde de l’œsophage métastatique, récidivant ou localement avancé non résécable (ORIENT-15)
- Statut : Ouvert (01-10-2018 - 30-06-2025)
- Promoteur : Innovent Biologics (Suzhou) Co., Ltd.
-
PRODIGE 62 - OESIRI : Etude de phase II randomisée comparant l’efficacité de l’Onivyde® en association avec de l’acide folique et du 5-fluorouracile par rapport à celle du paclitaxel en traitement de deuxième intention chez les patients ayant un carcinome épidermoïde métastatique de l'oesophage.
- Statut : Ouvert (11-04-2019 - 15-07-2022)
- Promoteur : Federation Francophone de Cancerologie Digestive
-
PRODIGE 67 - ARION : Association de radiochimiothérapie et immunothérapie pour le traitement du cancer de l’œsophage non résécable : un essai randomisé comparatif de phase II
- Statut : Ouvert (05-12-2018 - 01-09-2024)
- Promoteur : UNICANCER
-
SKYSCRAPER-07 : Une étude de l’atezolizumab avec ou sans tiragolumab chez des participants atteints d’un carcinome épidermoïde œsophagien non résécable dont les cancers n’ont pas progressé après une chimioradiothérapie concomitante définitive (SKYSCRAPER-07)
- Statut : Ouvert (28-12-2020 - 26-12-2025)
- Promoteur : Hoffmann-La Roche
- STELLAR-001 : Etude de phase I évaluant l'innocuité, la tolérance et l'activité antitumorale du IPH5401 associé à du durvalumab chez des patients adultes ayant des tumeurs solides avancées sélectionnées
- Akiyama H, Tsurumaru M, Udagawa H et al.
Radical lymph node dissection for cancer of the thoracic esophagus.
Ann Surg. 1994;220 :364-72
- Altorki NK, Zhou XK, Stiles B et al.
Total number of resected lymph nodes predicts survival in esophageal cancer.
Ann Surg. 2008 ;248 :221-6
- Ando N, et al.
A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907).
- Bedenne L, Michel P, Bouché O et al.
Chemoradiation Followed By Surgery Compared With Chemoradiation Alone In Squamous Cancer of the Esophagus : FFCD 9102.
J Clin Oncol 2007;25:1160-8
- Bleiberg H, Conroy T, Paillot B, Lacave AJ, et al.
Randomised phase II study of cisplatin and 5-fluorouracil versus cisplatin alone in advanced squamous cell œsophageal cancer.
Eur J Cancer 1997;33:1216-20
- Cho JW, Choi SC, Jang JY et al.
Lymph Node Metastases in Esophageal Carcinoma: An Endoscopist's View.
Clin Endosc. 2014;47:523-9
- Conroy T, Galais MP, Raoul JL et al.
Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial.
Lancet Oncol. 2014 ;15:305-14
- Conroy T, Etienne PL, Adenis A, Ducreux M, et al.
Vinorelbine and cisplatin in metastatic squamous cell carcinoma of the oesophagus : response, toxicity, quality of life and survival.
Ann Oncol. 2002;13:721-9
- Conroy T, Etienne PL, Adenis A, Wagener DJ, et al.
Phase II trial of vinorelbine in metastatic squamous cell esophageal carcinoma. European Organisation for Research and Treatment of Cancer Gastrointestinal Treat Cancer Cooperative Group.
J Clin Oncol. 1996;14:164-70
- Cooper JS, et al.
Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01).
- Endo M, Yoshino K, Kawano T et al.
Clinicopathologic analysis of lymph node metastasis in surgically resected superficial cancer of the thoracic esophagus.
Dis Esophagus. 2000;13:125-9
- Endo M, Kawano T.
Detection and classification of early squamous cell esophageal cancer.
Dis Esophagus 1997; 10:155-8
- Endoscopic Classification Review Group.
Update on the paris classification of superficial neoplastic lesions in the digestive tract.
- Gaast AV, van Hagen P, Hulshof M et al.
Effect of preoperative concurrent chemotherapy on survival of patients with resectable esophageal or esophagogastric junction cancer: Results from a multicenter randomized phase III study.
J Clin Oncol 2010; 28, 302 S
- Gronnier C, Tréchot B, Duhamel A et al.
Impact of neoadjuvant chemoradiotherapy on postoperative outcomes after esophageal cancer resection: results of a European multicenter study.
Ann Surg. 2014 ;260:764-70
- Herskovic A, Martz K, al-Sarraf M, Leichman L, et al.
Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus.
N Engl J Med 1992 ;326:1593-8
- Hofstetter W, Swisher SG, Correa AM et al.
Treatment outcomes of resected esophageal cancer.
Ann Surg. 2002;236:376-84
- Honing J, Smit JK, Muijs CT et al.
A comparison of carboplatin and paclitaxel with cisplatinum and 5-fluorouracil in definitive chemoradiation in oesophageal cancer patients.
Ann Oncol 2014 ; 25:638-643
- Hulscher JB, van Sandick JW, de Boer AG et al.
Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus.
N Engl J Med 2002;347:1662-9
- Jong-Mu Sun et al.
Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study.
Lancet. 2021; 398(10302):759-71
- Kelly RJ, et al.
Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer.
- Kato K et al.
Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3) : a multicentre, randomised, open-label, phase 3 trial.
Lancet oncol. 2019; 20 :1506-17
- Kelly RJ, Ajani JA, Kuzdzal J, et al.
Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer.
- Kitagawa Y, Uno T, Oyama T, et al.
Esophageal cancer practice guidelines 2017 edited by the Japan Esophageal Society: part 1.
- Kojima T et al.
Randomized Phase III KEYNOTE-181 Study of Pembrolizumab Versus Chemotherapy in Advanced Esophageal Cancer;
J Clin Oncol. 2020; 38(35):4138-48 - Lazarescu I, Thureau S, Nkhali L et al.
Définiton du volume cible anatomoclinique pour l'irradiation des cancers de l'œsophage.
Cancer Radiother. 2013;17:453-60 - Lightdale CJ, Kulkarni KG.
Role of endoscopic ultrasonography in the staging and follow-up of esophageal cancer.
J Clin Oncol 2005;23:4483-9
- Mariette C, Alves A, Benoist S et al.
Perioperative care in digestive surgery. Guidelines for the French society of digestive surgery (SFCD).
Ann Chir. 2005 ;130:108-24
- Mariette C Piessen G, Briez N et al.
The number of metastatic lymph nodes and the ratio between metastatic and examined lymph nodes are independent prognostic factors in esophageal cancer regardless of neoadjuvant chemoradiation or lymphadenectomy extent.
Ann Surg. 2008 ;247:365-71
- Mariette C, Meunier B, Pezet D et al.
Hybrid minimally invasive versus open oesophagectomy for patients with oesophageal cancer: A multicenter, open-label, randomized phase III controlled trial, the MIRO trial.
J Clin Oncol 2015, 33(suppl 3; abstr 5)
- Mariette C, et al.
Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer: final analysis of randomized controlled phase III trial FFCD 9901.
- Medical Research Council œsophageal Cancer Working Group.
Surgical resection with or without preoperative chemotherapy in œsophageal cancer : a randomised controlled trial.
Lancet 2002;359:1727-33
- Minsky BD, Pajak TF, Ginsberg RJ et al.
INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy.
J Clin Oncol 2002;20:1167-74
- Pasquer A, Renaud F, Hec F et al.
Is Centralization Needed for Esophageal and Gastric Cancer Patients With Low Operative Risk?: A Nationwide Study.
Ann Surg. 2016;264:823-830
- Peyre CG, Hagen JA, DeMeester SR et al.
Predicting systemic disease in patients with esophageal cancer after esophagectomy: a multinational study on the significance of the number of involved lymph nodes.
Ann Surg. 2008 ;248:979-85
- Pimentel-Nunes, Pedro, et al.
« Endoscopic Submucosal Dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline ».
Endoscopy, vol. 47, no 09, août 2015, p. 829‑54
- Stahl M, Kataja VV, Oliveira J ; ESMO Guidelines Task Force.
ESMO Minimal Clinical Recommendations for diagnosis, treatment and follow-up of esophageal cancer.
Ann Oncol 2005;16 Suppl 1:i26-7
- Smith TJ, Ryan LM, Douglass HO Jr et al.
Combined chemoradiotherapy vs. radiotherapy alone for early stage squamous cell carcinoma of the esophagus: a study of the Eastern Cooperative Oncology Group.
Int J Radiat Oncol Biol Phys 1998;42:269-76
- Shapiro J, van Lanschot JJB, Hulshof MCCM, van Hagen P, et al. CROSS study group.
Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial.
- Stahl M, Stuschke M, Lehmann N et al.
Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus.
J Clin Oncol. 2005;23:2310-7
- The Paris endoscopic classification of superficial neoplastic lesions : esophagus, stomach, and colon : november 30 to december 1, 2002.
Gastrointest Endosc. 2003;58(6 Suppl):S 3-43
- Thomas CR, Berkey BA, Minsky BD et al.
Recursive partitioning analysis of pretreatment variables of 416 patients with locoregional esophageal cancer treated with definitive concomitant chemoradiotherapy on Intergroup and Radiation Therapy Oncology Group trials.
Int J Radiat Oncol Biol Phys 2004;58:1405-10
- Thirion PG, Michiels S, Le Maître A et al, on behalf of the MetaAnalysis of Chemotherapy in Esophagus Cancer Collaborative Group.
Individual patient data-based meta-analysis assessing pre-operative chemotherapy in resectable œsophageal carcinoma.
J Clin Oncol. 2007;25, 18S (Suppl. Part I):résumé 4512
- Urschel JD, Vasan H.
A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer.
Am J Surg 2003;185:538-43
- Van Hagen P, Hulshof MC, van Lanschot JJ et al.
Preoperative chemoradiotherapy for esophageal or junctional cancer.
N Engl J Med. 2012;366:2074-84
- Van Heijl M, van Lanschot JJ, Koppert LB et al.
Neoadjuvant chemoradiation followed by surgery versus surgery alone for patients with adenocarcinoma or squamous cell carcinoma of the esophagus (CROSS).
BMC Surgery 2008;8:21
- Van Westreenen, Westerterp M, Bossuyt PM et al.
Systematic review of the staging performance of 18F-fluorodeoxyglucose positron emission tomography in esophageal cancer.
J Clin Oncol. 2004;22:3805-12
- Vazquez-Sequeiros E, Wiersema MJ, Clain JE et al.
Impact of lymph node staging on therapy of esophageal carcinoma.
Gastroenterology 2003;125:1883 - 6
- Vieth M, Rösch T.
Endoscopic mucosal resection and the risk of lymph-node metastases: indications revisited?
Endoscopy. 2006 ;38:175-9
- Wong RK, Malthaner RA, Zuraw L et al.
Combined modality radiotherapy and chemotherapy in nonsurgical management of localized carcinoma of the esophagus: a practice guideline.
Int J Radiat Oncol Biol Phys 2003;55:930-42


