Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels des Réseaux Régionaux de Cancérologie de Bourgogne-Franche-Comté (ONCOBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 29 janvier 2024.
- Les cancers invasifs de la vulve sont peu fréquents, représentant moins de 5 % des cancers gynécologiques. Ce chapitre concerne les carcinomes épidermoïdes de la vulve.
- Ils surviennent le plus souvent chez des femmes âgées de plus de 70 ans mais il existe un premier pic d'incidence entre 40 et 60 ans.
- Les facteurs de risque sont :
- Cancers induits par les papillomavirus oncogènes (HPV) :
- Les lésions intra-épithéliales épidermoïdes vulvaires (VIN) ou cervicales associées à l’HPV
- Le tabac
- L’immunodépression (HIV, HSV, les traitements immumodulateurs…)
- Cancers indépendants aux papillomavirus oncogènes (HPV) :
- Les dermatoses et dystrophies vulvaires chroniques comme le lichen scléreux de la vulve (LSV)
- Les lésions intra-épithéliales de la vulve différenciées (dVIN)
- Cancers induits par les papillomavirus oncogènes (HPV) :
- Les circonstances de découverte ne sont pas spécifiques.
- Le stade fréquemment avancé de la maladie chez des femmes dont l’état général est plus ou moins altéré rend le traitement difficile.
- La présence fréquente de comorbidités est à prendre en compte avant toute décision thérapeutique.
- L’évolution des cancers vulvaires reste longtemps locorégionale : les métastases ganglionnaires sont précoces.
- Une consultation d’oncogériatrie est nécessaire pour les patientes de plus de 75 ans ou ayant un score G8 ≤ 14.
- Le traitement du LSV nécessite un traitement de longue durée par dermocorticoïdes de classe forte :
- clobétasol (DERMOVAL®)
- bétaméthasone (DIPROLENE®)
- La réponse au traitement doit être contrôlée à 3 mois, en cas de réponse thérapeutique incomplète : biopsie(s) impérative(s).
Source : Recommandations pour la Pratique Clinique du Collège national des Gynécologues-Obstétriciens Français 2022
|
1986 ISSVD
2003 OMS
|
2004 ISSVD | 2012 LAST |
2015 ISSVD
2014 OMS
|
2020 OMS |
|
VIN
Type squameux 1) VIN I 2) VIN II 3) VIN III 1) VIN différenciée
|
VIN
Flat condylome ou effet HPV VIN de type usuel : 1) Warty type
2) Type basaloid 3) Type mixte VIN de type différencié
|
Lésions intraépithéliales :
|
Vulvar squamous intraepithelial lesion (SIL)
|
Vulvar squamous intraepithelial lesion (SIL) :
|
- Arrêt du tabac+++.
- Vaccination prophylactique en option (faible niveau de preuve)
(RPC 2022).
- Vulvectomie partielle superficielle avec marges macroscopiques de 3 mm et la pièce opératoire doit idéalement être fixée sur un support et orientée.
- Vulvectomie totale superficielle.
- Instauration progressive pour une meilleure tolérance jusqu'à 3 fois par semaine (posologie optimale) pendant 4 mois.
- Vérifier l'observance.
- En cas d'échec thérapeutique ou de réponse incomplète : biopsie(s) impérative(s).
- Chez les femmes porteuses d’une vH-SIL, il n’y a pas d’argument dans la littérature pour proposer une utilisation préférentielle de la vaporisation par laser CO2 ou de l’excision chirurgicale que ce soit en termes de récidive, de progression vers un cancer infiltrant ou de qualité de vie.
- Selon les cas, la possibilité de réaliser un contrôle histologique pourra faire préférer l’excision chirurgicale et le caractère multifocal et certaines localisations pourront faire préférer la vaporisation laser (accord d'experts).
- Il est possible de proposer une vaporisation laser en première intention pour le traitement d’une vH-SIL en raison du caractère attendu mutilant d’une éventuelle chirurgie (accord d'experts).
- Chez les femmes porteuses d’une vH-SIL, il n’y a pas d’argument dans la littérature pour recommander l’utilisation préférentielle de la photothérapie dynamique (PDT) ou de l’excision chirurgicale que ce soit en termes de récidive, de progression vers un cancer infiltrant ou de qualité de vie. La PDT semble avoir une efficacité, mal mesurée. Selon les cas, la possibilité de réaliser un contrôle histologique pourra faire préférer l’excision chirurgicale et le caractère multifocal et certaines localisations d’accès chirurgical complexe pourront faire préférer la PDT (accord d'experts).
- Chez les femmes porteuses d’une vH-SIL, il n’y a pas d’argument dans la littérature pour proposer une recommandation générale sur l’utilisation préférentielle de l’imiquimod ou de l’excision chirurgicale que ce soit en termes de récidive, de progression vers un cancer infiltrant ou de qualité de vie. Les essais contre placebo mettent en évidence une efficacité de ce traitement et un taux de récidive de l’ordre de 50 %. Sans que la littérature permette de déduire une indication préférentielle, son utilisation paraît intéressante dans les lésions multifocales en alternative à une chirurgie potentiellement mutilante.
- Chez les femmes porteuses d’une vH-SIL, il n’y a pas d’argument dans la littérature pour recommander l’utilisation préférentielle de la Cavitron ultrasonic surgical aspirator (CUSA) ou de l’excision chirurgicale classique, que ce soit en termes de récidive, de progression vers un cancer infiltrant ou de qualité de vie. La CUSA semble avoir une efficacité comparable à celle du laser CO2 avec l’avantage de permettre le recueil des tissus fragmentés pour analyse histologique (accord d'experts).
- Chez les femmes opérées d’une vH-SIL, il est recommandé d’avoir des marges saines en première intention. Les marges histologiques saines étant associées à un risque de récidive des lésions inférieur en comparaison aux patientes opérées avec des marges non saines. Recommandation forte, qualité de preuve basse.
- En l’absence de données dans la littérature, il n’est pas recommandé de procéder à titre systématique à une reprise chirurgicale en cas de marges non saines. Une reprise chirurgicale pourra être discutée en fonction du contexte spécifique à chaque patiente (Accord d'experts).
-
La classification des lésions épidermoïdes comprend :
-
Les lésions vulvaires intra-épithéliales épidermoïdes induites par l’HPV (lésions épidermoïdes de bas grade ou VIN1 et de haut grade ou VIN2-3)
-
Les lésions vulvaires intra-épithéliales épidermoïdes HPV-indépendantes (ou VIN différencié)
-
Le carcinome épidermoïde associés à l’HPV
-
Le carcinome épidermoïde HPV-indépendant
-
Le carcinome épidermoïde sans type spécifique (NOS)
-
Le carcinome basaloïde.
-
-
Le compte-rendu histologique doit comprendre :
-
La procédure chirurgicale et la localisation de la lésion
-
La taille de la lésion et la profondeur d’invasion
-
Le type histologique
-
Le grade histologique
-
La présence et le nombre d’emboles lympho-vasculaires
-
L’estimation des marges périphériques et profondes pour les lésions intra-épithéliales et le carcinome invasif (en mm)
-
Le statut ganglionnaire : nombre, taille des métastases (micro-métastase ≤ 2mm, cellules tumorales isolées ou <0,2mm…), extension extra-capsulaire
-
Le stade FIGO 2021
-
Le statut immunohistochimique de p16 et p53
-
Eventuellement le statut HPV en hybridation in situ.
-
-
Note : diagnostic différentiel entre :
| Carcinome épidermoïde | Carcinome basaloïde | |
| Prévalence et âge | 80 %, femmes âgées | 20 %, femmes jeunes |
| Morphologie | Kératinisant | Verruqueux |
| Association avec VIN | VIN différencié |
VIN associé à l'HPV
(v-HSIL)
|
| Associaiton avec lichen scléreux | Fréquent | Rare |
| HPV | Non | Oui |
| Immunohistochimie |
P53 : parfois positif
P16 : négatif (ou faible)
|
P53 : négatif
P16 : positif
|
- Facteurs de risque de rechute locale :
- présence de lésions précancéreuses à proximité de la berge (Te groohentuis, 2019 ; Dudley, 2019)
- profondeur >5 mm
- taille >4 cm
- présence d'emboles (LVSI)
- atteinte de la marge ou marge proche (NCCN, 2021).
- Un examen clinique conjoint, à chaque fois que possible (chirurgien référent et radiothérapeute) éventuellement sous anesthésie générale est un préalable pertinent avant présentation en RCP :
- Examen soigneux de l’ensemble de la vulve (la maladie peut être plurifocale, pouvant associer des lésions invasives et des lésions de néoplasies intra-épithéliales (VIN)).
- Caractéristiques de la lésion vulvaire : localisation côté droit ou gauche, antérieur, postérieur/taille/distance par rapport à la ligne médiane/mobilité par rapport aux plans sous-jacents/extension de voisinage : méat urétral, marge anale, paroi vaginale.
- Examen du col (frottis pour cytologie et/ou test HPV), du vagin et de la marge anale et du canal anal. SNFCP 2022
- ± sérologie HIV pour les femmes jeunes, les lésions évoluées et avec un contexte viral probable.
- Biopsies multiples de la lésion selon la taille de la lésion, et éventuellement recherche d'HPV, pour examen anatomo-pathologique après anesthésie locale (injection intradermique de xylocaïne) : PUNCHbiopsie ≥ 4 mm.
L'exérèse biopsie est à éviter. Elle peut compromettre la suite des traitements. - Examen des aires ganglionnaires : inguinales, rétro crurales, sus-claviculaires. La fiabilité de l’examen clinique est faible : en particulier le caractère fréquemment surinfecté du cancer vulvaire augmente le risque de faux positifs. La cytoponction est à proposer en cas de ganglion inguinal suspect.
- Bilan d’opérabilité, consultation d’oncogériatrie nécessaire pour les patientes de plus de 75 ans ou ayant un score G8 ≤ 14, bilan nutritionnel (avec supplémentation précoce pour réduire les complications postopératoires).
- Un schéma de la lésion et des aires ganglionnaires et des photographies doivent être réalisés.
Vous pouvez télécharger ce schéma à un plus grand format en PDF.
- Il est adapté en fonction des caractéristiques tumorales et locorégionales.
- Il comprend :
- Biopsie de la lésion pour examen anatomo-pathologique
- Colposcopie (en cas d'anomalie cervicale)
- Selon la localisation de la tumeur : urétro-cystoscopie, anuscopie, rectoscopie
- Echographie inguinale systématique si stade > IA ± biopsie si ganglion suspect.
- Imagerie injectée en coupes :
- TEP scanner à partir du stade II
- TDM thoraco-abdomino-pelvien pour le bilan d'extension ganglionnaire lombo-aortique et lésions secondaires viscérales
- Ou IRM lombo-pelvienne (si possible dès le stade IA) pour le bilan d'extension tumoral local et ganglionnaire pelvien (Cf. protocole).
| Stade I | Confiné à la vulve ou au périnée, N0 |
| IA | T ≤ 2 cm et invasion stromale ≤ 1 mm |
| IB | T >2 cm, ou invasion stromale >1 mm |
| Stade II | Extension aux structures périnéales adjacentes 1/3 proximal (urètre, vagin, anus) quelle que soit la taille et pN0 |
| Stade III | Extension aux structures périnéales adjacentes 2/3 distal (urètre, vagin, anus) quelle que soit la taille et/ou pN+ inguinal |
| IIIA | Extension aux structures périnéales adjacentes 2/3 distal ou N ≤ 5 mm |
| IIIB | N >5 mm |
| IIIC | Tout N avec rupture capsulaire |
| Stade IV | Lésion de toute taille fixée à l'os pubien, ou ganglion fixé/ulcéré ou métastases à distance |
| IVA | Atteinte os pubien ou ganglion fixé : ulcéré |
| IVB | Métastases à distance (incluant N+ pelvien) |
- Date de naissance
- Statut OMS ± score de Balducci (en cas de consultation en oncogériatrie) ou score G8
- Comorbidités incidentes ± score ASA
- Poids et taille
- Dimensions tumorales (schéma) ± document photographique (disponibles au cours de la RCP)
- Type histologique et tout compte-rendu anatomo-pathologique (hyperexpression de la P16, option détection d'HPV)
- Imagerie
- Compte-rendu opératoire
- Proposition de consultation de préservation de la fertilité pour les femmes de moins de 40 ans si risque d'hypofertilité.
- La stratégie du traitement des cancers de la vulve doit tenir compte de la topographie de la tumeur, du caractère uni- ou plurifocal de la tumeur, du risque élevé d'envahissement ganglionnaire mais également des comorbidités.
- Un passage en RCP est nécessaire avant toute décision thérapeutique.
(Butler, 2010 ; Courtney-Brooks, 2010 ; Le T, 2007 ; Levenback, 2012 ; Pecorelli, 2009 ; Van der Zee, 2008)
(Arvas, 2018 ; Bedell, 2019 ; Gamsimli, 2018 ; Micheletti, 2018 ; Pleunis, 2018 ; Raimond, 2019 ; Te Grootenhuis, 2019; Wagner, 2022))
(ESGO 2023)
(NCCN Clinical Practice Guidelines in Oncology Version 2022)
- Chirurgie vulvaire : l'objectif est la réalisation de l'exérèse radicale des lésions en passant à distance (marges saines).
Recommandations de l'ESGO (2023) et NCCN (2022) : l’objectif de la résection de la tumeur primaire est l'ablation complète avec des marges histologiques négatives. La définition d'une marge négative continue d'évoluer et des données plus récentes confirment l'importance d'une marge négative, mais mettent moins l'accent sur la distance réelle (en mm) de la marge. Dans le cas de marges tumorales proches ou positives, une nouvelle résection pour obtenir des marges négatives doit être privilégiée. Une radiothérapie locale adjuvante est une option en cas de chirurgie impossible. Dans une étude récente, des marges sans tumeur d'au moins 2 mm ont été associées à un risque plus faible de récidive locale. De plus, il existe un intérêt à retirer les lésions précancéreuses adjacentes, si possible, pour réduire le risque de récidive.- La vulvectomie :
- Superficielle : marges jusqu’à 5 mm en profondeur
- Radicale : marges macroscopique ≥ 2 cm pour obtenir des marges histologiques saines
- Nécessité d’orienter les pièces+++
- L'utilisation des techniques de chirurgie reconstructrice par lambeaux doit être maîtrisée et est à envisager avant toute chirurgie (privilégier les lambeaux d'avancement aux lambeaux de rotation : moins de complication et durée d'hospitalisation plus courte)
- L’atteinte urètrale inférieure ou cutanée anale n’est pas une contre-indication à la chirurgie première
- Une thérapie par pression négative prophylactique est à envisager en cas d’exérèse large ou de facteurs prédictifs de désunion. Une thérapie par pression négative précoce en cas de désunion est recommandée (si marges saines).
- L'exentération pelvienne est à envisager en cas d'atteinte du 1/3 supérieur du vagin et/ou d'atteinte des organes de voisinage
- Les reprises chirurgicales se discutent pour des exérèses non en marges saines (NCCN, 2021) ; en cas de présence de VIN, elles doivent se discuter en RCP.
- Cicatrisation : en cas de lâchage important de cicatrice ou de non cicatrisation, il est recommandé d'utiliser la thérapie paar pression négative
- La vulvectomie :
- Geste ganglionnaire :
-
Procédure du ganglion sentinelle :
-
Méthode : double détection
-
Isotopique + colorimétrique ou
-
Isotopique + vert d’indocyanine
-
L’utilisation du traceur radioactif est obligatoire
-
-
Indications :
-
Tumeurs avec un stade supérieur à T1a et tumeurs inférieures à 4 cm sans atteinte ganglionnaire à l’imagerie / examen clinique
-
Si tumeurs latérale à >1cm de la ligne médiane : GS homolatéral
-
Si tumeur médiane (<1cm) GS bilatéral
-
-
Conduite à tenir en cas de positivité du GS :
-
Si envahissement macrométastases, reprise chirurgicale avec curage inguinal du côté du GS atteint
-
Si micrométastases ≤ 2mm : le curage peut être omis et en cas d'indications à une radiothérapie (GROINS STUDY VII)
-
Métastases <0,2mm et les cellules isolées : pas suffisamment de données pour abstention thérapeutique (décision en RCP en fonction des autres facteurs de risque de récidive)
-
-
Curage ganglionnaire inguinal (lymphadénectomie fémoro-inguinale) :
-
Type de curage : curages superficiels et profonds
-
Indication :
-
Ganglion sentinelle non détecté
-
Tumeurs ≥ 4cm et ou multifocale : curage inguino fémoral par incisions séparées
-
Si tumeur latérale à >1cm de la ligne médiane : curage ipsilatéral
-
Si tumeur médiane (<1cm) : curage bilatéral
-
Si tumeurs latéralisées : curage inguinal homolatéral (Si N+ alors curage inguinal bilatéral)
-
Si GS macrométastatique
-
-
-
-
-
-
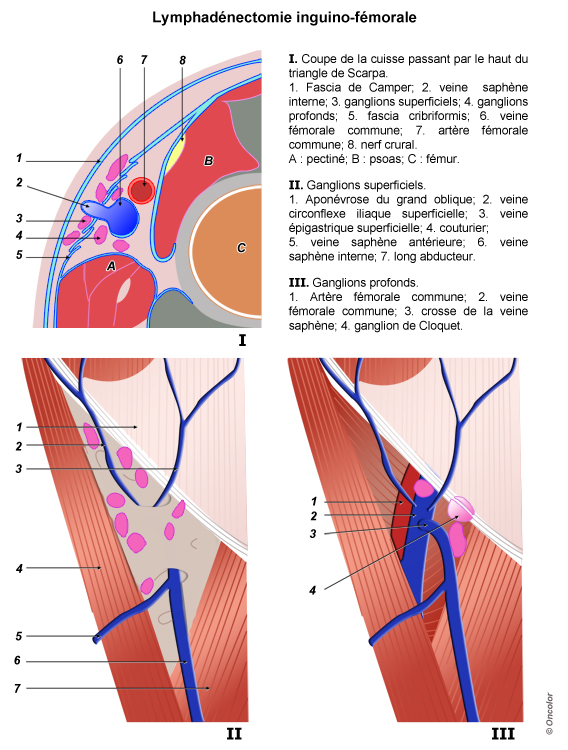
Vous pouvez télécharger ces schémas PDF dans un plus grand format.
- Radiothérapie conformationnelle 3D (photons et parfois mixage avec électrons (irradiation inguinale) ou avec modulation d'intensité (résultats dosimétriques supérieurs)) (Chapman, 2016).
- Des recommandations de contourage sont parues en 2012 et 2017 (Kim, 2012 ; Gaffney, 2017).
- Radiothérapie postopératoire :
- L’irrradiation postopératoire doit débuter idéalement dans les 6-10 semaines après la chirurgie ; au-delà de 104 jours, il n’y a plus de bénéfice à l’irradiation.
- L’interruption de la radiothérapie doit être évitée. Une durée de traitement supérieure à 50 jours est associée à une augmentation du risque de récidive.
- Volumes cibles : vulve et/ou aires ganglionnaires inguinales ± pelviennes (iliaques internes, externes et obturatrices).
- Facteurs de risque de rechute locale :
- présence de lésions précancéreuses à proximité de la berge (Te groohentuis, 2019 ; Dudley, 2019) (rechute ou nouveau cancer…la véritable question)
- profondeur >5 mm
- taille >4 cm
- présence d'emboles (LVSI)
- atteinte de la marge ou marge proche (NCCN, 2021).
- Indications d'irradiation vulvaire :
- si marge positive et reprise chirurgicale impossible : radiothérapie (la reprise chirurgicale est à privilégier) : une chimiothérapie concomitante est à envisager en l'absence de contre-indication.
- si marge négative et N- : irradiation vulvaire si T >4 cm ou T2 ou T3 (NCCN, 2021).
- si marge négative et N+ : l’irradiation vulvaire se discute dès le stade I en présence d’autres facteurs de risque de rechute locale.
- Irradiation des aires inguinales et pelviennes :
- Standard :
-
À partir de 2N+
-
Si 1 N+ : irradiation si taille ≥ 2mm et/ou rupture capsulaire (NCCN, 2021).
-
Une chimiothérapie concomitante est à envisager à partir de 1 macroN+ en l’absence de contre-indication.
-
Si microN+ sans rupture capsulaire :
-
Après curage : la surveillance se discute en l’absence de facteurs de risque de rechute locale
-
Après GS : radiothérapie
-
-
-
Cas particulier : si stade I N- sur GS ou curage unilatéral : radiothérapie inguinale controlatérale ou curage ; voire surveillance si tumeur bien latéralisée de moins de 4 cm.
- Doses :
Les doses se discutent en fonction de la réalisation ou pas d’une chimiothérapie concomitante, de la localisation et de l’étendue des volumes à booster, et des comorbidités.- Lit opératoire avec marge négative ou aire ganglionnaire non atteinte : 45-50 Gy en 5 semaines (NCCN, 2019)
- Marge positive : ≥ 54-56 Gy (Viswanathan, 2013 ; Chapman, 2016) jusque 66 Gy
- Marge proche : ≥ 50 Gy ou 54-56 Gy si autre facteur de risque
- Sur ganglion inguinal N+ sans rupture : 50-55 Gy (NCCN, 2021)
- Sur ganglion inguinal N+ avec rupture capsulaire : 54-64 Gy (NCCN, 2021)
- Avec chimiothérapie concomitante de potentialisation (1,8 Gy/fraction) à partir de 2N+ et 1N+ de taille ≥ 2 mm.
- Standard :
- Irradiation tumeur en place : discuter au cas par cas la chirurgie complémentaire en cas de résidu confirmé par une biopsie.
- Volumes cibles :
- GTV et vulve en totalité
- Aires inguinales et pelviennes : remontant au moins 5 cm au-dessus de l'atteinte la plus basse, limite supérieure minimum au niveau du pied des sacro-iliaques.
- Doses :
Les doses se discutent en fonction de la réalisation ou pas d’une chimiothérapie concomitante, de la localisation et de l’étendue des volumes à booster, et des comorbidités.- Vulve et adénopathies en place : 59,4 Gy en 33-36 fractions (avec chimio) ou jusqu'à 70 Gy en l'absence de chimio
- N0 : 45/50 Gy (avec/sans chimio)
- Une chimiothérapie concomitante doit être proposée en l'absence de contre-indication
- Réévaluation :
- si rémission clinique : surveillance
- si résidu clinique avec biopsie positive : évaluer possibilités chirurgicales.
- Volumes cibles :
- Passage en RCP avant toute thérapeutique.
Si GS non détecté faire curage
Associé GS unilatéral
± chimiothérapie concomitante
(en fonction des facteurs de risque
et des comorbidités)
Stade IB unifocal
inopérable
- Radiothérapie vulvaire et inguinale
- Complément par radiothérapie externe
ou curiethérapie interstitielle
chimiothérapie concomitante
- Radiothérapie vulvaire
- Complément inguinal
ou pelvien par radiothérapie externe
ou curiethérapie
± adénopathies
(Gordinier, 2003 ; Gonzalez, 2005)
- Il est préconisé la constitution pour la patiente d'un calendrier de soins (support écrit remis à la patiente).
- Examen périnéal et touchers pelviens, palpation ganglionnaire tous les 4 mois pendant 2 ans, puis tous les 6 mois pendant 3 à 5 ans.
- Surveillance échographique inguinale ± cytologie tous les 4 à 6 mois pendant les 2 premières années puis tous les 6 mois pendant 3 à 5 ans.
- Scanner TAP en fonction du stade initial et des facteurs de risque (tous les 4 à 12 mois).
- VIN : surveillance rapprochée tous les 4 à 6 mois pendant 2 ans puis tous les ans.
- Réaliser un bilan complet :
- Clinique : examen clinique +/- sous anesthésie générale avec biopsies multiples
- Imagerie : IRM pelvienne, TEP-TDM au FDG/scanner TAP
- Bilan d’opérabilité
- Récidive locale :
- Vulvaire :
- En fonction de l’aspect et des traitements déjà reçus
- Reprise chirurgicale +/- lambeaux de couverture +/- exploration ganglionnaire
- Exentération pelvienne peut être discutée dans des cas précis et sélectionnés
- Et/ ou curiethérapie intestitielle ou RTCT
- Vulvaire :
- Ganglionnaire :
- Si bilan d’extension négatif (TEP-TDM au FDG)
- Adénectomie itérative si possible avant RT
- Sinon en fonction des traitements antérieurs
- Reprise RT/ CT/ soins de supports
- Métastatique :
- En fonction des symptômes et de l’âge
- Chimiothérapie par sels de platine, soins de supports
- Discuter inclusion dans un essai thérapeutique et immunothérapie
- Opacification vaginale
- 3 plans T2 petit champ, coupes fines, hautes résolutions couvrant vulve et vagin
- Axial T2, ganglions comprenant les creux inguinaux et remontant jusqu'aux veines rénales
- 3 plans T1 FAT-SAT après injection de gadolinium
- Diffusion
- TDM TAP dans le bilan d'extension

-
GASVERT : Fiabilité de l'utilisation du vert d'indocyanine dans l'évaluation du ganglion sentinelle en chirurgie cancérologique.
- Status : Ouvert (29-11-2017 - 29-11-2020)
- Promoteur : Institut de Cancérologie de Lorraine
-
undefined : undefined
- Statut : undefined ()
- Promoteur : undefined
-
VOLATIL : Étude de phase II évaluant l’intérêt d’associer le vaccin UCPVax et l’atezolizumab dans le traitement des cancers HPV positifs
- Status : Ouvert (14-02-2020 - 31-01-2022)
- Promoteur : Centre Hospitalier Universitaire de Besançon
- Arvas M, Kahramanoglu I, Bese T, Turan H et al.
The Role of Pathological Margin Distance and Prognostic Factors After Primary Surgery in Squamous Cell Carcinoma of the Vulva.
Int J Gynecol Cancer. 2018 ; 28, 623-631.
- Bedell SM, Hedberg C, Griffin A, Pearson H et al.
Role of Adjuvant Radiation or Re-Excision for Early Stage Vulvar Squamous Cell Carcinoma With Positive or Close Surgical Margins.
Gynecol Oncol. 2019 ; 154 , 276-279.
- Bornstein J, Bogliatto F, Haefner HK, Stockdale CK et al.
The 2015 International Society for the Study of Vulvovaginal Disease (ISSVD) Terminology of Vulvar Squamous Intraepithelial Lesions.
Obstet Gynecol. 2016 ; 127 : 264-8.
- Butler JS, Milliken DA, Dina R, Eccles SA et al.
Isolated groin recurrence in vulval squamous cell cancer (VSCC). The importance of node count.
Eur.J.Gynaec.Oncol. 2010 ; 31 : 10-513.
- Chapman BV, Gill BS, Viswanathan AN, Balasubramani GK, Sukumvanich P, Beriwal S.
Adjuvant Radiation Therapy for Margin-Positive Vulvar Squamous Cell Carcinoma: Defining the Ideal Dose-Response Using the National Cancer Data Base.
Int J Radiat Oncol Biol Phys. janv 2017;97(1):107 17.
- Cibula D, Raspollini MR, Planchamp F, Centeno C, Chargari C, Felix A, et al.
ESGO/ESTRO/ESP Guidelines for the management of patients with cervical cancer – Update 2023
International Journal of Gynecologic Cancer. 2023;33(5).
- Dudley S, Viswanathan A
Margins in vulvar cancer: challenges to classical clinicopathologic vulvar recurrence risk factors.
Gynecol Oncol. août 2019;154(2):253 4.
- CNGOF
Recommandations pour la Pratique Clinique du Collège national des Gynécologues-Obstétriciens Français 2022
A paraitre
- NCCN
Clinical Practice Guidelines in Oncology - Vulvar Cancer Version 1.2023
December 22, 2022
- Courtney-Brooks M, Sukumvanich, Beriwal S, Zorn KK et al.
Does the number of nodes removed impact survival in vulvar cancer patients with node-negative disease ?
Gynecol Oncol. 2010 ; 117 : 308-311.
- Covens A, Vella ET, Kennedy EB et al.
Sentinel lymph node biopsy in vulvar cancer: Systematic review, meta-analysis and guideline recommendations.
Gynecol Oncol. 2015 ;137 : 351-61.
- Gaffney DK, King B, Viswanathan AN, Barkati M, Beriwal S, Eifel P, et al.
Consensus Recommendations for Radiation Therapy Contouring and Treatment of Vulvar Carcinoma
Int J Radiat Oncol Biol Phys. 2016;95(4):1191 200. - Gasimli K, Straussner M, Schmeil I, Karn T et al.
Impact of Re-Excision of Residual Adjacent Vulvar Intraepithelial Neoplasia (VIN III) and Histological Tumour-Free Margin (hTFM) on Survival in Primary Squamous Cell Carcinoma of Vulva
Arch Gynecol Obstet. 2018 ; 298 : 945-950. - Gordinier ME, Malpica A, Burke TW, Bodurka DC et al.
Groin recurrence in patients with vulvar cancer with negative nodes on superficial inguinal lymphadenectomy.
Gynecol Oncol. 2003 ; 90 : 625-8.
- Gonzalez Bosquet J, Magrina JF, Gaffey TA, Hernandez JL et al.
Long-term survival and disease recurrence in patients with primary squamous cell carcinoma of the vulva.
Gynecol Oncol. 2005 ; 97 : 828-33.
- Kim CH, Olson AC, Kim H, Beriwal S et al.
Contouring international and femoral nodes; how much margin is needed around the vessels ?
Pract Radiat Oncol. 2012 ; 2 : 274-2.
- Kirtschig G.
Lichen Sclerosus-Presentation, Diagnosis and Management.
Dtsch Arztebl Int. 2016 ; 113 : 337-43.
- Le T, Elsugi R, Hopkins L, Faught W, Fung-Kee-Fung M.
The definition of optimal inguinal femoral nodal dissection in the management of vulva squamous cell carcinoma.
Ann Surg Oncol. 2007 ; 14 : 2128-2132.
- Levenback CF, Ali S, Coleman RL, Gold MA et al.
Lymphatic Mapping and Sentinel Lymph Node Biopsy in Women With Squamous Cell Carcinoma of the Vulva: A Gynecologic Oncology Group Study.
J Clin Oncol. 2012 ; 30 : 3786-91.
- Micheletti L, Preti M, Cintolesi V, Corvetto E et al.
Prognostic Impact of Reduced Tumor-Free Margin Distance on Long-Term Survival in FIGO Stage IB/II Vulvar Squamous Cell Carcinoma.
J Gynecol Oncol. 2018 ; 29 (5) : e61. - ONCO Hauts-De-France
Référentiel régional de prise en charge des cancers gynécologiques 2023 - Oonk MH, Van Hemel BM, Hollema H, de Hullu JA et al.
Size of sentinel-node metastasis and chances of non-sentinel-node involvement and survival in early stage vulvar cancer: results from GROINSS-V, a multicentre observational study.
Lancet Oncol. 2010 ; 11 : 646–52.
- Oonk MHM, Slomovitz B, Baldwin PJW, et al.
Radiotherapy Versus Inguinofemoral Lymphadenectomy as Treatment for Vulvar Cancer Patients With Micrometastases in the Sentinel Node : Results of GROINSS-V II.
- Parthasarathy A, Cheung MK, Osann K, Husain A et al.
The benefit of adjuvant radiation therapy in single-node-positive squamous cell vulvar carcinoma.
Gynecologic Oncology. 2006 ; 103 : 1095-9.
- Pleunis N, Leermakers M, van der Wurff A, Klinkhamer P et al.
Surgical Margins in Squamous Cell Carcinoma, Different for the Vulva?
Eur J Surg Oncol. 2018 ; 44 : 1555-1561. - Raimond E, Delorme C, Ouldamer L, Carcopino X et al.
Surgical Treatment of Vulvar Cancer: Impact of Tumor-Free Margin Distance on Recurrence and Survival. A Multicentre Cohort Analysis From the Francogyn Study Group.
Eur J Surg Oncol. 2019 ; 45 : 2109-2114. - SNFCP
Recommandations pour la Pratique Clinique - Lésions précancéreuses anales liées aux papillomavirus humains : dépistage et prise en charge
2022
- Te Grootenhuis NC, Pouwer AW , de Bock GH , Hollema H et al.
Margin Status Revisited in Vulvar Squamous Cell Carcinoma.
Gynecol Oncol. 2019 ; 154 : 266-275.
- Thomas GM, Dembo AJ, Bryson SC, Osborne R et al.
Changing concepts in the management of vulvar cancer.
Gynecol Oncol. 1991 ; 42 : 9-21.
- Van der Zee AG, Oonk MH, De Hullu JA, Ansink AC, et al.
Sentinel node dissection is safe in the treatment of early-stage vulvar cancer.
J Clin Oncol. 2008 ; 26 : 884-9
- Virarkar M, Vulasala SS, Daoud T, Javadi S, Lall C, Bhosale P.
Vulvar Cancer: 2021 Revised FIGO Staging System and the Role of Imaging.
Cancers (Basel). 30 avr 2022;14(9):2264
- Viswanathan AN, Pinto AP, Schultz D, Berkowitz R, Crum CP.
Relationship of margin status and radiation dose to recurrence in post-operative vulvar carcinoma.
Gynecol Oncol. sept 2013;130(3):545 9.
- Wagner MM, Van Der Zee AGJ, Oonk MHM.
History and Updates of the GROINSS-V Studies.


