Collaborateurs
Coordonnateurs régionaux
KOCH Stéphane
CHRU de Besançon (25)
CHEVAUX Jean-Baptiste
CHRU de Nancy (54)
Rédacteurs
AYAV Ahmet
CHRU de Nancy (54)
Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 13 janvier 2022.
- Cette référence concerne la tumeur de la papille. Les adénocarcinomes péri-ampullaires ne seront pas traités dans cette référence. Du point de vue anatomique, ces tumeurs peuvent concerner la partie duodénale, la partie ampullaire ou les deux.
- En fonction du type histologique, voir les références Tumeurs neuroendocrines du grêle ou Adénocarcinomes exocrines du grêle.
- Du point de vue anatomo-pathologique, ces tumeurs peuvent être de sous-type intestinal développées sur un adénome duodénal et de sous-type excréto-biliaire (pancréato-biliaire) développées sur le versant endobiliaire.
- Le pronostic de la tumeur ampullaire de type intestinal est bien meilleur que celui de type excréto-biliaire (Kawabata, 2010 ; Morini, 2013).
- Clinique : ictère cholestatique (prurit) continu progressif, amaigrissement récent, antécédents personnels ou familiaux de polyadénomatose familiale (mutation du gène APC, à préciser), fièvre.
- Biologie : anémie ferriprive, cytolyse, cholestase ictérique.
- Duodénoscopie (latéroscope haute définition indispensable) avec biopsies multiples : localisation précise, développement endoluminal ou endoampullaire, diamètre, degré de sténose, présence d’une ulcération, adénomes associés de D2.
- Echographie : dilatation souvent très marquée de la voie biliaire principale et du canal pancréatique sur tout le trajet en l'absence de pancréas divisum.
- Duodénoscopie avec biopsie à la pince pour les formes endoluminales.
- Echoendoscopie avec biopsies pour les formes endocanalaires (avec aiguille tranchante pour histologie, FNB) : statut usT (usT2 : extension à la sous-muqueuse ; usT3 : extension au pancréas), statut N, extension endocanalaire au canal pancréatique principal et/ou à la voie biliaire principale.
- Scanner thoraco-abdomino-pelvien en coupes fines de 1 mm centré sur la région duodénopancréatique avec remplissage du duodénum à l’eau et acquisition aux trois phases de l’injection : recherche les contre-indications à la DPC (métastases ganglionnaires à distance inter-aortico-cave, métastases hépatiques) et précise la cartographie vasculaire (Al-Hawary, 2014).
- Cholangio-pancréato-IRM : recherche une extension tumorale endocanalaire.
- Gastroscopie et coloscopie haute résolution à la recherche de lésions associées.
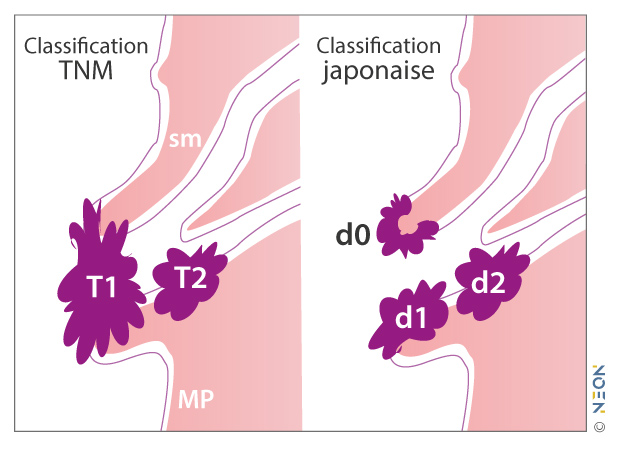
- Le sphincter d’Oddi représente l’équivalent d’une musculaire muqueuse. Le risque ganglionnaire n’existe pas en l’absence d’extension tumorale à la sous-muqueuse duodénale, alors qu'il est de 30 % en cas d’envahissement de celle-ci. Pour les stades T1, cette information doit être indispensable.
- Il s'agit d’adénocarcinomes. Deux sous-types histologiques principaux sont décrits : le sous-type intestinal développé sur adénome duodénal et le sous-type excréto-biliaire (pancréatobiliaire) développé sur le versant endobiliaire.
- Lorsque la morphologie n'oriente pas aisément vers une différenciation histologique précise, il est recommandé de réaliser une étude immunohistochimique :
- un profil immunohistologique cytokératine 7+ / cytokératine 20- est en faveur d'une origine pancréatobiliaire.
- un profil immunohistologique cytokératine 7- / cytokératine 20+ est en faveur d'une origine intestinale.
- La mutation KRAS est retrouvée dans environ la moitié des cas et pourrait constituer un élément pronostic (Kim, 2016 ; Tao, 2016).
- La recherche d'une instabilité des microsatellites est souhaitable chez les patients de moins de 70 ans ayant une tumeur de type intestinale.
- Les critères de qualité d'un compte-rendu anatomo-pathologique ampullome comprennent :
- type hystologique intestinal ou biliopancréatique
- niveau de différenciation
- envahissement du sphincter d'Oddi (stade pT1a) ou au-delà (stade pT1b)
- présence d'emboles lymphatiques, vasculaires et périnerveux.
| T - Tumeur | |
| Tx | Tumeur inclassée |
| Tis | Carcinome in situ |
| T1a | Tumeur limitée à l’ampoule de Vater ou au sphincter d’Oddi |
| T1b | Tumeur envahissant au-delà du sphincter d’Oddi et/ou envahissant la sous-muqueuse duodénale |
| T2 | Tumeur envahissant la muscularis propria du duodénum |
| T3 | Tumeur envahissant le pancréas |
| T3a | Tumeur envahissant le pancréas de moins de 0,5 cm |
| T3b | Tumeur envahissant le pancréas sur plus de 0,5 cm ou dans le tissu péri-pancréatique ou atteignant la séreuse duodénale sans envahissement artériel cœliaque ou mésentérique supérieur |
| T4 | Tumeur envahissant le tronc cœliaque, l'artère mésentérique supérieure ou l'artère hépatique |
| N - Extension ganglionnaire | |
| N0 | Absence d’adénopathie régionale métastatique |
| N1 | Présence d’adénopathies régionales métastatiques ≤ 3 |
| N2 | Présence d’adénopathies régionales métastatiques ≥ 4 |
| M - Métastases à distance | |
| M0 | Pas de métastase |
| M1 | Métastases à distance ou adénopathies spléniques ou caudales |
| Stade 0 | Tis | N0 | M0 | ||
| Stade IA | T1 | N0 | M0 | ||
| Stade IB | T1b | N0 | M0 | ||
| T2 | |||||
| Stade IIA | T3a | N0 | M0 | ||
| Stade IIB | T3b | N1 | M0 | ||
| Stade IIIA | T1a | N1 | M0 | ||
| T1b | |||||
| T2 | |||||
| T3 | |||||
| Stade IIIB | Tout T | N2 | M0 | ||
| T4 | Tout N | M0 | |||
| Stade IV | Tout T | tout N | M1 | ||
- La différenciation histologique (intestinale vs pancréatobiliaire) est un facteur pronostique majeur et déterminant dans le choix des chimiothérapies adjuvantes.
- Il est également possible de s'aider d'autres marqueurs comme CDX2 et MUC2 dont la positivité est en faveur d'une origine intestinale et de MUC1 dont la positivité est en faveur d'une origine pancréatobiliaire.
- ≥ T2 ou
- N+ ou
- Tumeur ulcérée.
Le traitement sera une Duodéno Pancréatectomie Céphalique (DPC) avec les mêmes critères de qualité que pour les adénocarcinomes pancréatiques.
- L'échoendoscopie est indispensable
- ≤ T1a et
- tumeur non ulcérée et
- us N0 et
- pas d’extension endocanalaire biliaire ou pancréatique et
- M0 et
- pas de caractère infiltrant sur les biopsies.
- En cas d'ampullome non dégénéré pour lesquels une ampullectomie endoscopique est envisagée : il est nécessaire de réaliser au moins 2 séries de biopsies avec duodénoscope interprétées par 2 anatomopathologistes différents confirmant l'ampullome. En cas de papille adénomateuse non tumorale, sans anomalie du bilan hépatique, aucun geste n'est réalisé en l'absence de dysplasie de haut grade au minimum.
- ampullectomie endoscopique en centre expert :
- exérèse monobloc de l'ensemble de la structure ampullaire sans injection « sous-muqueuse »
- stenting de canal pancréatique principal souhaitable par une prothèse plastique de 3-7Fr. Elle sera retirée après 4 à 6 semaines après le geste afin de diminuer les pancréatites post-résection.
- utilisation de courant de section pure sans courant de coagulation.
- ampullectomie chirurgicale :
- avec examen histologique extemporané des sections de canaux pancréatique et biliaire
- le risque d’extension rétrograde endobiliaire justifie une section haute de la voie biliaire principale infundibulaire
- le résultat histologique définitif de la lésion ampullaire doit être donné très rapidement (moins de 4 jours) afin de permettre une réintervention rapide dans de bonnes conditions si la tumeur est finalement invasive (DPC).
- L'ampullome T1b doit être traité par chirurgie dans l'idéal.
- Si l'état général ne permet pas la DPC, le traitement endoscopique est discuté.
- Le risque d'envahissement ganglionnaire est de 30 %.
Suspicion de
tumeur ampullaire
Duodénoscopie
+ biopsie
EUS
Cholangiocarcinome
IRM
IRM
R0 DBG DHG pT1a
Contrôle 3 mois
Duodénoscopie
+ biopsie
+ biopsie
RCP
Ampulectomie
chirurgicale
transduodénale
chirurgicale
transduodénale
RCP
DPC
RCP
≥ T1b
ou N+
ou M+
ou N+
ou M+
RCP
DBG
Dysplasie
bas grade
Dysplasie
bas grade
DHG
Dysplasie haut
grade ou ≤ T1a
Dysplasie haut
grade ou ≤ T1a
R1 pTis
ou pT1a
ou pT1a
≥ pT1b
R1 DBG DHG
Adénome envahissement
canalaire <20 mm
canalaire <20 mm
Histologie N
- Duodénoscopie
+ biopsie - EUS
EUS + Biopsie
Tumeur obstructive
Grosse papille
asymptomatique
asymptomatique
Biologie normale
- ERCP
- Petite
sphinctérotomie
+ biopsie
Biopsie
2ème série
2ème série
T1s N0 M0
ou T1a
ou T1a
Carcinome
ou
adénome avec envahissement
>20mm
adénome avec envahissement
>20mm
ou
Difficultés techniques
(diverticules, T >40mm...)
(diverticules, T >40mm...)
Contrôle 3 mois
Résection
complémentaire
complémentaire
- EMR
- APC
- RFA
Ampulectomie endoscopique
centre expert
centre expert
±
RFA canal biliaire
- Première duodénoscopie à 3 mois. But : dépister une résection incomplète
Puis :
- Surveillance clinique tous les 3 mois
- Echographie et duodénoscopie tous les 6 mois pendant 2 ans puis tous les ans pendant 3 ans.
-
COHORTE AMPULLOME : Etude des survies et description de la prise en charge des patients porteurs d’un ampullome vatérien dégénéré
- Status : Ouvert (15-12-2013 - 31-12-2022)
- Promoteur : Fédération Francophone de Cancérologie Digestive (FFCD)
- Al-Hawary MM, Francis IR, Chari ST et al.
Pancreatic ductal adenocarcinoma radiology reporting template: consensus statement of the society of abdominal radiology and the american pancreatic association.
Gastroenterology. 2014;146:291-304.
- Amin MB, Greene FL, Edge SB et al. The Eighth Edition AJCC
Cancer Staging Manual : Continuing to build a bridge from a populationbased to a more “personalized” approach to cancer staging.
CA Cancer J Clin 2017; 67: 93–99
- Kawabata Y, Tanaka T, Nishisaka T et al.
Cytokeratin 20 (CK20) and apomucin 1 (MUC1) expression in ampullary carcinoma: Correlation with tumor progression and prognosis.
Diagn Pathol. 2010 ;5:75.
- Kim BJ, Jang HJ, Kim JH et al.
KRAS mutation as a prognostic factor in ampullary adenocarcinoma: a meta-analysis and review.
Oncotarget. 2016 ;7:58001-58006.
- Lee SY, Jang KT, Lee KT et al.
Can endoscopic resection be applied for early stage ampulla of Vater cancer?
Gastrointest Endosc. 2006 ;63:783-8.
- Morini S, Perrone G, Borzomati D et al.
Carcinoma of the ampulla of Vater: morphological and immunophenotypical classification predicts overall survival.
Pancreas. 2013 ; 42 : 60-6.
- Nagtegaal ID, Odze RD, Klimstra D et al.
The 2019 WHO classification of tumours of the digestive system.
Histopathology 2020; 76: 182– 188
- Tao LY, Zhang LF, Xiu DR et al.
Prognostic significance of K-ras mutations in pancreatic cancer: a meta-analysis.
World J Surg Oncol. 2016;14:146.
-
Vanbiervliet Geoffroy et al.Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline


