Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 1er septembre 2021.
- Cette référence propose la conduite à tenir diagnostique et thérapeutique devant une tumeur épithéliale de l'appendice.
- Ces tumeurs sont le plus souvent de découverte fortuite lors d'une appendicectomie pour syndrome appendiculaire ou lors d'une exploration chirurgicale de l'abdomen.
- Le terme de mucocèle est réservé à la macroscopie (accumulation de mucus dans l'appendice).
- Le pseudomyxome péritonéal (PMP) est caractérisé par l'accumulation d'ascite et d'implants mucineux dans la cavité péritonéale.
| OMS 2019 | PSOGI 2016 |
|
Lésions non invasives
* la totalité de l'appendice doit être soumis à l'examen histologique |
| Néoplasie mucineuse appendiculaire de bas grade (LAMN-G1) | |
|
Lésions invasives
|
| Adénocarcinome non mucineux - type colorectal classique (bas grade ou haut grade) | Adénocarcinome non mucineux (type colorectal classique) |
(Carr, 2016 ; Davison, 2014 ; Yantiss, 2009 ; Pai,2009 ; Misdraji, 2003)
|
Tumeur primitive
OMS 2019
|
Maladie péritonéale Terminologie PSOGI 2016 * |
Néoplasie appendiculaire et péritonéale Terminologie AJCC 8ème édition |
| Néoplasie appendiculaire mucineuse de bas grade (LAMN) | Carcinose mucineuse péritonéale de bas grade | Néoplasie mucineuse de bas grade (G1) |
| Adénocarcinome mucineux sans cellules en bague à chaton | Carcinose mucineuse péritonéale de haut grade | Adénocarcinome mucineux avec haut grade cyto-nucléaire modérément différencié (G2) |
| Adénocarcinome mucineux avec ou à cellules en bague à chaton | Carcinose mucineuse péritonéale de haut grade avec cellules en bague à chaton | Adénocarcinome mucineux avec haut grade cyto-nucléaire et/ou à cellules en bague à chaton (G3) |
Les grades G2 et G3 correspondent à des hauts grades pour l'AJCC.
* Des discordances existent rarement entre le grade de la tumeur appendiculaire et celui de la localisation péritonéale. Le grade de la maladie péritonéale reflète mieux l'évolution clinique et devrait donc être pris en compte pour la prise en charge thérapeutique.
- Terme clinique (et non histopathologique) correspondant à la dissémination intrapéritonéale de cellules muco-sécrétantes responsables d’une accumulation de mucine dans la cavité péritonéale. L’appendice est maintenant reconnu comme le premier organe responsable, même si les carcinoses mucineuses peuvent occasionnellement provenir d’adénocarcinomes mucineux d’autres organes (vésicule biliaire, estomac, trompe, ovaire ou origine colorectale).
- Pour le groupe PSOGI 2016 :
- Mucine sans cellule épithéliale
- Pseudomyxome de bas grade = carcinose mucineuse péritonéale de bas grade
- Pseudomyxome de haut grade = carcinose mucineuse péritonéale de haut grade
- Pseudomyxome avec cellules en bague à chaton = carcinose mucineuse péritonéale de haut grade avec cellules en bague à chaton.
- Remarques :
- Le pseudomyxome peut être associé à tout type de tumeur mucineuse.
- Les carcinoses mucineuses péritonéales font partie des tumeurs rares du péritoine. Ces tumeurs, avec les mucocèles, font l’objet d’un recensement par le groupe RENAPE depuis 2011 et une relecture par l’un des pathologistes du groupe RENAPATH est recommandée depuis 2012 (relecture de la totalité de l'appendice par un centre expert).
- Dans son acceptation la plus restreinte, le terme de "carcinoïde" est réservé actuellement aux tumeurs endocrines digestives associées à un syndrome carcinoïde clinique dû à l'hyper-sécrétion de sérotonine (tumeurs dites fonctionnelles), rares au niveau de l'appendice.
- Les tumeurs neuroendocrines appendiculaires représentent 20 % de l'ensemble des tumeurs endocrines digestives ; ce sont les tumeurs endocrines digestives les plus fréquentes après les tumeurs du grêle. Le plus souvent situées au niveau de la pointe de l'appendice, ces tumeurs ont, dans la grande majorité des cas, un comportement très peu agressif, bénin malgré l'infiltration quasi-constante de la musculeuse.
- Goblet Cell Adenocarcinoma (GCC) anciennement goblet cell carcinoid : tumeur mixte constituée d’éléments épithéliaux et neuroendocrines avec présence de cellules caliciformes « goblet cells » de type intestinal. Possibilité d'évolution vers un adénocarcinome mucineux ou à cellules en bague à chaton.
- Les carcinomes neuroendocrines, très rares au niveau de l'appendice, sont presque exclusivement bien différenciés. La survie à 5 ans des patients traités pour une tumeur endocrine de l'appendice est excellente pour les formes localisées.
- L'index mitotique doit être exprimé comme le nombre de mitoses par 2 mm2 (équivalent à 10 champs à fort grossissement à x40), déterminé par le comptage de 50 champs de 0,2 mm2 (soit une aire totale de 10 mm2).
- L'index de prolifération (Ki67) est déterminé par comptage d'au moins 500 cellules dans les régions de plus fort marquage (hot-spots).
| Grade | Index mitotique (IM) / Index de prolifération (Ki67) |
| G1 |
IM <2 et/ou Ki67 ≤2 %
|
| G2 |
IM de 2 à 20 et/ou Ki67 de 3 à 20 %
|
| G3 |
IM >20 et/ou Ki67 >20 %
|
- Le grade final est basé sur celui des 2 indices classant la lésion dans la catégorie de plus haut grade.
- Moitié proximale / moitié distale / diffus / autres
- Invasion de la base appendiculaire : oui / non / non évaluable
- Taille de la tumeur (cm)
- Type histologique
- Différenciation : bien / modérée / peu / indifférenciée
- Aspect histologique de la tumeur : plan / villeux / cribriforme...
- Perforation tumorale : oui / non
- Pushing : oui / non
- Budding : oui / non
- Pour les tumeurs neuroendocrines :
- Tumeur neuroendocrine de grade I, tumeur neuroendocrine de grade II, carcinome neuroendocrine
- Ki67 en %
- Compte de mitoses pour 10 grands champs
- Pour les tumeurs neuroendocrines :
- Invasion vasculaire
- Infiltration péri-nerveuse
- Présence de cellules en bague à chaton : oui / non et %
- Evaluation de l'infiltration pariétale de la mucine / évaluation de l'infiltration pariétale de la tumeur
- Statut ganglionnaire TNM
- Marges : distance aux marges chirurgicales et état des marges (cellules tumorales / dysplasie ou mucine acellulaire)
- Cytologie péritonéale
- Résultats des biopsies péritonéales éventuelles.
- Le bilan est habituellement fait après appendicectomie et dépend de la forme anatomo-pathologique.
- Tumeur endocrine
- <1 cm
- Bien différenciée
- Limitée à la musculeuse
- Sans angioinvasion
- Sans atteinte de la base appendiculaire ?
RENATEN
- Scanner thoracique
- Scanner abdomino-pelvien
- Imagerie nucléaire
- Coloscopie totale (fréquence élevée de tumeurs associées)
- Exploration du grêle (entéroscanner)
- Biologie : chromogranine A sérique
- IRM si métastases hépatiques
- Echographie cardiaque si syndrome carcinoïde
- TEP au 18F-FDG si carcinome neuroendocrine
option :
Adresser à un
centre expert
RENAPE
* description de l'intestin grêle, du
type d'atteinte, existence ou non
d'une rétraction mésentérique,
atteinte ou non des coupoles,
présence d'une ascite.
Score de Sugarbaker
Découverte
peropératoire de lésions
péritonéales
Syndrome
appendiculaire
Description de la carcinose *
région par région (photos-vidéos),
prélèvements anatomo-pathologiques
de la carcinose ± appendicectomie
(appendice perforé ou péritonite)
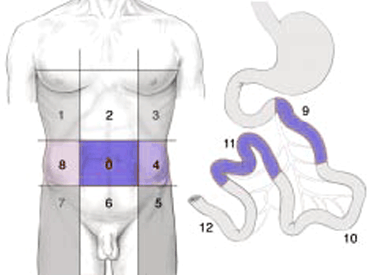
| 0 | Central | 7 | Inférieur droit |
| 1 | Supérieur droit | 8 | Flanc droit |
| 2 | Epigastre | 9 | Jéjunum supérieur |
| 3 | Supérieur gauche | 10 | Jéjunum inférieur |
| 4 | Flanc gauche | 11 | Iléon supérieur |
| 5 | Inférieur gauche | 12 | Iléon inférieur |
| 6 | Pelvis |
- Index péritonéal définissant précisément l'étendue de la carcinose.
- Chacune des 13 régions est notée selon le volume tumoral :
- 0 si absence de tumeur
- 1 si tissu tumoral inférieur à 0,5 cm
- 2 si entre 0,5 et 5 cm
- 3 si supérieur à 5 cm ou atteinte de la totalité de la région.
- L'index total peut varier de 1 à 39.
- La qualité de la cytoréduction est exprimée selon l'index de "completness of cytoreduction" (CCR)
- CCR 0 : aucun résidu tumoral macroscopique
- CCR 1 : aucun des nodules résiduels ne mesurent plus de 2,5 mm
- CCR2 : diamètre des nodules tumoraux résiduels supérieur à 2,5 mm.
- Données démographiques (date de naissance, lieu d'habitation)
- Médecin correspondant, date et lieu du diagnostic
- Index OMS, poids habituel, poids actuel, taille
- Antécédents familiaux de cancer
- Comptes-rendus opératoire et anatomo-pathologique (si malade déjà opéré)
- Comorbidités du patient (cardiaque, rénale, neurologique)
- Bilan d'extension (selon la référence et disponibilité de l'imagerie)
- Si présence de carcinomatose péritonéale, décrire l'étendue des lésions selon le score de Sugarbaker.
| Classification OMS | Description |
| 0 | Capable d'une activité identique à celle précédant la maladie, sans aucune restriction. |
| 1 | Activité physique diminuée mais ambulatoire et capable de mener un travail. |
| 2 | Ambulatoire et capable de prendre soin de soi, incapable de travailler. Alité <50 % de son temps. |
| 3 | Capable de seulement quelques soins personnels. Alité ou chaise >50 % du temps. |
| 4 | Incapable de prendre soin de lui-même, alité ou chaise en permanence. |
| Stade pTNM de la tumeur | Descriptif |
| pTis | Extension "pushing type" jusque dans la musculeuse |
| pT1 et pT2 | Non applicable pour les LAMN/HAMN * |
| pT3 | La tumeur s'étend à travers la musculeuse dans la sous-séreuse ou le méso-appendiculaire |
| pT4a | La tumeur pénètre au-delà du péritoine viscéral. Ceci comprend des cellules tumorales et/ou du mucus acellulaire (sans cellules tumorales identifiables). |
| pT4b | La tumeur s'étend par contiguïté à d'autres organes dont le péritoine incluant la présence de mucus acellulaire |
| M1a | Mucus intra-péritonéal acellulaire (sans cellules tumorales identifiables) |
| M1b |
Métastases intrapéritonéales avec cellules tumorales et implants
± infiltration superficielle d'organes abdominopelviens (rate, capsule hépatique, ovaires, intestins ou autres) |
| Mic | Métastases extrapéritonéales ** |
|
Stade pTNM
de la tumeur
|
Descriptif |
| pTis | Prolifération limitée à la muqueuse |
| pT1 | Infiltration de la sous-muqueuse |
| pT2 | Infiltration de la musculeuse |
| pT3 | Infiltration de la sous-séreuse |
| pT4a | Extension tumorale au-delà du péritoine viscéral |
| pT4b | Infiltration d'autres organes par contiguïté |
| M1a | Mucus intra-péritonéal acellulaire (sans cellules tumorales identifiables) |
| M1b | Métastases intra-péritonéales avec cellules tumorales et implants ± infiltration superficielle d'organes abdomino-pelviens (rate, capsule hépatique, ovaires, intestins ou autres...) |
| M1c | Métastases extra-péritonéales |
| Ganglions lymphatiques régionaux (N) | |
| N0 | Pas d'adénopathie régionale métastatique |
| N1 |
1 à 3 adénopathies régionales métastatiques
|
| N2 | ≥ 4 adénopathies régionales métastatiques |
| Nx | Pas de ganglion lymphatique analysé |
- Le grade histologique, en particulier pour les tumeurs mucineuses (plus de 50 % de la tumeur est constituée de mucus extracellulaire), est nécessaire pour séparer le stade IVa du stade IVb.
| Classification | Grade | Différenciation |
| TNE G1 | G1 | Bien différencié |
| TNE G2 | G2 | Bien différencié |
| TNE G3 | G3 | Bien différencié |
| CNE * | G3 | Peu différencié, à grandes ou petites cellules |
| MiNEN | Néoplasie mixte neuroendocrine - non neuroendocrine |
|
- Les CNE doivent être classés comme pour les carcinomes exocrines de localisation identique.
| Tumeur de l'appendice | |
| Tx | La tumeur primitive ne peut pas être évaluée |
| T0 | Pas de signe de tumeur primitive |
| T1 | Taille tumorale ≤ 2 cm |
| T2 | Taille tumorale entre 2 et 4 cm |
| T3 | Taille tumorale >4 cm ou envahit la sous-séreuse ou le méso-appendice |
| T4 | Envahit la séreuse ou les organes adjacents (sauf invasion pariétale de la sous-séreuse ou de l'intestin) |
| Ganglions régionaux | |
| Nx | Les ganglions régionaux ne peuvent pas être évalués |
| N0 | Pas de signe de métastase ganglionnaire |
| N1 | Métastases ganglionnaires régionales |
| Métastases | |
| Mx | Les métastases à distance ne peuvent pas être évaluées |
| M0 | Pas de métastase à distance |
| M1 |
Métastases à distance :
M1a : métastases hépatiques uniquement
M1b : métastases disséminées à au moins une localisation extrahépatique
M1c : métastases hépatiques et extrahépatiques
|
- Dans cette classification de l'UICC, l'invasion de la sous-séreuse ou du méso-appendice et le seuil de 4 cm n'ont pas été validés. La classification ENETS (Rindi, 2007) est basée sur des seuils cliniquement pertinents :
- T1 : tumeur ≤ 1 cm envahissant la sous-muqueuse et la muscularis propria
- T2 : tumeur ≤ 2 cm envahissant la sous-muqueuse, la muscularis propria et/ou envahissant focalement (jusqu'à 3 mm) la sous-séreuse, du méso-appendice
- T3 : tumeur >2 cm et/ou invasion étendue (plus de 3 mm) de la sous-séreuse, du méso-appendice
- T4 : la tumeur envahit le péritoine ou d'autres organes.
hors TNE
- résection R1/R2
- ou grade 2
- ou invasion lympho-vasculaire
- ou adénopathie suspecte ou métastatique
- ou localisation à la base
- ou invasion de la sous-séreuse >3 mm
- Grade 1 ou grade 2 faible
- et localisation au
niveau du corps/pointe - et pas d'invasion lympho-vasculaire
- et sous-séreuse respectée
ou invasion focale ≤ 3 mm - et pas d'adénopathie suspecte
Pas de traitement
droite
mucine acellulaire
et PCI >3
maladie résiduelle
- Appendicectomie avec :
- exérèse du méso-appendiculaire
- avec agrafage du bas-fond caecal
en centre
expert RENAPE
péritonéale
avec péritonite
centre RENAPE
- Description des lésions
- Biopsies
- Même démarche que pour l'adénocarcinome du côlon.
- Si coloscopie négative : refaire à 5 ans
- Si coloscopie positive : refaire à 1 an.
- voir Cancers du côlon
- Non rompu, pas de malignité : pas de surveillance
- Rompu : examen clinique + scanner TAP ou IRM abdominale de diffusion + dosage ACE et CA 19.9 : surveillance en centre expert à moduler en fonction de la cellularité et du grade de la tumeur.
- Les métastases pouvant survenir très tardivement, le malade doit être informé de la nécessité d'une surveillance prolongée en fonction des facteurs pronostiques :
- Tumeurs appendiculaires ≤ 1 cm ou 1 à 2 cm et base non envahie et absence de métastase ganglionnaire dans le méso-appendice et absence d'emboles veineux ou lymphatiques et nature non adénocarcinoïde : pas de suivi.
- Autres situations : suivi minimal annuel comprenant :
- interrogatoire
- examen clinique
- contrôle de l’efficacité du traitement symptomatique éventuel
- dosage chromogranine A sérique
- échographie hépatique (ou TDM).
- Les TNE de l'appendice rentrent exceptionnellement dans le cadre d'une NEM.
- Brighi N, La Rosa S, Rossi G, Grillo F et al.
Morphological Factors Related to Nodal Metastases in Neuroendocrine Tumors of the Appendix: A Multicentric Retrospective Study.
Ann Surg. 2020 ;271:527-533.
- Cancer Staging Handbook from the AJCC Cancer Staging Manual.
8th édition, Springer, New York.
- Carr NJ, Arends M J, Deans GT et al.
Tumors of the appendix. In : S. R. Hamilton end L. A. Aaltonen (eds.), Word Health Organization Classification of Tumours. Tumours of the Digestive System.
Lyon, France : IARC Press, 2000.
- Carr NJ, Bibeau F, Bradley RF, Dartigues P et al.
The histopathological classification, diagnosis and differential diagnosis of mucinous appendiceal neoplasms, appendiceal adenocarcinomas and pseudomyxoma peritonei.
Histopathology. 2017 ;71:847-858.
- Carr NJ, Cecil TD, Mohamed F, Sobin LH et al; Peritoneal Surface Oncology Group International.
A Consensus for Classification and Pathologic Reporting of Pseudomyxoma Peritonei and Associated Appendiceal Neoplasia: The Results of the Peritoneal Surface Oncology Group International (PSOGI) Modified Delphi Process.
Am J Surg Pathol. 2016 ;40:14-26.
- Clift AK, Kornasiewicz O, Drymousis P, Faiz O et al.
Goblet cell carcinomas of the appendix: rare but aggressive neoplasms with challenging management.
Endocr Connect. 2018 ;7:268-277.
- Couvelard A.
Tumeurs endocrines gastro-intestinales : particularités morphologiques et clinico-pathologiques.
Ann Pathol. 2005;25:499-509.
- Dartigues P, Isaac S, Villeneuve L et al.
Peritoneal pseudomyxoma: an overview emphasizing pathological assessment and therapeutic strategies.
Ann Pathol. 2014 ;34:14-2
- D'Assignies G, Fina P, Bruno O, Vullierme MP et al.
High sensitivity of diffusion-weighted MR imaging for the detection of liver metastases from neuroendocrine tumors: comparison with T2-weighted and dynamic gadolinium-enhanced MR imaging.
Radiology. 2013 ;268:390-9.
- Davison JM, Choudry HA Pingpank JF et al.
Clinicopathologic and molecular analysis of disseminated appendiceal mucinous neoplasms: identification of factors predicting survival and proposed criteria for a three-tiered assessment of tumor grade.
Mod Pathol. 2014 ;27:1521-39.
- Delhorme JB, Averous G , Dohan A, Quenet F et al.
Tumeurs appendiculaires (hors TNE)
Thésaurus National de Cancérologie Digestive, avril 2020, en ligne
- De Mestier L, Lepage C, Baudin E, Coriat R et al.
Thésaurus National de Cancérologie Digestive (TNCD). Digestive Neuroendocrine Neoplasms (NEN): French Intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, GTE, RENATEN, TENPATH, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SFR).
Dig Liver Dis. 2020 ;52:473-492.
- Dhage-Ivatury S, Sugarbaker PH.
Update on the surgical approach to mucocele of the appendix.
J Am Coll Surg. 2006;202:680-4.
- Dohan A, Hoeffel C, Soyer P, Jannot AS et al.
Evaluation of the peritoneal carcinomatosis index with CT and MRI.
Br J Surg. 2017 ;104:1244-1249.
- Elias D, Sideris L, Baton O et al.
Traitement chirurgical à visée curatrice des carcinoses péritonéales.
EMC 40-085 (2004).
- Foster JM, Sleightholm RL, Wahlmeier S, Loggie B et al.
Early identification of DPAM in at-risk low-grade appendiceal mucinous neoplasm patients: a new approach to surveillance for peritoneal metastasis.
World J Surg Oncol. 2016;14:243.
- Fournier K, Rafeeq S, Taggart M, Kanaby P et al.
Low-grade Appendiceal Mucinous Neoplasm of Uncertain Malignant Potential (LAMN-UMP): Prognostic Factors and Implications for Treatment and Follow-up.
Ann Surg Oncol. 2017 24:187-193.
- Garcia-Carbonero R, Sorbye H, Baudin E, Raymond E et al.Vienna Consensus Conference participants.
ENETS Consensus Guidelines for High-Grade Gastroenteropancreatic Neuroendocrine Tumors and Neuroendocrine Carcinomas.
Neuroendocrinology. 2016;103:186-94.
- Glehen O, Cotte E, Brigand C et al.
Nouveautés thérapeutiques dans la prise en charge des carcinoses péritonéales d'origine digestive : chirurgie de cytoréduction et chimiothérapie intrapéritonéale.
Rev Med Interne. 2006 ;27:382-91.
- Guaglio M, Sinukumar S, Kusamura S, Milione M et al.
Clinical Surveillance After Macroscopically Complete Surgery for Low-Grade Appendiceal Mucinous Neoplasms (LAMN) with or Without Limited Peritoneal Spread: Long-Term Results in a Prospective Series.
Ann Surg Oncol. 2018 ;25:878-884.
- Legué LM, Creemers GJ, de Hingh IHJT, Lemmens VEPP et al.
Review: Pathology and Its Clinical Relevance of Mucinous Appendiceal Neoplasms and Pseudomyxoma Peritonei.
Clin Colorectal Cancer. 2019;18:1-7
- Misdraji J, Yantiss RK, Graeme-Cook FM et al.
Appendiceal mucinous neoplasms: a clinicopathologic analysis of 107 cases.
Am J Surg Pathol. 2003 ;27:1089-103.
- Nagtegaal ID, Odze RD, Klimstra D, Paradis V et al.
WHO Classification of Tumours Editorial Board. The 2019 WHO classification of tumours of the digestive system.
Histopathology. 2020 ;76:182-188.
- Norman J Carr, Thomas D Cecil et al
A consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia.
Am J Surg Pathol. 2016 ;40:14-26
- Oberg K, Couvelard A, Delle Fave G, Gross D et al.
Antibes Consensus Conference participants. ENETS Consensus Guidelines for Standard of Care in Neuroendocrine Tumours: Biochemical Markers.
Neuroendocrinology. 2017;105:201-211.
- Pai RK, Beck AH, Norton JA et al.
Appendiceal mucinous neoplasms: clinicopathologic study of 116 cases with analysis of factors predicting recurrence.
Am J Surg Pathol. 2009;33:1425-39.
- Perren A, Couvelard A, Scoazec JY, Costa F et al. Antibes Consensus Conference participants.
ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Pathology: Diagnosis and Prognostic Stratification.
Neuroendocrinology. 2017;105:196-200.
- Plockinger U, Rindi G, Arnold R, Eriksson B et al.
Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS).
Neuroendocrinology 2004;80 :394-424.
- Rault-Petit B, Do Cao C, Guyétant S, Guimbaud R et al.
Current Management and Predictive Factors of Lymph Node Metastasis of Appendix Neuroendocrine Tumors: A National Study from the French Group of Endocrine Tumors (GTE).
Ann Surg. 2019 ;270:165-171.
- Recommandations de bonnes pratiques cliniques. Pseudomyxomes et mésothéliomes péritonéaux.
Diagnostic, traitement, et surveillance.
Journal de Chirurgie 2014 ; 151 (Hors-série 2) : S1-S63.
- Reid MD, Basturk O, Shaib WL, Xue Y et al.
Adenocarcinoma ex-goblet cell carcinoid (appendiceal-type crypt cell adenocarcinoma) is a morphologically distinct entity with highly aggressive behavior and frequent association with peritoneal/intra-abdominal dissemination: an analysis of 77 cases.
Mod Pathol. 2016;29:1243-53.
- Rindi G, Klöppel G, Couvelard A, Komminoth P et al.
TNM staging of midgut and hindgut (neuro) endocrine tumors: a consensus proposal including a grading system.
Virchows Arch. 2007 ;451:757-62.
- Ronnett BM, Shmookler BM, Sugarbaker PH et al.
Pseudomyxoma peritonei : new concepts in diagnosis, origin, nomenclature, and relationship to mucinous borderline (low malignant potential) tumors of the ovary.
Anat Pathol. 1997;2:197-226.
- Schraml C, Schwenzer NF, Sperling O, Aschoff P.
Staging of neuroendocrine tumours: comparison of [⁶⁸Ga]DOTATOC multiphase PET/CT and whole-body MRI.
Cancer Imaging. 2013;13:63-72.
- Solcia E, Klöppel G, Sobin LH, World Health Organization.
International Histological Classification of Tumors. Second Edition.
Springer, Berlin; 2000
- Sugarbaker PH.
When and When Not to Perform a Right Colon Resection with Mucinous Appendiceal Neoplasms.
Ann Surg Oncol. 2017 ;24:729-732.
- Tang LH, Shia J, Soslow RA, Dhall D et al.
Pathologic classification and clinical behavior of the spectrum of goblet cell carcinoid tumors of the appendix.
Am J Surg Pathol. 2008 ;32:1429-43.
- TNM classification of malignant tumours 8th edition
Edited by L.H. Sobin, M.K. Gospodarowicz, C Wittekind
International Union against Cancer.
- TNM Online.
Appendix - Carcinoma (ICD-O C18.1)
Wiley Interscience.
- Yantiss RK, Shia J, Klimstra DS et al.
Prognostic significance of localized extra-appendiceal mucin deposition in appendiceal mucinous neoplasms.
Am J Surg Pathol. 2009 ;33:248-55.


