Sommaire
Collaborateurs
Coordonnateurs régionaux
NOEL Georges
Centre Paul Strauss (67)
TAILLANDIER Luc
CHU de Nancy (54)
Rédacteurs
LE RHUN Emilie
CHRU de Lille (59)
QUETIN Philippe
CHR de Metz-Thionville (57)
RAMIREZ Carole
CHRU de Lille (59)
Ce référentiel, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaboré par un groupe de travail pluridisciplinaire de professionnels membres de l'Association des Neuro-Oncologues d'Expression Française (ANOCEF), en tenant compte des recommandations nationales, et conformément aux données acquises de la science au 11 mai 2016.
- Les tumeurs germinales primitives (TGP) du système nerveux central (SNC) sont histologiquement les mêmes que celles rencontrées dans les gonades. Elles sont donc d'origine extra-neurale mais rencontrées dans le SNC suite à la migration aberrante de cellules germinales primordiales lors de l'embryogenèse.
- La classification histologique distingue 2 grands groupes de significations pronostiques et d’implications thérapeutiques différentes :
- les germinomes (ou séminomes) sont les plus fréquents (45 %) des tumeurs germinales (Rosenblum, 2000). Ils sont composés de cellules de même aspect que les gonocytes primordiaux. Ils peuvent comporter des cellules syncitiotrophoblastiques qui expliquent la possibilité d’une faible sécrétion d’hCG.
- les tumeurs germinales non séminomateuses (TGNS) qui comportent :
- des tissus rappelant le fœtus
- les tératomes mature ou immature présentant une différenciation plus ou moins marquée vers les trois lignées embryonnaires (ectodermique, endodermique, mésodermique) et les tératomes avec transformation maligne. Les tératomes matures (ou dysembryomes) représentent 15 % des tumeurs germinales de la région pinéale. Ce sont les seules de grade bénin.
- le carcinome embryonnaire fait de grandes cellules avec des ébauches de structures épithéliales et un marquage immunohistochimique avec les anticorps anti-cytokératine, OCT4 et CD30.
- des tissus rappelant les annexes :
- le choriocarcinome identifié sur les éléments cytotrophoblastiques ou les cellules géantes syncitiotrophoblastiques et le marquage immunohistochimique (hCG et hPL)
- la tumeur du sac vitellin (yolk sac tumor) qui exprime l'alpha-fœtoprotéine.
- des tissus rappelant le fœtus
- Ces tumeurs peuvent être pures ou mixtes (plusieurs contingents).
- Ces tumeurs, rares en France, représentent moins de 1 % des tumeurs cérébrales primitives de l'adulte (Matsutani, 1997). Elles prédominent chez l'adolescent et l'adulte jeune de sexe masculin et de moins de 25 ans (65 % entre 11 et 20 ans). Elles sont plus fréquentes chez les asiatiques. Elles font l’objet d’un consensus international (Murray, 2015).
- Elles sont situées habituellement sur la ligne médiane dans la région pinéale dans 2/3 des cas (Villano, 2008 ; Matsutani, 1997) et/ou dans la région supra-chiasmatique dans 1/3 des cas, avec une prédilection pour la neuro-hypophyse (Matsutani, 2001).
- Les tumeurs bifocales (de la région pinéale et de la région supra-chiasmatique) ne sont pas considérées comme des métastases, et sont le plus souvent des germinomes (si les marqueurs sont négatifs. Les tumeurs uni- ou bifocales situées dans ces sites doivent faire évoquer une tumeur germinale et inciter à un dosage des marqueurs alpha-fœtoprotéine (αFP) et human chorionic gonadotrophin (βhCG totales) dans le sang et le liquide céphalo-rachidien (LCR).
- La localisation dans le thalamus et les hémisphères est rare (moins de 10 %, mais plus fréquente chez les asiatiques), de même que les atteintes multiples (10 %). Une atteinte méningée est parfois visible sur l’IRM ou par l’analyse du LCR.
- Souvent aigu, dans les tumeurs pinéales : hypertension intracrânienne par obstruction de l’aqueduc de Sylvius.
- De façon subaiguë/chronique dans les supra-sellaires :
- symptomatologie neuro-ophtalmologique : diplopie, altération du champ visuel, baisse de l'acuité visuelle (hémianopsie bitemporale par compression et/ou envahissement du chiasma optique), syndrome de Parinaud.
- symptomatologie neuroendocrine : panhypopituitarisme, diabète insipide, hyperprolactinémie.
- hypertension intracrânienne par croissance dans le troisième ventricule.
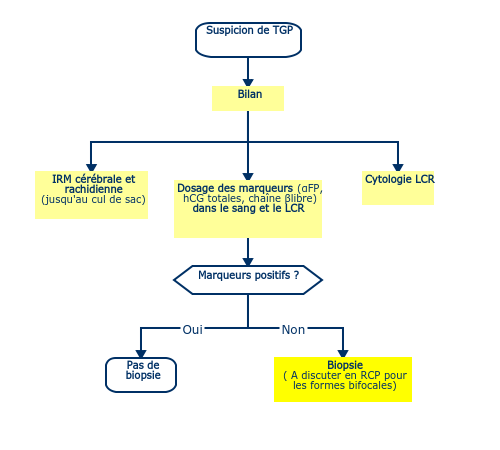
- Les marqueurs spécifiques, αFP et hCG totales (si possible aussi chaîne β libre), sont augmentés dans ⅓ des cas.
- Ils sont à rechercher dans le sang et dans le LCR.
- Normes :
- αFP <5 ng/mL, demi-vie : 5 à 7 jours.
- hCG totales < 5 à mUI/mL (0,5 à 0,7 mg/mL), demi-vie : 3 à 4 h.
- hCG chaîne β libre < 0,1 ng/mL, demi-vie : 3 à 4 h.
- La positivité d’un marqueur indique la présence (pas forcément exclusive) d’un composant ci- dessous :
- αFP > 5 ng/mL : contingent de tumeur vitelline
- hCG totales >50 mUI/mL : probable contingent choriocarcinome
- hCG totales entre 0,5 mUI/mL et 50 mUI/mL : probable contingent germinome sécrétant
- hCG totales normales (<0,5 mUI/mL) : possible contingent germinome pur et/ou tératome et/ou carcinome embryonnaire.
- L'augmentation de l'αFP ou des ßHCG dans le sang ou le LCR permet d'affirmer la nature germinale et sécrétante de la tumeur ; la preuve histologique n'est pas nécessaire. Pour les tumeurs non sécrétantes une preuve histologique est indispensable pour préciser le type par une biopsie voire une chirurgie si celle-ci n'est pas périlleuse, sauf en cas de lésions bifocales car la grande majorité sont des germinomes.
- Le LCR peut montrer une augmentation de la protéinorachie, une lymphocytose, des cellules malignes. En cas de doute sur la nature de ces cellules, une revue centralisée est souhaitable. La présence de cellules malignes au delà de J14 postopératoire signe l'existence de métastases.
- Le dosage de PALP n'est pas de pratique courante.
- Les TGP peuvent se développer sur la ligne médiane (région pinéale, et/ou à l'extrémité antérieure du 3ème ventricule sous forme uni- ou bifocale) ou dans le thalamus. Les tumeurs de la ligne médiane sont des masses qui peuvent provoquer une obstruction des voies d’écoulement liquidien. Les tumeurs des noyaux gris centraux sont des masses souvent kystiques et/ou hémorragiques, et s’accompagnent d’une atrophie du cerveau homolatéral.
- L’aspect radiologique ne préjuge pas de l’histologie. Les germinomes sont souvent bien limités, homogènes et sont rehaussés par le produit de contraste. Parfois ils sont hémorragiques ou présentent des calcifications.
- Les tératomes ont un aspect hétérogène et le rehaussement est inhomogène. Ils peuvent présenter des kystes intratumoraux et des calcifications.
Certaines de ces lésions peuvent disséminer d'où la nécessité de rechercher des localisations méningées et de réaliser une IRM spinale qui doit explorer la TOTALITÉ de l’axe y compris le cul de sac.
- Bilan endocrinien : recherche d'un diabète insipide (fondamental avant de débuter une chimiothérapie) et d'un déficit anté-hypophysaire
- Bilan neuro-ophtalmologique
- Bilan neuro-psychologique avant irradiation si possible
- Bilan radiologique : échographie testiculaire, scanner thoraco-abdomino-pelvien pour éliminer la métastase d'une tumeur germinale extracrânienne
- Consultation de préservation de la fertilité (avant de débuter la chimiothérapie).
- Les TGP sont des maladies curables pour la plupart. Il est recommandé de prendre un avis auprès d'une équipe expérimentée. La RCP Adolescents Jeunes Adultes (AJAs) de neuro-oncologie est compétente pour les TGP :
- Fiche à remplir : cliquer ici pour la télécharger

florence.ray@lyon.unicancer.fr ou souhir.mecellem@ihope.fr
- tous les lundi à 12h00
- à partir de votre téléphone :
- composer le : +33 (0)1 72 28 30 01
- taper le code d'accès : 493 625#
- connexion à la salle virtuelle Live Session : http://clb.emea.acrobat.com/salle1/ : connexion en tant qu'invité.
- En cas d’hydrocéphalie ou d'hypertension intracrânienne : ventriculo-cysternostomie par voie endoscopique ou dérivation ventriculo-péritonéale, voire dérivation externe avec analyse cytologique du LCR et dosage des marqueurs dans le sang ET dans le LCR.
- Des biopsies ne seront proposées que si le diagnostic n'est pas établi après le dosage des marqueurs dans le plasma et le LCR. Elles permettent d’éliminer les diagnostics différentiels tels que les gliomes et les tumeurs du parenchyme pinéal.
- La biopsie peut se faire par endoscopie lors du geste de ventriculocysternotomie. La constatation de localisations tumorales ventriculaires lors d’une ventriculo-cysternostomie ne suffit pas pour affirmer le caractère métastatique d’un germinome, si ces lésions ne sont pas visibles sur l’IRM.
- Compte tenu de la sensibilité à la chimiothérapie et à la radiothérapie, une chirurgie d'exérèse première est déconseillée. L'exérèse est réservée aux tératomes matures et en cas de reliquat après chimiothérapie dans les tumeurs non séminomateuses (O’Callaghan, 1997).
- Les TGP sont sensibles aux dérivés du platine, à l'étoposide et à l'ifosfamide. Le schéma thérapeutique est fonction du caractère sécrétant ou non de la lésion et de l'existence de métastases.
- La radiothérapie reste une arme indispensable. Sa dose et son étendue varient selon le type histologique et le caractère localisé ou métastasé.
- Il est important de noter que l'exérèse chirurgicale n'est pas systématique mais proposée après discussion en RCP en cas de persistance d'un bourgeon tumoral.
- Un protocole prospectif est actuellement ouvert en France, sans limite d'âge : SIOP GCT II. Contact pour la France : Dr Didier FRAPPAZ.
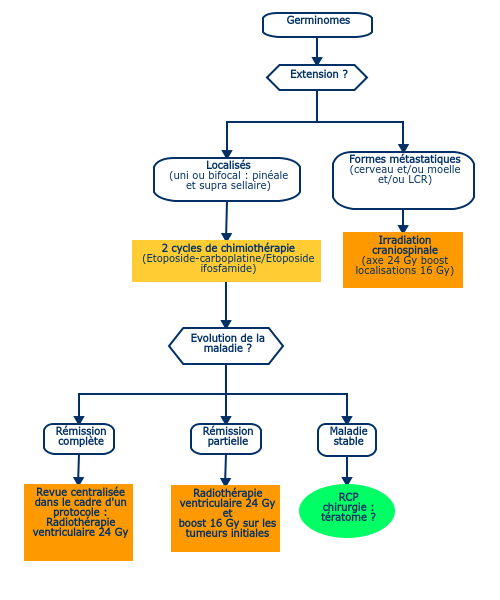
- Excellent pronostic : survie sans récidive de l'ordre 90 %.
- Ils sont radiocurables par une irradiation crâniospinale. Les champs de radiothérapie ventriculaire étant complexes, une radiothérapie conformationnelle avec modulation d'intensité, ou une radiothérapie conformationnelle en 3 dimensions sont à utiliser. L’utilisation de protons pour l’irradiation ventriculaire peut être proposée.
- Cependant, les répercussions neurocognitives et endocriniennes, la survenue de tumeurs métachrones extra-système nerveux central et de cancers secondaires à long terme chez des sujets jeunes ayant une longue espérance de vie sont à craindre.
- Utilisation dans les formes localisées (y compris bifocales) de chimiothérapie première pour réduire les champs de l'irradiation aux ventricules avec boost sur les tumeurs initiales (voire sans boost exclusivement dans le cadre d'un protocole de désescalade thérapeutique) (Calaminus, 2013).
- Dans les formes métastatiques, indication de radiothérapie crânio-spinale sans chimiothérapie.
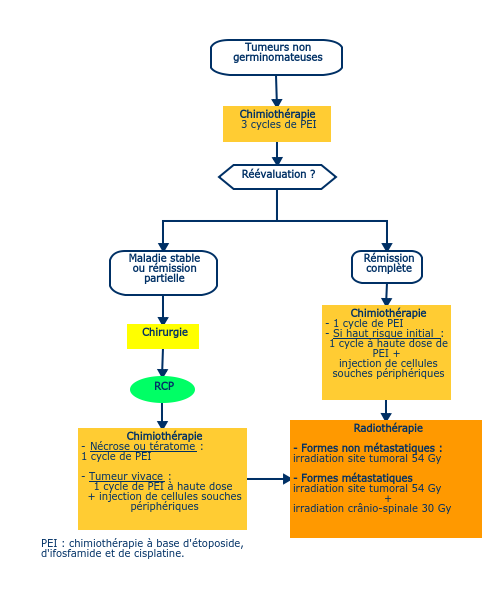
- Leur pronostic est moins bon que celui des germinomes (60-70 % de guérison). Le pronostic dépend du contingent tumoral le plus chimiorésistant.
- La chimiothérapie première (4 cycles) seule ne permet pas leur contrôle à long terme (Baranzelli, 1998) et la radiothérapie est indispensable.
- Les meilleurs survies sont obtenues en associant une chimiothérapie) à base d'étoposide, d'ifosfamide et de cisplatine (PEI) à une irradiation du site tumoral systématique à la dose de 54 Gy en 30 fractions de 1,8 Gy (Calaminus, 2005 ; Goldman, 2015).
- Une seconde chirurgie est indiquée, même si les marqueurs sont redevenus normaux en cas de masse résiduelle en imagerie au moment de la troisième cure (rémission partielle ou maladie stable)(Weiner, 1999 ; Villano, 2008). La suite du traitement doit alors se discuter en RCP en fonction du résultat histologique :
- dans les formes à haut risque biologique (alpha FP >1000 ng/mL), le dernier cycle de chimiothérapie peut être remplacé par un cycle à haute dose (HD PEI) avec réinjection de cellules souches périphériques (à discuter en RCP).
- dans les formes métastatiques, on associera à la radiothérapie du site tumoral une irradiation crânio-spinal de 30 Gy.
- Les TGP intracrâniennes récidivantes peuvent bénéficier d'une chimiothérapie standard puis intensive avec autogreffe de cellules souches périphériques qui amène de 50 % (tumeurs non germinomateuses) à 90 % (germinomes) de contrôle tumoral prolongé (Finlay, 2008).
- Un avis multidisciplinaire doit être pris, pour discuter des possibilités chirurgicales, de ré-irradiation ou de chimiothérapie, en fonction du type de rechute.
- Les TGP survenant chez des sujets jeunes ayant un espoir de longue survie, il est indispensable de dépister et prendre en charge les séquelles :
- neuropsychologiques et qualité de vie (Cf. annexe)
- endocriniennes (dues à la tumeur ou induites par la radiothérapie) : surveillance annuelle par un endocrinologue
- risque de néoplasie secondaire : surveillance clinique régulière, et IRM crânienne tous les 5 ans dans le suivi à log terme
- cataractes radio-induites : surveillance régulière et consultation en cas de symptomatologie
- séquelles rénales : surveillance biologique de la fonction rénale régulière initialement
- séquelles auditives : consultation ORL si sensation de baisse auditive.
- Les cures sont espacées de 3 semaines : J1=J21 :
- cures 1 et 3 :
- J1 : carboplatine 600mg/m²/j
- J1 à J3 : étoposide 100 mg/m²/j
- cures 2 et 4 :
- J1 à J5 : ifosfamide 1800 mg/m²/j
- J1 à J3 : étoposide 100 mg/m²/j
- cures 1 et 3 :
- PEI :
- J1 à J5 : cisplatine 20 mg/m²/j
- J1 à J3 : étoposide 100 mg/m²/j
- J1 à J5 : ifosfamide 1500 mg/m²/j
- PEI haute dose + injection de cellules souches circulantes périphériques (CSP)
- J1 à J5 : cisplatine 20 mg/m²/j
- J1 à J5 : étoposide 300 mg/m²/j
- J1 à J5 : ifosfamide 2000 mg/m²/j
- Baranzelli MC, Patte C, Bouffet E, Portas M et al.
An attempt to treat pediatric intracranial alphaFP and betaHCG secreting germ cell tumors with chemotherapy alone. SFOP experience with 18 cases.
J Neurooncol. 1998;37:229-39.
- Bouffet E, Baranzelli MC, Patte C, Portas M et al.
Combined treatment modality for intracranial germinomas: results of a multicentre SFOP experience. Société Francaise d'Oncologie Pediatrique.
Br J Cancer 1999;79:1199-204.
- Buckner JC, Peethambaram PP, Smithson WA, Groover RV et al.
Phase II trial of primary chemotherapy followed by reduced-dose radiation for CNS germ cell tumors.
J Clin Oncol. 1999;17:933-40.
- Calaminus G, Bamberg M, Jurgens H, Kortmann RD et al.
Impact of surgery, chemotherapy and irradiation on long term outcome of intracranial malignant non-germinomatous germ cell tumors: results of the German Cooperative Trial MAKEI 89.
Klin Padiatr. 2004;216:141-9.
- Calaminus G, Kortmann R, Worch J, Nicholson JC et al.
SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease.
Neuro Oncol. 2013 ;15:788-96.
- Finlay J, Gardner S, Allen J.
Outcome of children and adults with recurrent central nervous sytem germ cell tumors. A retrospective study 2003-2008.
Abstract MA-67, SNO (Las Vegas 2008).
- Matsutani M, Sano K, Takakura K, Fujimaki T et al.
Primary intracranial germ cell tumors: a clinical analysis of 153 histologically verified cases.
J Neurosurg. 1997 Mar;86:446-55.
- Matsutani M. Japanese Pediatric Brain Tumor Study Group.
Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience.
J Neurooncol. 2001;54:311-6.
- Murray MJ, Bartels U, Nishikawa R, Fangusaro J et al.
Consensus on the management of intracranial germ-cell tumours.
Lancet Oncol. 2015 ;16:e470-7
- O'Callaghan AM, Katapodis O, Ellison DW, Theaker JM et al.
The growing teratoma syndrome in a nongerminomatous germ cell tumor of the pineal gland: a case report and review.
Cancer. 1997 Sep 1;80:942-7.
- Rosenblum MK, Matstani M, Van Meir EG.
CNS germ cell tumors. In : Kleihues P, Cavanee WK eds. Pathology and Genetics Tumours of the nervous system.
Lyon : IARC Press, 2000, 207-214.
- Sawamura Y, de Tribolet N, Ishii N, Abe H.
Management of primary intracranial germinomas: diagnostic surgery or radical resection?
J Neurosurg. 1997;87:262-6.
- Védrine L, Bauduceau O, Fayolle M, Le Moulec S, Ceccaldi B.
Combined chemotherapy and radiation therapy for intracranial germinomas. The Val-de-Grace hospital experience.
Cancer Radiother. 2005;9:335-40.
- Villano JL, Propp JM, Porter KR, Stewart AK et al.
Malignant pineal germ-cell tumors: an analysis of cases from three tumor registries.
Neuro Oncol. 2008;10:121-30.
- Villano JL, Virk IY, Ramirez V, Propp JM et al.
Descriptive epidemiology of central nervous system germ cell tumors : nonpineal analysis.
Neuro Oncol. 2010 Mar;12:257-64.
- Weiner HL, Finlay JL.
Surgery in the management of primary intracranial germ cell tumors.
Childs Nerv Syst. 1999;15:770-3.


