Sommaire
Collaborateurs
Coordonnateurs interrégionaux
CLEMENT-DUCHENE Christelle
Institut de Cancérologie de Lorraine (54)
Coordonnateurs régionaux
CAZES Aurélie
APHP Bichat (75)
DAMOTTE Diane
APHP Cochin (75)
DUCHEMANN Boris
AP-HP Hôpital Avicenne (93)
Rédacteurs
CASSE Jean-Mathieu
Cypath Metz (57)
DUBOUIS Ludovic
Cypath Metz (57)
FORET Thibault
Centre de Médecine Nucléaire du Parc (71)
LUPO Audrey
APHP Cochin (75)
Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des Dispositifs Spécifiques Régionaux du Cancer de Bourgogne-Franche-Comté (OncoBFC), du Grand Est (NEON) et d'Île-de-France (ONCORIF), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 16 mai 2024.
- Les tumeurs broncho-pulmonaires regroupent différents types histologiques :
- carcinomes broncho-pulmonaires non à petites cellules : adénocarcinome, carcinome épidermoïde, carcinome indifférencié à grandes cellules
- carcinomes broncho-pulmonaires à petites cellules.
- Les tumeurs neuroendocrines broncho-pulmonaires forment un groupe hétérogène de tumeur, tant sur le plan histologique qu'immunohistochimique ou moléculaire, mais aussi pronostique et thérapeutique. Elles regroupent les carcinomes neuroendocrines à grandes cellules, les carcinomes bronchiques à petites cellules, les carcinoïdes typiques et atypiques.
- La classification histologique de l’Organisation Mondiale de la Santé pour les tumeurs bronchiques date de 2015 (Travis, 2015). Une actualisation a été réalisée en 2021.
| Types et sous-types histologiques | Code ICDO |
| TUMEURS EPITHELIALES | |
| Papillomes | |
| Papillome épidermoïde, SAI | 8052/0 |
| Papillome épidermoïde, inversé | 8053/0 |
| Papillome glandulaire | 8260/0 |
| Papillome épidermoïde et glandulaire mixte | 8560/0 |
| Adénomes | |
| Pneumocytome sclérosant | 8832/0 |
| Adénome alvéolaire | 8251/0 |
| Adénome papillaire | 8260/0 |
| Adénome bronchiolaire / tumeur papillaire muconodulaire ciliée | 8140/0 |
| Cystadénome mucineux | 8470/0 |
| Adénome des glandes muqueuses | 8480/0 |
| Lésions glandulaires précurseurs | |
|
Hyperplasie adénomateuse atypique
|
8250/0 |
|
Adénocarcinome in situ
|
|
|
Adénocarcinome in situ, non mucineux
|
8250/2 |
|
Adénocarcinome in situ, mucineux
|
8253/2 |
| Adénocarcinomes | |
|
Adénocarcinome mini-invasif
|
|
|
Adénocarcinome mini-invasif, non mucineux
|
8256/3 |
|
Adénocarcinome mini-invasif, mucineux
|
8257/3 |
|
Adénocarcinome non mucineux invasif
|
|
|
Adénocarcinome lépidique
|
8250/3 |
|
Adénocarcinome acineux
|
8551/3 |
|
Adénocarcinome papillaire
|
8260/3 |
|
Adénocarcinome micropapillaire
|
8265/3 |
|
Adénocarcinome solide
|
8230/3 |
|
Adénocarcinome mucineux invasif
|
8253/3 |
|
Adénocarcinome mucineux et non mucineux invasif mixte
|
8254/3 |
| Adénocarcinome colloïde | 8480/3 |
| Adénocarcinome fœtal | 8333/3 |
| Adénocarcinome, type entérique | 8144/3 |
| Adénocarcinome, SAI | 8140/3 |
| Lésions précurseurs squameuses | |
| Carcinome épidermoïde in situ | 8070/2 |
| Dysplasie squameuse légère | 8077/0 |
| Dysplasie squameuse modérée | 8077/2 |
| Dysplasie épidermoïde sévère | 8077/2 |
| Carcinomes épidermoïdes | |
| Carcinomes épidermoïdes, SAI | 8070/3 |
|
Carcinome épidermoïde, kératinisant
|
8071/3 |
|
Carcinome épidermoïde, non kératinisant
|
8072/3 |
|
Carcinome épidermoïde basaloïde
|
8083/3 |
| Carcinome lymphoépithélial | 8082/3 |
| Carcinomes à grandes cellules | |
| Carcinomes à grandes cellules | 8012/3 |
| Carcinomes adénosquameux | |
|
Carcinomes adénosquameux
|
8560/3 |
| Carcinomes sarcomatoïdes | |
|
Carcinome pléomorphe
|
8022/3 |
|
Carcinome à cellules géantes
|
8031/3 |
|
Carcinome à cellules fusiformes
|
8032/3 |
| Blastome pulmonaire | 8972/3 |
| Carcinosarcome | 8980/3 |
| Autres tumeurs épithéliales | |
| Carcinome NUT | 8023/3 |
| Tumeur indifférenciée déficiente en SMARCA4 thoracique | 8044/3 |
| Tumeurs de type glande salivaire | |
| Adénome pléomorphe | 8940/0 |
| Carcinome adénoïde kystique | 8200/3 |
| Carcinome épithélial-myoépithélial | 8562/3 |
| Carcinome muco-épidermoïde | 8430/3 |
| Carcinome à cellules claires hyalinisant | 8310/3 |
| Myoépithéliome | 8982/0 |
| Carcinome myoépithélial | 8982/3 |
| TUMEURS NEUROENDOCRINES PULMONAIRES | |
| Lésion précurseur | |
| Hyperplasie diffuse idiopathique des cellules neuroendocrines | 8040/0 |
| Tumeurs neuroendocrines | |
| Tumeur carcinoïde, SAI/tumeur neuroendocrine, SAI | 8240/3 |
|
Tumeur carcinoïde/neuroendocrine typique, grade 1
|
8240/3 |
|
Tumeur atypique carcinoïde/neuroendocrine, grade 2
|
8249/3 |
| Carcinomes neuroendocriniens | |
| Carcinome à petites cellules | 8041/3 |
|
Carcinome combiné à petites cellules
|
8045/3 |
| Carcinome neuroendocrinien à grandes cellules | 8013/3 |
|
Carcinome neuroendocrinien à grandes cellules combiné
|
8013/3 |
| TUMEURS DES TISSUS ECTOPIQUES | |
| Mélanome | 8720/3 |
| Méningiome | 9530/0 |
| TUMEURS MESENCHYMATEUSES SPECIFIQUES DU POUMON | |
| Hamartome pulmonaire | 8992/0 |
| Chondrome | 9220/0 |
| Lymphangiomatose diffuse | 9170/3 |
| Blastome pleuropulmonaire | 8973/3 |
| Sarcome intimal | 9137/3 |
| Tumeur myofibroblastique péribronchique congénitale | 8827/1 |
| Sarcome myxoïde pulmonaire avec fusion EWSR1-CREB1 | 8842/3 |
| PECome | |
| Lymphangioléiomyomatose | 9174/3 |
| PECome bénin | 8714/0 |
| PECome malin | 8714/3 |
| TUMEURS HEMATOLYMPHOÏDES | |
| Lymphome du MALT | 9699/3 |
| Lymphome diffus à grandes cellules B, SAI | 9680/3 |
| Granulomatose lymphomatoïde, SAI | 9766/1 |
|
Granulomatose lymphomatoïde, grade 1
|
9766/1 |
|
Granulomatose lymphomatoïde, grade 2
|
9766/1 |
|
Granulomatose lymphomatoïde, grade 3
|
9766/3 |
| Lymphome intravasculaire à grandes cellules B | 9712/3 |
| Histiocytose à cellules de Langerhans | 9751/1 |
| Maladie d'Erdheim-Chester | 9749/3 |
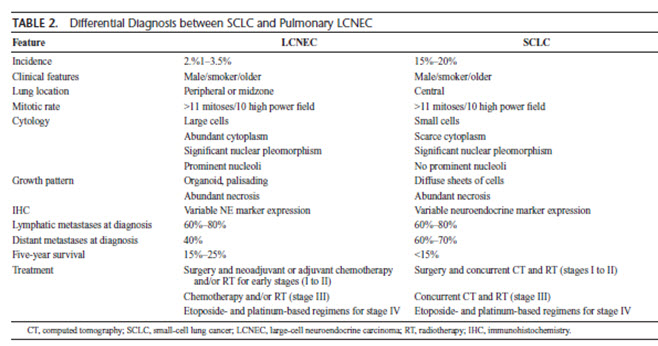
- Cette référence ne traite que des carcinomes neuroendocrines à grandes cellules.
- Sous-estimation de l'incidence du fait des difficultés diagnostiques mais ce sont des tumeurs rares (séries chirurgicales avec incidence de 2,1 % à 3,5 %).
- Tumeurs plus fréquentes chez les hommes et les gros fumeurs.
- Âge médian : 65 ans.
- Profil agressif : les courbes de survie pour chaque stade, sont superposables à celles du carcinome bronchique à petites cellules (Iyoda, 2006).
- Patients peu symptomatiques mais certains signes peuvent se retrouver :
- toux
- hémoptysies
- pneumonie
- découverte d'un nodule pulmonaire
- douleur thoracique
- dyspnée
- sueurs nocturnes
- syndrome carcinoïde
- ou un syndrome paranéoplasique.
- Profil similaire à celui du carcinome bronchique à petites cellules :
- atteinte ganglionnaire dans 60 à 80 % des cas
- atteinte métastatique dans 40 % des cas.
- Aucune spécificité radiologique.
- Bilan diagnostique identique à celui des tumeurs broncho-pulmonaires.
- Le staging doit suivre la dernière classification TNM (8ème édition).
- Un TEP-TDM au 18F-FDG et/ou un octréoscan est recommandé pour les stades chirurgicaux.
- Il n’y a aucun intérêt à demander des marqueurs tumoraux.
| TX | Tumeur primaire non connue ou tumeur prouvée par la présence de cellules malignes dans les sécrétions broncho-pulmonaires mais non visible aux examens radiologiques et endoscopiques |
| T0 | Absence de tumeur identifiable |
| Tis | Carcinome in situ |
| T1 | Tumeur ≤ 3 cm dans sa plus grande dimension, entourée par du poumon ou de la plèvre viscérale, sans évidence bronchoscopique d'invasion de la bronche souche |
| T1a(mi) | Adénocarcinome minimalement invasif |
| T1a | Tumeur ≤ 1 cm |
| T1b | Tumeur >1 cm et ≤ 2 cm |
| T1c | Tumeur >2 cm et ≤ 3 cm |
| T2 | Tumeur >3 cm et ≤ 5 cm dans sa plus grande dimension et présentant une des caractéristiques suivantes : - envahissement d'une bronche souche quelle que soit sa distance par rapport à la carène mais sans envahissement de la carène - envahissement de la plèvre viscérale - présence d'une atélectasie ou d'une pneumopathie obstructive s'étendant à la région hilaire ((sub)lobaire ou pulmonaire) |
| T2a | Tumeur >3 cm et ≤ 4 cm dans sa plus grande dimension |
| T2b | Tumeur >4 cm et ≤ 5 cm dans sa plus grande dimension |
| T3 | Tumeur >5 cm et ≤ 7 cm ou associée à un(des) nodule(s) tumoral(aux) distinct(s) et dans le même lobe, ou ayant au moins un des caractères invasifs suivants : - atteinte de la paroi thoracique (y compris tumeur de Pancoast) - atteinte du nerf phrénique - atteinte de la plèvre pariétale ou du péricarde |
| T4 | Tumeur >7 cm ou associée à un(des) nodule(s) pulmonaire(s) distinct(s) comportant un envahissement quelconque parmi les structures suivantes : médiastin, cœur, gros vaisseaux, trachée, diaphragme, nerf récurrent, œsophage, corps vertébraux, carène, nodules tumoraux séparés dans deux lobes différents du même poumon. |
| Nx | Envahissement locorégional inconnu |
| N0 | Absence de métastase dans les ganglions lymphatiques régionaux |
| N1 | Métastases ganglionnaires péribronchiques homolatérales et/ou hilaires homolatérales incluant une extension directe |
| N2 | Métastases dans les ganglions médiastinaux homolatéraux ou dans les ganglions sous-carénaires |
| N3 | Métastases ganglionnaires médiastinales controlatérales ou hilaires controlatérales ou scalènes, sus-claviculaires homo- ou controlatérales |
| Mx | La présence de métastase(s) à distance ne peut être évaluée |
| M0 | Absence de métastase à distance |
| M1 | Présence de métastase(s) à distance : |
| M1a | Nodules tumoraux séparés dans un lobe controlatéral ou nodules pleuraux ou pleurésie maligne ou péricardite maligne |
| M1b | 1 seule métastase dans un seul site métastatique |
| M1c | Plusieurs métastases dans un seul site ou plusieurs sites atteints |
| STADES | N0 | N1 | N2 | N3 | M1a-b Tout N |
M1c Tout N |
| T1a | IA-1 | IIB | IIIA | IIIB | IV-A | IV-B |
| T1b | IA-2 | IIB | IIIA | IIIB | IV-A | IV-B |
| T1c | IA-3 | IIB | IIIA | IIIB | IV-A | IV-B |
| T2a | IB | IIB | IIIA | IIIB | IV-A | IV-B |
| T2b | IIA | IIB | IIIA | IIIB | IV-A | IV-B |
| T3 | IIB | IIIA | IIIB | IIIC | IV-A | IV-B |
| T4 | IIIA | IIIA | IIIB | IIIC | IV-A | IV-B |
- La nouvelle classification OMS de 2021 est à utiliser. Le carcinome neuroendocrine à grandes cellules, une variante des carcinomes à grandes cellules dans la classification OMS 2004, est regroupé dans les carcinomes neuroendocrines de haut grade (Travis, 2015).
- Les carcinomes neuroendocrines à grandes cellules présentent :
- une architecture neuroendocrine organoïde insulaire, trabéculaire, palissadique ou en rosette
- une nécrose importante
- des cellules tumorales de grande taille à noyau nucléolé et à cytoplasme éosinophile
- un index mitotique élevé : ≥ 11 mitoses / 2mm²
- des formes composites possibles avec les carcinomes épidermoïdes, les adénocarcinomes et les carcinomes à petites cellules.
- Il existe des difficultés diagnostiques entre carcinome neuroendocrine à grandes cellules, carcinome bronchique non à petites cellules peu différencié, carcinome à petites cellules et carcinoïde atypique : des prélèvements biopsiques de qualité sont nécessaires. Une relecture de lame fait changer le diagnostic en cancer à petites cellules ou en non à petites cellules avec une composante neuroendocrine dans plus de 30 % des cas (Derks, 2018) : le but est de guider le traitement en 2ème et 3ème ligne. Une relecture de lame par le réseau TENPath de façon précoce est recommandée.
- En cas d'aspect morphologique évocateur, étude IHC obligatoire : chromogranine A, synaptophysine, ISNM1 (marqueur émergent) et CD56 (moins spécifique)
- Le diagnostic d'un carcinome neuroendocrine à grandes cellules repose à la fois sur :
- un aspect morphologique de carcinome neuroendocrine et
- la positivité d'au moins 1 marqueur neuroendocrine spécifique.
En cas d'un seul marqueur exprimé, ce marqueur doit montrer une positivité diffuse.
- Les carcinomes neuroendocrines à grandes cellules expriment au moins un marqueur neuroendocrine, inconstamment TTF1 (50 %) et n'expriment pas P40, ni Napsin A. Environ 50 % perdent Rb.
- La détermination du Ki67 est utile pour aider à déterminer l’agressivité d’une tumeur (Travis, 2010 ; Iyoda, 2004) et il est recommandé de réaliser cette immunohistochimie pour différencier le groupe des tumeurs de « haut grade » (cancer bronchique à petites cellules et carcinome neuroendocrine à grandes celulles) des tumeurs de « bas grade » (tumeurs carcinoïdes) (Fabbri, 2017).
- Les réarrangements ALK, ROS1 ou RET sont rares (Karlsson, 2015 ; Makino, 2016 ; Matsumura, 2015).
- PD-L1 s'exprime sur les tumeurs de « haut grade » avec une positivité observée surtout sur les cellules immunitaires plutôt que sur les cellules tumorales (Tsuruoka, 2017 ; Inamura, 2017).
- Le profil génomique des tumeurs neuroendocrines et leurs anomalies commencent à être analysés (Miyoshi, 2017 ; Lou, 2017).
- La biologie moléculaire peut permettre de définir des sous-groupes orientant vers un profil adénocarcinome-like (KRAS-STK11) ou CPC-like (co-inactivation de Rb et p53) (George, 2018 ; Rekhtman, 2016 ; Lazaro, 2018). Ces profils pourraient être prédictifs de réponse aux différents types de chimiothérapie motivant la réalisation précoce de ces marqueurs dès le diagnostic (Derks, 2018).
- Moins de 1 % des cancers broncho-pulmonaires neuroendocrines expriment une mutation de l'EGFR (Makino, 2016) mais les mutations de KRAS sont plus fréquentes (Rekhtman, 2016).
- Différences pour le diagnostic anatomo-pathologique entre les CBNPC et les carcinomes neuroendocrines à grandes cellules (Fasano, 2015) : Cf. Annexe 7.1 .
Stade IA
Chirurgie
Stades
IB et II
IB et II
Chirurgie
Stade IIIA
Stade IV
Radiochimiothérapie
Chimiothérapie *
Chimiothérapie *
Chirurgie
Chimiothérapie
adjuvante *
Chimiothérapie *
Chirurgie possible ?
Carcinome
neuroendocrine
à grandes cellules
Stade IIIB
et IIIC
Radiothérapie **
thoracique ≥ 60 Gy
concomittante
thoracique ≥ 60 Gy
concomittante
ou séquentielle
Diagnostic histologique
confirmé
Recherche systématique de RB1, ALK
Recherche systématique de RB1, ALK
et p53 en immunohistochimie
* Chimiothérapie :
- Si activité RB1 conservée et/ou KRAS et/ou STK11 muté :
sels de platine + taxane ou gemcitabine - Si non ou en option : sels de platine + étoposide
** Radiothérapie : à discuter en fonction du sous-type
- C'est le traitement de référence pour les stades résécables.
- La chirurgie des N2 est réservée à des cas particuliers : à discuter en RCP.
- Comme pour les autres types histologiques de CBNPC, les stades I à II doivent être opérés en fonction de l’évaluation clinique et fonctionnelle préopératoire ainsi qu’en fonction de l’étendue prévisible de l’éxérèse broncho-pulmonaire (Mazières, 2002 ; Iyoda, 2006 ; Kenmotsu, 2014).
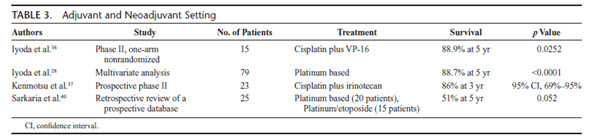
Cf. Annexes : traitements adjuvants et néoadjuvants (Fasano, 2015). - Les indications de chimiothérapie adjuvante sont les mêmes que pour les autres cancers broncho-pulmonaires réséqués.
- Si l’indication d’une chimiothérapie péri-opératoire est retenue, le doublet recommandé est une association de sels de platine et d’étoposide (Rossi, 2005 ; Iyoda, 2006 : Sun, 2012 ; Iyoda, 2014).
- 4 cycles sont recommandés en adjuvant.
- L’irradiation prophylactique cérébrale n’est pas recommandée contrairement au carcinome bronchique à petites cellules.
- La radiothérapie postopératoire ne peut être recommandée (essai clinique LUNG ART négatif (Le Pechoux, 2020)). Cependant, pour les tumeurs avec un profil carcinomes petites cellules-like, la radiothérapie est à discuter en RCP.
- Les stades IIIA et IIIB, non résécables, (Cf. Classification) seront traités par une association chimiothérapie (sels de platine/étoposide) et radiothérapie concomitante ou séquentielle d’au moins 66 Gy en fonction de la masse tumorale et de l’état clinique du patient.
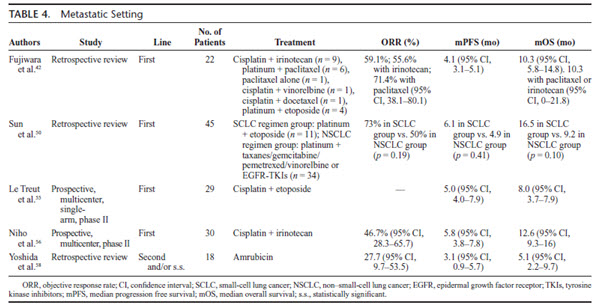
- 1ère ligne :
- plusieurs études ont évalué différentes associations de traitements (Rossi, 2005 ; Fujiwara, 2007 ; Sun, 2012)
- l’utilisation d’une chimiothérapie de type « petites cellules » (sels de platine/étoposide) est recommandée en 1ère ligne (Cf. Chimiothérapie des CBPC)
- options :
- chimiothérapie de type adénocarcinome à proposer dans certains profils de type adenocarcinoma-like (Derks 2018).
- chimiothérapie de type CBNPC (platine+taxane ou gemcitabine) en cas de conservation d’activité du gène RB1 dans la tumeur.
- 2ème ligne et ultérieures : pas de traitement validé : à discuter en RCP (CBPC ou CBNPC ou immunothérapie).
- MET
- Agents anti-angiogéniques
- TKI (EGFR) si composante adénocarcinome.
- Pour les stades I, II, IIIA (Cf. Classification) résécables :
- TEP-TDM au 18F-FDG nécessaire pour le staging exact
- une résection chirurgicale doit être proposée dans les stades I et II
- la chimiothérapie adjuvante doit être proposée pour les stades IB, II et III : 4 cycles de sels de platine/étoposide, si l’état du patient le permet
- pour les pN2, la radiothérapie postopératoire ne peut être conseillée (essai LUNG ART négatif).
- Les stades N2 « cliniques » doivent être prouvés (preuve histologique) et l’intérêt d’une résection chirurgicale doit être discuté en RCP.
- Les stades IIIA et IIIB, non résécables, (Cf. Classification) seront traités par une association chimiothérapie (sels de platine/étoposide) et radiothérapie concomitante ou séquentielle d’au moins 60 Gy en fonction de la masse tumorale et de l’état clinique du patient.
- Stades IV :
- une chimiothérapie par sels de platine et étoposide est proposée en 1ère ligne
- en option, une chimiothérapie de type adénocarcinome peut être proposée dans certains profils de type adenocarcinoma-like
- l’indication de chimiothérapie de 2ème ligne doit être discutée au cas par cas en RCP
- l’inclusion dans les essais thérapeutique doit être privilégiée.
Mises à jour via le site HECTOR (Hébergement des essais cliniques et thérapeutiques en oncologie régional) :

- Derks JL, Lebaly N, Thunnissen E, et al.
Molecular Subtypes of Pulmonary Large-cell Neuroendocrine Carcinoma Predict Chemotherapy Treatment Outcome.
Clin Cancer Res. 2018 ; 24(1) : 33-42.
- Fabbri A, Cossa M, Sonzogni A, et al.
Ki-67 labeling index of neuroendocrine tumors of the lung has a high level of correspondence between biopsy samples and surgical specimens when strict counting guidelines are applied.
Virchows Arch. 2017 ; 470(2) : 153‑164.
- Fasano M, Della Corte CM, Papaccio F, et al.
Pulmonary Large-Cell Neuroendocrine Carcinoma : From Epidemiology to Therapy.
J Thorac Oncol. 2015 ; 10(8) : 1133-1141.
- Fournel L, Falcoz PE, Alifano M, et al.
Surgical management of pulmonary large cell neuroendocrine carcinomas: a 10-year experience.
Eur J Cardiothorac Surg. 2013 ; 43(1) : 111-114
- Fujiwara Y, Sekine I, Tsuta K, et al.
Effect of platinum combined with irinotecan or paclitaxel against large cell neuroendocrine carcinoma of the lung.
Jpn J Clin Oncol. 2007 ; 37(7) : 482-486.
- Goldstraw P, Chansky K, Crowley J, et al.
The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer.
J Thorac Oncol. 2016 ; 11(1) : 39-51
- George J, Walter V, Peifer M, Alexandrov LB, Seidel D, Leenders F, et al.
Integrative genomic profiling of large-cell neuroendocrine carcinomas reveals distinct subtypes of high-grade neuroendocrine lung tumors.
Nat Commun. 2018;9(1):1048.
- Grand B, Cazes A, Mordant P, et al.
High grade neuroendocrine lung tumors : pathological characteristics, surgical management and prognostic implications.
Lung Cancer. 2013 ; 81(3) : 404-409.
- Harada T, Oizumi S, Ito K, et al.
A phase II study of amrubicin as a third-line or fourth-line chemotherapy for patients with non-small cell lung cancer : Hokkaido Lung Cancer Clinical Study Group Trial (HOT) 0901.
Oncologist. 2013 ; 18(4) : 439-445.
- Inamura K, Yokouchi Y, Kobayashi M, et al.
Relationship of tumor PD-L1 (CD274) expression with lower mortality in lung high-grade neuroendocrine tumor.
Cancer Med. 2017 ; 6(10) : 2347‑2356
- Iyoda, A, Hiroshima K, Moriya Y, et al.
Prospective study of adjuvant chemotherapy for pulmonary large cell neuroendocrine carcinoma.
Ann Thorac Surg, 2006 ; 82(5) : 1802-1807.
- Iyoda A, Hiroshima K, Moriya Y, et al.
Pulmonary large cell neuroendocrine carcinoma demonstrates high proliferative activity.
Ann Thorac Surg. 2004 ; 77(6) : 1891‑1895.
- Iyoda A, Makino T, Koezuka S, et al.
Treatment options for patients with large cell neuroendocrine carcinoma of the lung.
Gen Thorac Cardiovasc Surg. 2014 ; 62(6) : 351‑356.
- Karlsson A, Brunnström H, Lindquist KE, et al.
Mutational and gene fusion analyses of primary large cell and large cell neuroendocrine lung cancer.
Oncotarget. 2015 ; 6(26) : 22028‑22037.
- Kenmotsu H, Niho S, Ito T, et al.
A pilot study of adjuvant chemotherapy with irinotecan and cisplatin for completely resected high-grade pulmonary neuroendocrine carcinoma (large cell neuroendocrine carcinoma and small cell lung cancer).
Lung Cancer. 2014 ; 84(3) : 254-258
-
Lázaro S, Pérez-Crespo M, Lorz C, et al.Differential development of large-cell neuroendocrine or small-cell lung carcinoma upon inactivation of 4 tumor suppressor genes.
- Le Pechoux C
Abstract LBA3_PR ‘An international randomized trial, comparing post-operative conformal radiotherapy (PORT) to no PORT, in patients with completely resected non-small cell lung cancer (NSCLC) and mediastinal N2 involvement. Primary end-point analysis of Lung ART (IFCT-0503, UK NCRI, SAKK) NCT00410683.
Ann Oncol. 2020; 31 :4.
- Lou G, Yu X, Song Z.
Molecular Profiling and Survival of Completely Resected Primary Pulmonary Neuroendocrine Carcinoma.
Clin Lung Cancer. 2017 ; 18 (3) : e197‑201.
- Makino T, Mikami T, Hata Y, et al.
Comprehensive Biomarkers for Personalized Treatment in Pulmonary Large Cell Neuroendocrine Carcinoma: A Comparative Analysis With Adenocarcinoma.
Ann Thorac Surg. 2016 ; 102(5) : 1694‑1701.
- Matsumura Y, Umemura S, Ishii G, et al.
Expression profiling of receptor tyrosine kinases in high-grade neuroendocrine carcinoma of the lung : a comparative analysis with adenocarcinoma and squamous cell carcinoma.
J Cancer Res Clin Oncol. 2015 ; 141(12) : 2159‑2170.
- Mazières J, Daste G, Molinier L, et al.
Large cell neuroendocrine carcinoma of the lung : pathological study and clinical outcome of 18 resected cases.
Lung Cancer, 2002. 37(3) : 287-292.
- Miyoshi T, Umemura S, Matsumura Y, et al.
Genomic Profiling of Large-Cell Neuroendocrine Carcinoma of the Lung.
Clin Cancer Res. 2017 ; 23(3) : 757‑765.
- Nicholson AG, Tsao MS, Beasley MB, et al.
The 2021 WHO Classification of Lung Tumors : Impact of Advances Since 2015.
- Niho S, Kenmotsu H, Sekine I, et al.
Combination chemotherapy with irinotecan and cisplatin for large-cell neuroendocrine carcinoma of the lung : a multicenter phase II study.
J Thorac Oncol. 2013 ; 8(7) : 980-984.
- Rami-Porta R, Bolejack V, Crowley J, et al.
The IASLC Lung Cancer Staging Project : Proposals for the Revisions of the T Descriptors in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer.
J Thorac Oncol. 2015 ; 10(7) : 990-1003
- Rekhtman N, Pietanza MC, Hellmann MD et al.
Next-Generation Sequencing of Pulmonary Large Cell Neuroendocrine Carcinoma Reveals Small Cell Carcinoma-like and Non-Small Cell Carcinoma-like Subsets.
Clin Cancer Res. 2016 ; 22(14) : 3618‑3629
- Rossi G, Cavazza A, Marchioni A, et al.
Role of chemotherapy and the receptor tyrosine kinases KIT, PDGFRalpha, PDGFRbeta, and Met in large-cell neuroendocrine carcinoma of the lung.
J Clin Oncol, 2005. 23(34) : 8774-8785.
- Sun JM, Ahn MJ, Ahn JS, et al.
Chemotherapy for pulmonary large cell neuroendocrine carcinoma: similar to that for small cell lung cancer or non-small cell lung cancer?
Lung Cancer. 2012 ; 77(2) : 365-370.
- Travis WD.
Advances in neuroendocrine lung tumors.
Ann Oncol. 2010 ; 21 Suppl 7 : vii65-vii71.
- Travis WD, Brambilla E, Nicholson AG, et al.
The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification.
J Thorac Oncol. 2015 ; 10(9) : 1243-1260.
- Tsuruoka K, Horinouchi H, Goto Y, et al.
PD-L1 expression in neuroendocrine tumors of the lung.
Lung Cancer. 2017 ; 108 : 115‑120.
- Yoshida H, Sekine I, Tsuta K, et al.
Amrubicin monotherapy for patients with previously treated advanced large-cell neuroendocrine carcinoma of the lung.
Jpn J Clin Oncol. 2011 ; 41(7) : 897-901.