Collaborateurs
Coordonnateurs interrégionaux
JEUDY Géraldine
CHU de Dijon (21)
Rédacteurs
AUBIN François
CHU de Besançon (25)
BRUNAUD Claire
Institut de Cancérologie de Lorraine (ICL) (54)
BUHLER Julie
Institut de Cancérologie de Lorraine (ICL) (54)
CARLIER Claire
Institut Jean Godinot - CHU de Reims (51)
COURTOIS Laurent
CHU de Besançon (25)
DE BILLY Marjolaine
CHU de Besançon (25)
GRANGE Florent
CHU de Reims (51)
HEJL Lorraine
Institut de Cancérologie de Lorraine (ICL) (54)
HERVIEU Alice
Centre Georges-François Leclerc (CGFL) (21)
LEUFFLEN Léa
Institut de cancérologie de Lorraine (54)
MAISONNETTE-ESCOT Yolande
CHRU de Besançon (25)
OLIVIER Pierre
CHRU de Nancy (54)
PADEANO Marie-Martine
Cabinet de gynécologie (21)
PUZENAT Eve
CHU de Besançon (25)
PY Jean-François
Institut de cancérologie de Lorraine (54)
REVEL Lucie
CHU de Besançon (25)
ROCHER François
Institut de cancérologie de Bourgogne (71)
VISSEAUX Laetitia
CHU de Reims (51)
Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels des Dispositifs Spécifiques Régionaux du Cancer de Bourgogne-Franche-Comté (ONCOBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 13 février 2024.
Cette référence est basée sur des avis d'experts (niveaux de preuve faibles) en raison de la rareté de ces pathologies.
- Tumeurs rares de pronostic plus péjoratif que les mélanomes cutanés en raison :
- du retard fréquent de diagnostic
- de la richesse du réseau lymphatique pelvien.
- Une attitude de recours intégrant les compétences d’organe à celles d’une réunion de concertation pluridisciplinaire des tumeurs cutanées est conseillée compte tenu :
- des particularités anatomiques
- de l’agressivité de ces atteintes muqueuses
- de l’absence de traitement standardisé.
- Second cancer de la vulve après le carcinome épidermoïde.
- 3 à 7 % des mélanomes de la femme sont localisés à la vulve.
- Mauvais pronostic : survie à 5 ans variant entre 10 et 63 % (moyenne 36 %) plus faible que le mélanome cutané (entre 72 et 81 %) et le carcinome épidermoïde vulvaire (72 %).
- Âge moyen au diagnostic 61,6 ans.
- Localisations : clitoris, grandes lèvres suivi des petites lèvres et zone péri-urétrale.
- Origine caucasienne majoritaire.
- Symptômes les plus fréquents : prurit, nodule, saignement.
(Gadducci, 2019 ; Vaysse, 2013 ; Mihajlovic, 2012)
- Moins de 4 % des cancers du vagin.
- Moins de 1 % des mélanomes sont localisés au vagin.
- Localisation : tiers distal du vagin (58 %), paroi antérieure (45 %).
- Âge au diagnostic : 60-70 ans.
- Survie à 5 ans : 5 à 25 %.
- Symptômes les plus fréquents : saignement, masse pelvienne.
(Tan, 2019)
- Examen gynécologique complet avec schéma de la lésion en particulier pour la vulve.
- Examen cutané muqueux et ganglionnaire à la recherche d’autres localisations de mélanome.
- Exerèse complète de la lésion sans marge si le geste n'est pas délabrant ; à défaut biopsie pour la zone la plus pigmentée ou la plus infiltrée ou la plus épaisse pour l'obtention d'un diagnostic fiable.
(Si possible, référer la patiente pour examen en microscopie confocale de la lésion pour biopsies des zones les plus suspectes). - Une discussion en RCP évaluant les bénéfices et les risques est indispensable avant toute décision de chirurgie potentiellement mutilante.
- Mélanomes in situ
- Pas de bilan d'extension.
- Mélanomes vulvaires (indice de Breslow ≤ 1 mm, non ulcérés)
- Echographie ganglionnaire inguinale bilatérale.
- Mélanomes vulvaires (indice de Breslow >1 mm ou ≤ 1 mm et ulcérés) et mélanomes du vagin.
- Echographie des aires ganglionnaires inguinales bilatérales.
- TDM cérébral et thoraco-abdomino-pelvienne.
- IRM lombo-pelvienne à discuter
- PET-Scan à discuter au cas par cas.
- Ne pas appliquer la classification TNM FIGO
- Le pronostic des mélanomes dépend :
- de l’épaisseur de la tumeur selon l’indice de Breslow ++
- de l’ulcération
- et du statut ganglionnaire.
- On utilisera la classification AJCC 8ème édition (2018) des mélanomes cutanés (Gershenwald, 2017) en prenant en compte :
- l'indice de Breslow
- l'ulcération tumorale
- l'atteinte ganglionnaire régionale ou métastatique en transit/satellite
- l'atteinte secondaire cutanée/ganglionnaire à distance
- le taux de LDH
- l'atteinte métastatique au niveau pulmonaire, du système nerveux central ou d'autres sites.
| Catégorie T | Epaisseur | Ulcération |
| T1 | ≤ 1,0 mm | |
| T1a | <0,8 mm | Sans ulcération |
| T1b | <0,8 mm | Avec ulcération |
| 0,8 - 1 mm | Avec ou sans ulcération | |
| T2 | >1,0 - 2,0 mm | |
| T2a | >1,0 - 2,0 mm | Sans ulcération |
| T2b | >1,0 - 2,0 mm | Avec ulcération |
| T3 | >2,0 - 4,0 mm | |
| T3a | >2,0 - 4,0 mm | Sans ulcération |
| T3b | >2,0 - 4,0 mm | Avec ulcération |
| T4 | >4,0 mm | |
| T4a | >4,0 mm | Sans ulcération |
| T4b | >4,0 mm | Avec ulcération |
| Catégorie N | Nombre de ganglions régionaux atteints | Présence de métastases en transit, satellites ou microsatellites |
| N1 | 1 ganglion atteint ou présence de métastases en transit, satellites ou microsatellites | |
| N1a | 1 ganglion (atteinte occulte (biopsie du ganglion sentinelle...)) | Non |
| N1b | 1 ganglion détecté cliniquement | Non |
| N1c | Absence d'atteinte ganglionnaire | Oui |
| N2 | 2-3 ganglions atteints ou présence de métastases en transit, satellites ou microsatellites | |
| N2a | 2-3 ganglions (atteinte occulte (biopsie du ganglion sentinelle...)) | Non |
| N2b | 2-3 ganglions ; au moins 1 détecté cliniquement | Non |
| N2c | 1 ganglion ; atteinte occulte ou détecté cliniquement | Oui |
| N3 | ≥ 4 ganglions atteints ou présence de métastases en transit, satellites ou microsatellites et ≥ 2 ganglions atteints ou présence de ganglions adhérents | |
| N3a | ≥ 4 ganglions ; atteinte occulte (atteinte occulte (biopsie du ganglion sentinelle...) | Non |
| N3b | ≥ 4 ganglions ; au moins 1 détecté cliniquement ou présence de ganglions adhérents | Non |
| N3c | ≥ 2 ganglions ; atteinte occulte ou détectée cliniquement et/ou présence de ganglions adhérents | Oui |
| Catégorie M | Site anatomique | Niveau de LDH |
| M1 | Présence de métastases à distance | |
| M1a(0) | Métastases cutanées, tissus mous (incluant musculaires) et/ou ganglions non régionaux | Normal |
| M1a(1) | Elevé | |
| M1b(0) | Métastases pulmonaires avec ou sans métastases aux sites anatomiques M1a | Normal |
| M1b(1) | Elevé | |
| M1c(0) | Métastases viscérales (sauf du système nerveux central) avec ou sans atteinte des sites anatomiques de M1a et M1b | Normal |
| M1c(1) | Elevé | |
| M1d(0) | Métastases système nerveux central avec ou sans atteinte des sites anatomiques de M1a, M1b et M1c | Normal |
| M1d(1) | Elevé | |
Correspondance de classification AJCC :
| Stades | pT | N | M |
| Stade 0 | pTis | N0 | M0 |
| Stade I | pT1 | N0 | M0 |
| Stade IA | pT1a | N0 | M0 |
| pT1b | N0 | M0 | |
| Stade IB | pT2a | N0 | M0 |
| Stade IIA | pT2b | N0 | M0 |
| pT3a | N0 | M0 | |
| Stade IIB | pT3b | N0 | M0 |
| pT4a | N0 | M0 | |
| Stade IIC | pT4b | N0 | M0 |
| Stade III | Tout pT | N0 | M0 |
| Stade IIIA | pT1a | N1, N2, N3 | M0 |
| Stade IIIB | pT1a, T1b, T2a | N1a, N2a | M0 |
| pT2b-T3a | N1, N2a, N2b | M0 | |
| Stade IIIC | pT1a, T1b, T2a, T2b, T3a | N2c, N3 | M0 |
| pT3b, T4a | N1, N2, N3 | M0 | |
| pT4b | N1, N2 | ||
| Stade IIID | pT4b | N3 | M0 |
| Stade IV | Tout pT | Tout N | M1 |
- En cas de métastases, la recherche de variants pathogènes BRAF, c-KIT et NRAS est indispensable et urgente.
- En l'absence de métastase, cette recherche de mutation est à demander en cas de mélanome à risque métastatique.
- L'analyse d'exomes par séquençage à haut débit est à discuter en cas d'impasse thérapeutique.
- En l’absence de traitement standardisé, le dossier devra être présenté à la fois en RCP de gynécologie et d’onco-dermatologie en décrivant :
- la taille du mélanome (en particulier pour les mélanomes du vagin)
- sa localisation avec schéma (Cf. ci-dessous) et photographies
- le statut ganglionnaire clinique
- le compte-rendu détaillé de l’analyse histologique :
- type histologique
- épaisseur tumorale ou indice de Breslow
- présence ou non d'une ulcération
- existence ou non de signe de régression
- index mitotique
- marge macroscopique de résection
- le résultat de l’exploration ganglionnaire et du bilan d'extension
- la preuve d'absence d'autres localisations du mélanome
- le statut oncogériatrique (score G8) de la patiente
- le résultat du génotypage BRAF, NRAS, c-KIT s'ils ont été réalisés.
- Un schéma de la lésion et des aires ganglionnaires doit être réalisé.
Vous pouvez télécharger ce schéma à un plus grand format en PDF.
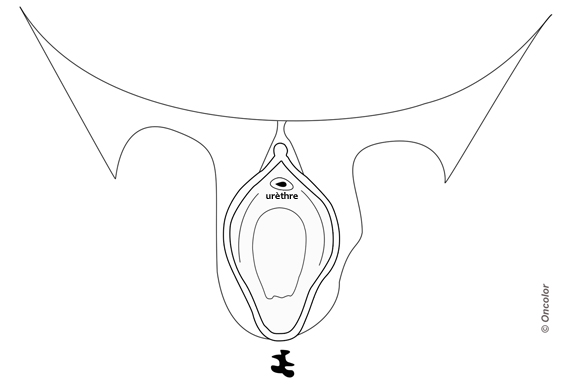
- Il est nécessaire de s’assurer de la négativité du bilan d’extension avant d’envisager une chirurgie qui sera parfois mutilante. En cas de doute sur une éventuelle localisation secondaire, compléter le bilan paraclinique (TEP scanner par exemple) ou reprogrammer un bilan d'extension afin de juger de l'éventuelle évolutivité de lésions douteuses.
- Exérèse locale large à privilégier par rapport à une vulvectomie radicale (pas de différence de survie) (Piura, 2008 ; Sinasac, 2019).
- Marges latérales : pas de différence en termes de survie si les marges latérales d’exérèse sont supérieures ou inférieures à 2 cm
- mélanome in situ : marges latérales macroscopiques de 0,5 cm
- indice de Breslow ≤ 1 mm : marges latérales macroscopiques de 1 cm
- indice de Breslow >1 mm : marges latérales macroscopiques de 1 à 2 cm en fonction des possibilités anatomiques
- il n'est pas utile de réaliser des marges supérieures à 2 cm.
- Marges profondes (exérèse vulvaire en pleine épaisseur) :
- entre le tissu adipeux sous-cutané et le fascia quelle que soit l’épaisseur tumorale.
(Falk Delgado, 2019 ; Guillot, 2019)
- Elle est optionnelle mais doit être encouragée si un traitement adjuvant est envisagé pour la patiente.
- Elle ne doit être envisagée que si l’épaisseur tumorale selon l’indice de Breslow est supérieure à 1 mm (ou <1 mm ulcéré) et en l’absence de ganglion suspect au bilan d’extension.
- Il est recommandé d’utiliser une méthode de détection combinée (méthode colorimétrique et méthode isotopique) ou vert d'indocyanine, par injection intradermique de part et d'autre du site tumoral, en l’absence d’antécédent allergique (Piura, 2008).
- Par analogie à la référence de prise en charge du mélanome cutané de stade III
- En cas d'atteinte ganglionnaire micrométastatique : un curage complémentaire n'est plus recommandé
- En cas de métastase ganglionnaire avec envahissement ganglionnaire macroscopique : discuter un curage inguino-crural.
- Selon la localisation anatomique et les possibilités techniques : exérèse large conservatrice avec analyse du ganglion sentinelle.
- En l'absence de possibilité d'exérèse conservatrice ou en cas de mélanome jugé "inopérable" (caractère délabrant de la chirurgie sans bénéfice sur l'absence de récidive locale/à distance) : préférer un traitement médical et/ou radiothérapie en première intention.
- En cas d'atteinte ganglionnaire micrométastatique, ne pas réaliser de curage mais proposer un traitement adjuvant en RCP d'onco-dermatologie.
- En cas d'atteinte ganglionnaire macroscopique locorégionale isolée (bilan d'extension négatif), la réalisation d'un curage ganglionnaire inguino-crural doit être considérée en RCP. Ensuite, un traitement adjuvant médical ou une radiothérapie pourra être proposé.
- Au cas par cas, un traitement néoadjuvant pourra être proposé en RCP avant le curage ganglionnaire ou en cas de tumeur primitive avancée dont l'exérèse serait trop délabrante initialement.
- Après discussion en RCP, au cas par cas, il peut être envisagé :
- une radiothérapie pelvienne et/ou curiethérapie postopératoire lors des traitements conservateurs des mélanomes du vagin
- une radiothérapie adjuvante ganglionnaire en présence de facteurs de risque de récidive importants (nombre de ganglions atteints, rupture capsulaire)
- une radiothérapie pelvienne exclusive pour les patientes non opérables ± associée à un traitement médical (immunothérapie)
- une radiothérapie palliative à visée tumorostatique/antalgique/hémostatique en cas de mélanome évolué ou métastatique.
- La décision de traitement médical relève d'une analyse en recours en RCP onco-dermatologie.
- La recherche des variants pathogènes BRAF, c-Kit, NRAS est indispensable : les variants pathogènes les plus fréquemment retrouvées pour les mélanomes de la sphère génitale concernent le gène c-Kit (15 à 35 %) et le gène NRAS (<5 %) ; les variants pathogènes du gène BRAF sont plus rares (<5 %) (Curtin, 2005 ; Hou, 2017).
- Mélanomes stades IIB et IIC : un traitement adjuvant par pembrolizumab ou nivolumab peut se discuter au cas pour cas en RCP par analogie aux recommandations des traitements mélanomes cutanés de stade IIB et IIC (AMM 2023) (Lee 2022, Kirkwood 2023)
- Mélanomes stades III opérés : en cas d'atteinte ganglionnaire réséquée, qu'elle soit micro ou macrométastatique, un traitement adjuvant peut être proposé par analogie aux mélanomes cutanés : immunothérapie ou thérapie ciblée en cas de variants pathogènes BRAF (AMM 2019) (Guillot, 2019 ; Long, 2017 ; Weber, 2017 ; Eggermont, 2018).
- Mélanomes localement avancés ou stade III inopérables ou stade IV : (D'Angelo, 2017 ; Guillot, 2018 ; Mignard, 2018 ; Moya-Plana, 2019)
- selon la disponibilité des essais thérapeutiques et le profil de la patiente : discuter de l'inclusion dans un essai thérapeutique
- l'association d'un anti-PD1 et d'un anti-CTLA4 (nivolumab et ipilimumab) sera proposée en 1ère ligne chez des patientes en bon état général et sans comorbidité lourde
- un traitement par immunothérapie anti-PD1 seul peut être proposé dans tous les cas
- un traitement par thérapie ciblée anti-BRAF + anti-MEK peut être proposé en cas de présence d'un variant pathogène activateur de BRAF
- une thérapie ciblée par inhibiteurs de c-Kit peut se discuter en RCP moléculaire en cas de variants pathogènes c-Kit (proposition hors AMM)
- la chimiothérapie cytotoxique (dacarbazine, fotémustine) garde une place modeste en situation palliative, après échec des traitements décrits ci-dessus
- un séquençage d'exomes (kit NGS) peut être proposé en situation d'impasse thérapeutique.
- Mélanome de faible épaisseur, Breslow ≤ 1 mm : surveillance clinique gynécologique, cutanée et ganglionnaire semestrielle pendant 3 ans puis annuelle à vie.
- Mélanome de plus mauvais pronostic (Breslow >1 mm, localisation ganglionnaire) :
- surveillance clinique gynécologique, cutanée et ganglionnaire trimestrielle pendant 3 à 5 ans puis annuelle à vie
- échographie des aires ganglionnaires, optionnelle tous les 3 à 6 mois pendant 3 ans
- examens d’imagerie complémentaire (IRM pelvienne, TDM corps entier ou PET-Scan, IRM cérébrale) au cours des 3 premières années à discuter au cas par cas pour les tumeurs à haut risque évolutif.
Mises à jour via le site HECTOR (Hébergement des essais cliniques et thérapeutiques en oncologie régional) :

-
GASVERT : Fiabilité de l'utilisation du vert d'indocyanine dans l'évaluation du ganglion sentinelle en chirurgie cancérologique.
- Status : Ouvert (29-11-2017 - 29-11-2020)
- Promoteur : Institut de Cancérologie de Lorraine
- Boer FL, Ten Eikelder MLG, Kapiteijn EH, Creutzberg CL et al.
Vulvar malignant melanoma: Pathogenesis, clinical behaviour and management: Review of the literature.
Cancer Treat Rev. 2019 ;73:91-103.
- Curtin JA, Fridlyand J, Kageshita T, Patel HN et al.
Distinct sets of genetic alterations in melanoma.
N Engl J Med. 2005;353:2135-47.
- D'Angelo SP, Larkin J, Sosman JA, Lebbé C et al.
Efficacy and Safety of Nivolumab Alone or in Combination With Ipilimumab in Patients With Mucosal Melanoma: A Pooled Analysis.
J Clin Oncol. 2017 ;35:226-235.
- Eggermont AMM, Blank CU, Mandala M, Long GV et al.
Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma.
N Engl J Med. 2018 ;378:1789-1801.
- Falk Delgado A, Zommorodi S, Falk Delgado A.
Sentinel Lymph Node Biopsy and Complete Lymph Node Dissection for Melanoma.
Curr Oncol Rep. 2019 ;21:54
- Gadducci A, Carinelli S, Guerrieri ME, Aletti GD.
Melanoma of the lower genital tract: Prognostic factors and treatment modalities.
Gynecol Oncol. 2018;150:180-189.
- Gershenwald JE, Scolyer RA, Hess KR, Sondak VK et al.
Melanoma staging: Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual.
CA Cancer J Clin. 2017 ;67:472-492.
- Guillot B, Dalac S, Denis MG, Dupuy A et al.
French updated recommendations in Stage I to III melanoma treatment and management.
J Eur Acad Dermatol Venereol. 2017 ;31:594-602.
- Guillot B, Charles J, Jeudy G, Cupissol D et al.
Treatment of patients with inoperable stage III or stage IV melanoma. Société française de dermatologie
Ann Dermatol Venereol. 2018 ;145:413-422
- Guillot B, Dupuy A, Pracht M, Jeudy G et al.
New guidelines for stage III melanoma (the French Cutaneous Oncology Group)
Ann Dermatol Venereol. 2019 ;146:204-214.
- Hou JY, Baptiste C, Hombalegowda RB, Tergas AI et al.
Vulvar and vaginal melanoma: A unique subclass of mucosal melanoma based on a comprehensive molecular analysis of 51 cases compared with 2253 cases of nongynecologic melanoma.
Cancer. 2017 ;123:1333-1344.
- Kanaki T, Stang A, Gutzmer R, Zimmer L et al.
Impact of American Joint Committee on Cancer 8th edition classification on staging and survival of patients with melanoma.
Eur J Cancer. 2019;119:18-29.
- Kirkwood JM, Del Vecchio M, Weber J, Hoeller C et al.
Adjuvant nivolumab in resected stage IIB/C melanoma: primary results from the randomized, phase 3 CheckMate 76K trial
Nat Med 2023 Nov;29(11):2835-2843.
- Lee J.J, Rutkowski P, Queirolo P, Del Vecchio M., Mackiewicz J, Chiarion-Sileni V. et al.
Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial.
Lancet. 2022; 399: 1718-1729
- Long GV, Hauschild A, Santinami M, Atkinson V.
Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma.
N Engl J Med. 2017 ;377:1813-1823.
- Mignard C, Deschamps Huvier A, Gillibert A, Duval Modeste AB et al.
Efficacy of Immunotherapy in Patients with Metastatic Mucosal or Uveal Melanoma
J Oncol. 2018 ;2018:1908065.
- Moya-Plana A, Herrera Gómez RG, Rossoni C, Dercle L et al.
Evaluation of the efficacy of immunotherapy for non-resectable mucosal melanoma.
Cancer Immunol Immunother. 2019 ;68:1171-1178.
- Mihajlovic M, Vlajkovic S, Jovanovic P, Stefanovic V.
Primary mucosal melanomas: a comprehensive review.
Int J Clin Exp Pathol. 2012;5:739-53.
- Morton DL, Thompson JF, Cochran AJ, Mozzillo N et al.
Final trial report of sentinel-node biopsy versus nodal observation in melanoma.
N Engl J Med. 2014 ;370:599-609.
- Omholt K, Grafstrom E, Kanter-Lewensohn L, Hansson J et al.
KIT pathway alterations in mucosal melanomas of the vulva and other sites.
Clin Cancer Res 2011; 17:3933–3942.
- Piura B.
Management of primary melanoma of the female urogenital tract.
Lancet Oncol 2008; 9:973–981.
- Sinasac SE, Petrella TM, Rouzbahman M, Sade S et al.
Melanoma of the Vulva and Vagina: Surgical Management and Outcomes Based on a Clinicopathologic Reviewof 68 Cases.
J Obstet Gynaecol Can. 2019 ;41:762-771.
- Tan A, Bieber AK, Stein JA, Pomeranz MK
Diagnosis and management of vulvar cancer: A review.
J Am Acad Dermatol. 2019 ;81:1387-1396.
- Vaysse C, Pautier P, Filleron T, Maisongrosse V et al.
A large retrospective multicenter study of vaginal melanomas: implications for new management.
Melanoma Res. 2013;23:138-46.
- Weber J, Mandala M, Del Vecchio M, Gogas HJ et al.
Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma.
N Engl J Med. 2017 ;377:1824-1835.
- Weinberg D, Gomez-Martinez RA.
Vulvar Cancer.
Obstet Gynecol Clin North Am. 2019 ;46:125-135.


