Ce référentiel, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaboré par un groupe de travail pluridisciplinaire de professionnels des réseaux régionaux de cancérologie de Lorraine (ONCOLOR), d’Alsace (CAROL), de Bourgogne (ONCOBOURGOGNE) et de Franche-Comté (ONCOLIE), en tenant compte des recommandations nationales, et conformément aux données acquises de la science au 19 mai 2014.
- L’incidence estimée des sarcomes des tissus mous (STM) est de 6 à 8 nouveaux cas par an pour 100.000 habitants soit 3.000 à 4.000 nouveaux cas par an en France. Un STM peut se développer dans toutes les régions du corps. Les membres représentent 65 % des localisations (50 % au niveau des membres inférieurs et 15 % au niveau des membres supérieurs).
- Les sarcomes ne représentent qu’une faible partie des tumeurs des parties molles (1/200) mais la proportion malin/bénin est de 1/7 pour les tumeurs profondes de 5 cm ou plus.
- Les étapes précoces de la prise en charge des STM sont essentielles, car elles retentissent directement sur les séquelles fonctionnelles et la survie des patients. Il est donc essentiel de penser très précocement au diagnostic de STM.
- Une prise en charge multidisciplinaire est nécessaire dans tous les cas. Elle fait intervenir les radiologues, les anatomo-pathologistes, les chirurgiens, les radiothérapeutes et les oncologues médicaux.
- S’agissant de tumeurs rares, de diagnostic et de traitement potentiellement difficiles, sous l’égide de l’INCa il a été mis en place depuis 2010 sur le territoire national un réseau clinique et pathologique constitué de centres référents définis par :
- le réseau clinique NETSARC dont les centres de la région Grand Est sont :
Besançon, Dijon, Nancy, Reims, Strasbourg - le réseau pathologie RRePS (Réseau de Référence en Pathologie des Sarcomes des tissus mous et des viscères) dont les centres de la Région Grand Est sont :
Dijon, Nancy, Strasbourg - Ces réseaux sont complétés pour la pathologie osseuse du réseau RESOS.
- le réseau clinique NETSARC dont les centres de la région Grand Est sont :
|
|
- Le plan personnalisé de soins (PPS) doit être établi en RCP du centre de référence régional du réseau sarcome NETSARC :
- cette discussion ne pourra être pertinente qu’en s’appuyant sur un bilan clinique, radiologique et histologique (microbiopsie préopératoire) complet et adapté.
- le premier geste chirurgical conditionne le contrôle tumoral local.
-
L’objectif chirurgical est double :
- obtenir une exérèse monobloc R0 et éviter toute effraction tumorale
- privilégier un traitement à visée conservatrice de l’anatomie et de la fonction.
Pour atteindre ce double objectif, une prise en charge chirurgicale multidisciplinaire doit être nécessaire. Des gestes de chirurgies plastiques et/ou vasculaires voire ostéo-articulaires doivent pouvoir être réalisés. La présence dans l’équipe chirurgicale d’un chirurgien plasticien, vasculaire et orthopédique est fortement recommandée.
-
La discussion préliminaire est indispensable :
- pour évaluer le rapport bénéfice/risque (qualité de l’exérèse/séquelles fonctionnelles) de l’intervention prévue
- pour planifier en préopératoire la nécessité :
- d’une exérèse R0
- d’une chirurgie plastique reconstructrice (envahissement musculo-cutané important, sarcome en terrain irradié)
- d’une chirurgie vasculaire reconstructrice
- d’une chirurgie ostéo-articulaire
- d’un sacrifice d’un gros tronc nerveux afin d’en prévenir le patient.
-
Un traitement néo-adjuvant peut être discuté en RCP notamment :
- en cas de tumeur rapidement évolutive
- et/ou de chirurgie potentiellement mutilante (du fait du volume tumoral ou de la topographie)
- ou de tumeur dont l’exérèse risque d’être macroscopiquement incomplète (R2).
- Le choix du traitement néo-adjuvant est fonction du type histologique, du grade, de la topographie tumorale, de l’âge et des comorbidités. Selon les cas peuvent se discuter (éventuellement de façon séquentielle) :
- une radiothérapie
- une chimiothérapie systémique
- une chimiothérapie locorégionale (perfusion de membre isolé en circulation extracorporelle).
- Le traitement standard des STM localisés consiste en une exérèse chirurgicale large R0 c’est-à-dire avec une marge de tissu sain sur toute sa surface.
- L’exérèse large consiste à emporter 1 à 2 cm de tissu sain (muscle strié) et/ou une barrière anatomique (aponévrose, adventice, périoste, épinèvre).
- Il n’y a pas d’indication à un curage ganglionnaire régional de principe.
Options :
Chimiothérapie néo-adjuvante
Radiothérapie néo-adjuvante
Standard :
chirurgie large monobloc
Plan Personnalisé de Soins Initial
déterminé en RCP centre référent
NETSARC
STM non métastatique
Perfusion isolée des membres
néo-adjuvante
Plan Personnalisé de Soins post-exérèse
déterminé en RCP centre référent
NETSARC
Marges après chirurgie ?
Grade ?
Grade 1
Tumeur superficielle
<5 cm
Option :
Radiothérapie
Tumeur superficielle >5 cm
et toute tumeur profonde
Tumeur superficielle
<5 cm
Surveillance
Tumeur profonde
<5 cm
Grade 2 ou 3
Option :
Surveillance
Tumeur profonde
>5 cm
Option :
chimiothérapie
puis radiothérapie
Option :
Surveillance
Marges R0
Options :
Marges ?
Reprise chirurgical
possible ?
Grade ?
Options :
Marges R1
(D'après Enneking & al. (1983) et Campanacci)
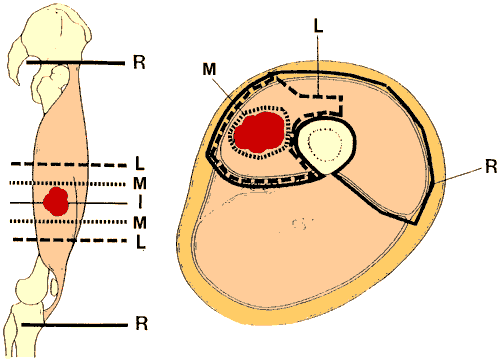
- Exérèse Intralésionnelle (I) : lésion "énucléée", "épluchée à l'intérieur de la pseudo-capsule". Un sarcome n'est jamais une tumeur réellement encapsulée.
- Exérèse Marginale (M) : lésion enlevée en bloc mais seulement recouverte de sa pseudo-capsule, sans réelle marge de tissu sain périlésionnel.
- Exérèse Large (L) : lésion enlevée en bloc et enveloppée de façon uniforme d'une couche de tissu sain (en cas de tumeur superficielle, sous-cutanée : l'exérèse comporte le fascia profond).
-
Exérèse Radicale (R) : lésion enlevée en bloc au sein de son compartiment anatomique d'origine limité par ses enveloppes naturelles (en cas de tumeur superficielle, sous-cutanée : l'exérèse emporte le fascia profond).
-
Plusieurs règles doivent être impérativement respectées :
- La voie d’abord doit emporter le trajet de biopsie et se faire dans le sens des fibres musculaires sous-jacentes (sauf au niveau des plis de flexion) : c’est-à-dire dans l’axe des membres sauf au niveau de la fesse (dans le sens des fibres du grand fessier). Elle doit également être si possible étendue à toute l’aire de décollement chirurgical. L’espace de décollement peut être marqué par des clips et l’hémostase doit être rigoureuse.
- La tumeur doit être emportée EN MONOBLOC (SANS EFFRACTION TUMORALE).
L’objectif est de ne pas voir la tumeur au cours de la dissection.
- Les drainages sont systématiquement placés dans l’axe et à proximité de la cicatrice afin de pouvoir être repris facilement en cas de récidive et de limiter les champs d’irradiation postopératoire.
- En cas d'envahissement musculo-cutané important, de sarcome en terrain irradié, il faut discuter la mise en place d’un lambeau musculo-cutané de couverture :
- il peut s’agir de lambeaux pédiculés ou de lambeaux libres
- le prélèvement du lambeau doit être effectué avec une instrumentation différente de celle de l’exérèse en séparant les champs s’il s’agit d’un lambeau libre.
- La pièce opératoire doit être adressée en anatomo-pathologie le plus rapidement possible (idéalement inférieur à 15 minutes pour permettre la congélation de fragment tissulaire pour la biologie moléculaire) :
- à l’état frais
- entière
- non ouverte
- orientée (le mieux est de faire un schéma).
- Le compte-rendu opératoire doit décrire la topographie de la tumeur, les facteurs limitants de l’exérèse (vaisseaux, nerfs, os), préciser les muscles réséqués et doit IMPÉRATIVEMENT :
- préciser si la tumeur a été vue ou non
- préciser s’il y a eu une effraction tumorale, un risque majeur de récidive locale
- informer, le cas échéant, sur la présence de résidus tumoraux laissés en place (exérèse R2). Il faut alors les repérer par la pose de clips spécifiques
- La réalisation de photographie peropératoire peut être utile.
- La voie d’abord doit emporter le trajet de biopsie et se faire dans le sens des fibres musculaires sous-jacentes (sauf au niveau des plis de flexion) : c’est-à-dire dans l’axe des membres sauf au niveau de la fesse (dans le sens des fibres du grand fessier). Elle doit également être si possible étendue à toute l’aire de décollement chirurgical. L’espace de décollement peut être marqué par des clips et l’hémostase doit être rigoureuse.
- En cas d’exérèse non R0, une réintervention doit être systématiquement discutée dans une RCP du centre de référence régional du réseau NETSARC.
- Cette discussion nécessite d’avoir :
- le compte-rendu opératoire
- le compte-rendu anatomo-pathologique
- l’imagerie préopératoire (IRM).
- Si une reprise d’exérèse est envisagée, il est préférable d’attendre la cicatrisation de l’intervention précédente pour éviter de mettre en contact l’ancien site d’exérèse et le nouveau. La cicatrice précédente et les orifices de drainage doivent être réséqués.
- En cas d’exérèse R1
- L’indication est fonction des possibilités d’obtention de marges satisfaisantes avec une morbidité acceptable et du type histologique
- L’indication est fonction des possibilités d’obtention de marges satisfaisantes avec une morbidité acceptable et du type histologique
- En cas d’exérèse R2 ou d’effraction tumorale : une réintervention doit être privilégiée.
- Une IRM postopératoire doit être réalisée pour visualiser le(s) résidu(s) tumoral(aux).
- Un traitement préopératoire (chimiothérapie, perfusion de membre isolée, radiothérapie) peut se discuter.
Métastases synchrones ?
Plan Personnalisé de Soins Initial
déterminé en RCP centre référent NETSARC
STM métastatique
Option :
Chirurgie
(si bonne réponse)
Résécabilité en totalité ?
puis
chirurgie
et/ou traitement ablatif local
Option :
si métastase pulmonaire d'emblée
chirurgie d'emblée
- Le traitement standard d’une maladie métastatique synchrone au diagnostic est une chimiothérapie.
- Dans certains cas, une exérèse chirurgicale peut néanmoins se discuter en RCP.
- En cas de métastases pulmonaires métachrones résécables en totalité, sans lésions extra-pulmonaires associées, l’exérèse chirurgicale est le standard.
- En cas de métastases extra-pulmonaires, la chimiothérapie est le standard. L’exérèse chirurgicale peut être, dans des cas bien sélectionnés, une option en cas de bonne réponse à la chimiothérapie.
- Depuis janvier 2010, sous l’égide de l’INCa, toute tumeur des tissus mous, qu’il existe ou non un doute diagnostique, doit bénéficier d’une deuxième lecture dans un centre de référence du réseau RRePS (Réseau de Référence en Pathologie des Sarcomes des tissus mous et des viscères) et être enregistrée dans la base de données nationale.
Tumeur des tissus mous
Pièce opératoire non fixée,
à adresser au pathologiste le plus rapidement possible
Fixation formolée
à visée diagnostique
- Renseignements cliniques, traitements préopératoire éventuel
- Repères topographiques chirurgicaux
(schéma, orientation pièce opératoire, barrière anatomiques des berges) - Compte-rendu opératoire
Examen anatomo-pathologique :
- descriptif macroscopique : taille tumeur (axe maximal),
situation par rapport à l'aponévrose superficielle et aux structures anatomiques présentes sur la pièce - type histologique (intérêt de l'immunohistochimie)
- grade histopronostic (FNCLCC)
- qualité des berges de l'exérèse : distance minimale par rapport aux berges et type de tissu (aponévrose, adventice, périoste, périnèvre, muscle, graisse)
- présence éventuelle d'emboles néoplasiques, atteinte des troncs nerveux, des axes vasculaires ou des structures osseuses
- en cas de traitement néo-adjuvant : évaluation de la réponse au traitement (importance de la nécrose, % de cellules tumorales viables résiduelles...
Congélation
pour biologie moléculaire
-
Plusieurs règles doivent être impérativement respectées :
- La pièce opératoire doit être adressée fraîche, orientée (schéma et repérage des zones d’intérêt par des fils), en monobloc, non ouverte, acheminée immédiatement au laboratoire à température ambiante (milieu réfrigéré si un délai existe).
- Pas d’intérêt de l’examen extemporané.
- Faire des prélèvements en congélation pour la biologie moléculaire. Ceux-ci sont à réaliser stérilement dans les plus brefs délais (idéalement dans les 15 min, 30 min maximum). Possibilité d’utiliser si besoin un milieu de conservation : RNA later. Le consentement du patient est nécessaire.
- Les informations cliniques sont nécessaires pour l’analyse des prélèvements :
- âge
- antécédents
- siège
- taille de la lésion
- aspect radiologique (idéalement bilan d’imagerie adressé aux anatomopathologistes)
- évolutivité
- compte-rendu opératoire.
- Examen macroscopique avec photographie de la pièce opératoire dès réception : utilité d’une feuille de macroscopie standardisée.
- Encrer les marges d’exérèse chirurgicale périphériques à l’aide de différentes couleurs et fixer dans un volume suffisant de formol tamponné à 4 % au moins 24 heures.
- Réaliser un prélèvement de la lésion tumorale tous les centimètres en prenant ses rapports aux autres organes et structures d’intérêt (vaisseaux, os...).
- Repérer le site des prélèvements sur un schéma ou une photo de la pièce sur tirage papier.
- Établir le type histologique selon la classification OMS de 2010 sur coupes de 4 µm en coloration standard (HES) puis en s’aidant des techniques complémentaires d’immunohistochimie.
- Utiliser un panel d’anticorps hiérarchisé pour arriver au diagnostic. Les données immunophénotypiques sont toujours à interpréter avec les données morphologiques et le contexte clinique.
- En fonction du type de sarcome et des altérations moléculaires connues, procéder à une analyse moléculaire pour confirmer le diagnostic (FISH, PCR) si elle n’a pas été faite auparavant lors de l’analyse des microbiopsies.
- Évaluer la qualité des marges d’exérèse chirurgicale pour déterminer le potentiel de récidive locale : distance minimale à indiquer en mm dans le CR anatomo-pathologique et le type de tissu correspondant (muscle, adipeux, aponévrose, périoste).
- Déterminer le grade histopronostique selon la classification de la FNCLCC.
- En cas de traitement néo-adjuvant, apprécier la réponse tumorale (% de territoires tumoraux vivaces et de nécroses, modifications morphologiques par le traitement néo-adjuvant).
- Intérêt du CR standardisé.
- La conclusion de l’examen anatomo-pathologique doit impérativement comporter :
- la taille
- le type histologique (OMS 2010)
- le grade selon la FNCLCC
- les marges d’exérèse.
- Toute indication de radiothérapie doit être discutée en RCP du centre de référence régional du réseau sarcome NETSARC.
- En cas de refus ou contre-indication chirurgicale, une radiothérapie exclusive peut-être proposée.
- Une radiothérapie postopératoire devra être systématiquement discutée en présence d’un ou de plusieurs des critères suivants :
- tumeur de grade 2 ou 3
- taille supérieure ou égale à 5 cm
- tumeur profonde
- en cas de reprise chirurgicale pour exérèse initiale non R0.
- La radiothérapie permet de diminuer significativement le risque de récidive locale mais n’a pas d’impact sur la survie globale.
- En cas d’exérèse R2, la reprise chirurgicale doit toujours être privilégiée. Si elle n’est pas possible, la radiothérapie devra être réalisée avec un boost sur le résidu tumoral.
- A l’heure actuelle, il n’y a pas d’indication de radiochimiothérapie concomitante, hors essai.
- L’absence de radiothérapie postopératoire peut se discuter dans les cas suivants :
- tumeur superficielle ou profonde réséquées largement à la chirurgie initiale (pas de reprise)
- et de grade faible (haut grade exclu)
- et de taille tumorale inférieure à 5 cm de plus grand axe.
- Idéalement, la radiothérapie doit être réalisée dans les huit semaines suivant la chirurgie.
- Toutefois, ce délai peut être reconsidéré en fonction des suites opératoires, des résultats opératoires, de la localisation tumorale. La qualité de la cicatrisation (notamment l’absence de désunion), l’absence de surinfection, de collection postopératoire sont des éléments nécessaires à la tolérance immédiate et tardive du traitement.
- Après un délai supérieur à trois mois, il sera nécessaire de discuter en réunion pluridisciplinaire la réalisation d’une nouvelle imagerie (afin d’éliminer une rechute locale précoce) mais également du maintien de l’indication de radiothérapie.
- La radiothérapie doit systématiquement être une radiothérapie conformationnelle, au besoin avec modulation d’intensité, regroupant les étapes suivantes :
- Il est nécessaire que le patient et plus particulièrement le membre traité soit immobilisé dans un système de contention personnalisé, confortable et reproductible (masque thermoformé, matelas personnalisé type blue bag, cales personnalisées...), en tenant compte de la balistique ultérieure qui devra éviter le reste du corps (par exemple penser pour un membre supérieur à écarter le bras du corps pour l’éloigner du tronc ou pour un membre inférieur à surélever la jambe controlatérale...). Il faudra également discuter de la nécessité de mettre en place un bolus à la peau.
- Avant de réaliser le scanner, il faudra impérativement matérialiser à la peau toutes les cicatrices ainsi que les orifices de drain. Le plus souvent, il n’est pas nécessaire de réaliser une injection de produit de contraste sauf en situation préopératoire.
- La définition des volumes d’irradiation dépend :
- de la description anatomique (topographie, muscles et autres structures envahies visibles sur l’imagerie préopératoire et décrites sur le compte-rendu opératoire)
- des constatations peropératoires, décrivant notamment les zones où l’exérèse a été difficile ou bien où la tumeur était visible (faisant évoquer une exérèse R1)
- des constatations anatomo-pathologiques précisant le grade et la qualité de l’exérèse.
- En situation postopératoire, il n’y a pas de volume-cible macroscopique (Gross Tumor Volume - GTV).
- Le volume-cible anatomoclinique (Clinical Target Volume - CTV) est le volume anatomique à risque d’extension microscopique de la tumeur. La définition utilisée est une définition anatomique qui correspond :
- au volume « manipulé » par le chirurgien comprenant le ou les muscles envahis, les insertions musculaires de proximité, les axes vasculo-nerveux contigus, les trajets et orifices de drains, la cicatrice.
- au volume anatomique limité par des barrières anatomiques, telles que des aponévroses ou cloisons inter-osseuses qui sont rarement infiltrées ; un groupe de muscles agonistes délimités par une aponévrose commune peut définir un compartiment ou une loge anatomique.
- les hématomes et lymphocèles doivent être inclus dans le CTV (Clinical Target Volume).
- Il existe une définition géométrique du CTV (incluant la cavité opératoire auquel on rajoute une marge de 1,5 cm latéralement et de 4-5 cm longitudinalement) qui a l’inconvénient d’irradier inutilement des volumes séparés par une barrière anatomique et de ne pas traiter des volumes plus distants et théoriquement à risque comme une extrémité ou une insertion musculaire de proximité. Cette définition géométrique du CTV peut être utilisée quand une localisation anatomique est difficile à préciser (en particulier dans les sarcomes de la paroi du tronc). Cette définition est toutefois déconseillée chaque fois que l’option anatomique de définition du CTV est possible.
- Le volume cible prévisionnel (Planning Tumor Volume - PTV) inclut le CTV avec une marge tenant compte de l’imprécision liée à l’incertitude de repositionnement. Le plus souvent, cette marge est de 1 cm.
- En situation préopératoire, le GTV (Gross Tumor Volume) correspond à la tumeur visible en IRM (T1 gado)
- Le CTV (Clinical Target Volume) comprend le GTV auquel on rajoute le volume anatomique à risque d’extension microscopique de la tumeur. Il doit inclure l’œdème péri-tumoral. Le volume anatomique est limité par des barrières anatomiques, telles que des aponévroses ou cloisons inter-osseuses qui sont rarement infiltrées ; un groupe de muscles agonistes délimités par une aponévrose commune peut définir un compartiment ou une loge anatomique.
- La définition géométrique correspond au GTV auquel on rajoute une marge de 1,5 cm latéralement et de 4-5 cm longitudinalement.
- La marge de PTV est généralement de 1 cm.
- Contourage des organes à risque : tous les organes à risque adjacent (os, paquet vasculo-nerveux…) doivent être contourés coupe par coupe.
- Il faudra être vigilant à ce que l’irradiation du membre ne soit pas circonférentielle (risque de syndrome des loges). L’os doit au maximum être épargné (risque de fracture).
- Il est impératif de s’assurer du bon repositionnement du patient, au minimum de façon hebdomadaire.
- La dose est délivrée en fractionnement classique (5 fractions hebdomadaires de 1,8 à 2 Gy par jour, tous les faisceaux étant délivrés le même jour) :
- Exérèse R0 : 50 Gy dans l’ensemble du volume irradié
- Exérèse R1 : 50 Gy dans l’ensemble du volume irradié + boost sur lit tumoral de 4 à 10 Gy (dose totale 54-60 Gy)
- Exérèse R2 : 50 Gy dans l’ensemble du volume irradié + boost sur lit tumoral de 10 à 16 Gy (dose totale 60-66 Gy)
- Radiothérapie préopératoire : entre 45 et 54 Gy (adapter au cas par cas)
- Radiothérapie exclusive : entre 60 et 66 Gy
- Le boost pourra éventuellement être réalisé en curiethérapie
- Les traitements hypofractionnés sont exclusivement utilisés dans une intention palliative.
- La chimiothérapie des STM de l'adulte doit comporter en première intention une anthracycline administrée à une dose optimale.
- Les polychimiothérapies majorent les taux de réponse objective, mais ne modifient pas la survie globale de ces patients.
- L’indication d’une chimiothérapie doit être discutée en RCP.
- L’emploi d’une chimiothérapie adjuvante systématique reste controversée dans le traitement des STM de l’adulte. Elle ne représente pas un standard.
- Si la preuve est faite qu’une chimiothérapie adjuvante améliore la survie sans rechute locale et la rechute sans métastase, son incidence sur la survie globale n’est pas démontrée. Cette approche peut être proposée aux patients sélectionnés à haut risque (grade 2-3, >5 cm).
- Si chimiothérapie adjuvante : utilisation d’une association comportant de la doxorubicine et de l’ifosfamide à doses optimales (4 à 6 cycles).
- Pour les STM localement avancés ne pouvant pas bénéficier d'une chirurgie carcinologiquement satisfaisante d'emblée, la chimiothérapie néo-adjuvante peut induire une réduction du volume tumoral et permettre ainsi la réalisation d'un geste locorégional secondaire (chirurgie ± radiothérapie) carcinologiquement satisfaisant. De plus, elle agirait en traitant de façon précoce les métastases infracliniques. A discuter en cas de STM de taille volumineuse et de haut grade. Des rémissions complètes prolongées ont été rapportées par plusieurs groupes avec ce type de procédures thérapeutiques.
- Pour les tumeurs d'emblée opérables, il n'est pas démontré qu'une chimiothérapie néo-adjuvante améliore la survie globale ou la survie sans récidive.
- Il n'existe pas de protocole de chimiothérapie néo-adjuvante standard dans les STM. Dans la mesure où l'objectif principal dans cette situation est le taux de réponse, la préférence doit être donnée aux protocoles de polychimiothérapie (association doxorubicine + ifosfamide).
- Privilégier les inclusions dans un essai thérapeutique.
- Elle s’adresse aux patients métastatiques pour lesquels un programme à visée curative ne peut être proposé.
- En l’absence de possibilité curative : monochimiothérapies successives (standard).
- En effet, si les associations donnent régulièrement des taux de réponses supérieurs, cela ne se traduit pas en termes de survie globale ; en revanche, la toxicité des associations est toujours plus forte.
- La doxorubicine est le premier choix, à la dose de 75 mg/m² toutes les 3 semaines suivi par l’ifosfamide à la dose de 5 à 9 g/m² toutes les 3 semaines.
- Si l’objectif est plus ambitieux (possibilité secondaire d’un traitement complémentaire chirurgical et/ou radiothérapique laissant entrevoir un avantage en survie) : optimisation de la réponse tumorale avec l’emploi d’une polychimiothérapie.
NB : l’association actuellement utilisée est : doxorubicine+ifosfamide.
-
Inclusion dans un essai thérapeutique recommandée
- Les cytostatiques utilisables au-delà de la première ligne de chimiothérapie sont : pazopanib, trabectidine, paclitaxel, docétaxel, gemcitabine, sels de platine, vinorelbine, étoposide, dacarbazine, à choisir selon le type et sous-type histologique du STM.
- Chez ces patients, la qualité de vie prime sur l'obtention d'une réponse objective et l'administration séquentielle des drogues les plus efficaces doit être préférée à leur administration concomitante.
- Cette technique peut être utilisée seule ou dans le cadre d’un traitement multidisciplinaire pour éviter une amputation chez les patients atteints de STM des membres localement évolués, métastatiques ou non métastatiques.
- Discussion en RCP de recours des patients qui relèvent de cette technique.
- Elle vise à diagnostiquer une récidive de manière suffisamment précoce pour permettre un traitement utile. Les récidives à distance sont essentiellement pulmonaires. En cas de tumeur de haut grade, les rechutes surviennent à 75-80 % dans les 3 premières années suivant le diagnostic. En cas de tumeur de bas grade, les récidives essentiellement locales peuvent survenir de très nombreuses années après.
- La pratique d’examens IRM systématiques n’est pas indiquée pour les tumeurs des membres. Néanmoins en pratique, la surveillance clinique locale souvent en terrain irradié n’est ni sensible ni spécifique.
- On ne sait pas si la pratique de scanners thoraciques systématiques affecte la résécabilité de lésions détectées ou la survie des malades.
- La surveillance vise aussi à mettre en évidence les problèmes de réadaptation, les effets secondaires des traitements et à les prendre en charge.
- Standards :
- examen clinique
- scanner thoracique.
- Recommandations interrégionales :
- examen clinique + IRM locale
- TDM thoraco-abdominal avec injection pour les sarcomes avec contingent myxoïde (liposarcome myxoïde, myxofibrosarcome), sarcome alvéolaire, à cellules claires et synovialosarcome
- bilan biologique chaque année après chimiothérapie
- pour les patients traités par anthracyclines : examen cardiaque avec échographie tous les 2-3 ans.
- Rythme :
- Le rythme de la surveillance peut être modulé en cas de faible risque de rechute locorégionale et/ou métastatique
- L’apparition d’une symptomatologie entre deux consultations doit évidemment faire avancer la consultation suivante.
| Surveillance GRADE 1 |
Examen clinique | Radiologie ou scanner thoracique | IRM locale (option) |
| 1ère et 2ème année | 6 mois | 6 mois | 6 mois |
| 3ème à 5ème année | 6 mois | 6 mois | 6 mois |
| 5ème à 10ème année | 12 mois | 12 mois | 12 mois |
| Surveillance GRADE 2 ou 3 |
Examen clinique | TDM thorax * | IRM locale (option) |
| 1ère et 2ème année | 4 mois | 4 mois | 4 mois |
| 3ème à 5ème année | 6 mois | 6 mois | 6 mois |
| 5ème à 10ème année | 12 mois | 12 mois | 12 mois |
* TDM thoraco-abdominal pour sarcome myxoïde, alvéolaire, à cellules claires, épithélioïdes et synovialosarcome.
| T | |
| Tx | Tumeur primitive non évaluable |
| T0 | Tumeur primitive non retrouvée |
| T1 | Tumeur <5 cm dans son plus grand diamètre |
| T1a | Tumeur superficielle |
| T1b | Tumeur profonde |
| T2 | Tumeur ≥ 5 cm dans son plus grand diamètre |
| T2a | Tumeur superficielle, qui respecte le fascia superficiel |
| T2b | Tumeur profonde, qui atteint le fascia superficiel ou s’étend au-delà |
| N | |
| N0 | Absence de ganglion envahi |
| N1 | Envahissement ganglionnaire |
| M | |
| M0 | Absence de métastase |
| M1 | Métastase(s) à distance |
| Stades | T | N | M | G |
| Stade IA | T1a T1b |
N0 N0 |
M0 M0 |
G1, Gx |
| Stade IB | T2a T2b |
N0 N0 |
M0 M0 |
G1, Gx |
| Stade IIA | T1a T1b |
N0 N0 |
M0 M0 |
G2, G3 |
| Stade IIB | T2a T2b |
N0 N0 |
M0 M0 |
G2 |
| Stade III | T2a T2b tout T |
N0 N0 N1 |
M0 M0 M0 |
G3 G3 tout G |
| Stade IV | tout T | tout N | M1 | tout G |
- Proposé par la Fédération Nationale des Centres de Lutte contre le Cancer (FNCLCC).
Différenciation tumorale Score 1 Sarcomes ressemblant à un tissu adulte normal (ex: liposarcome bien différencié) Score 2 Sarcomes pour lesquels le diagnostic histologique est certain (ex : liposarcome myxoïde) Score 3 Sarcomes embryonnaires, synovialosarcomes, sarcomes épithélioïdes, à cellules claires, alvéolaires des parties molles, sarcomes indifférenciés et sarcomes pour lesquels le type histologique est incertain Index mitotique (surface du champ : 0,174 mm²) Score 1 0 à 9 mitoses pour 10 HPF (pour 10 champs à l'objectif X 40) Score 2 10 à 19 mitoses pour 10 HPF Score 3 Plus de 19 mitoses pour 10 HPF Nécrose tumorale Score 0 Absence de nécrose Score 1 <50 % de nécrose tumorale Score 2 >50 % de nécrose tumorale RESULTATS Grade I Somme des scores = 2-3 (risque métastatique faible) Grade II Somme des scores = 4-5 (risque métastatique réel) Grade III Somme des scores = 6-8 (risque métastatique élevé) - Le grade d'un sarcome peut se modifier au cours de l'évolution.
- Voir la liste des essais cliniques.
- Bonvalot S.
Sarcome des tissus mous de l'adulte : état des lieux
Convergence Edition, avril 2013
- Bonvalot S, Missenard G, Rosset P, Terrier P et al.
Principes du traitement chirurgical des sarcomes des tissus mous des membres et du tronc de l'adulte.
EMC 2013
- Edge SB, Compton CC.
The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM.
Ann Surg Oncol. 2010;17:1471-4.
- Haas RL, Delaney TF, O'Sullivan B, Keus RB et al.
Radiotherapy for management of extremity soft tissue sarcomas : why, when, and where ?
Int J Radiation Oncol Biol Phys 2012 ;84 :572-580.


