Collaborateurs
Coordonnateurs interrégionaux
FOUCHER Pascal
CHU de Dijon (21)
Coordonnateurs régionaux
LOCHER Chrystèle
Grand Hôpital de l'Est Francilien (77)
MAIROVITZ Alexa
CHI de Villeneuve St Georges (94)
Rédacteurs
MONNET Isabelle
CHI de Créteil (94)
Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des Dispositifs Spécifiques Régionaux du Cancer de Bourgogne-Franche-Comté (OncoBFC), du Grand Est (NEON) et d'Île-de-France (ONCORIF), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 16 mai 2024.
- Les données disponibles dans la littérature concernant la vaccination des patients recevant une chimiothérapie pour tumeurs solides sont peu nombreuses, rendant difficile l’évaluation de la balance bénéfice/risque des vaccins chez ces patients et dans la majorité des cas, les considérations théoriques priment et les recommandations reposent sur des avis d’experts.
- Les informations utilisées dans ce document sont en grande partie issues du rapport de l’HCSP (Haut Conseil de la Santé Publique) sur les recommandations en terme de vaccination des personnes immunodéprimées ou aspléniques et sur le calendrier des vaccinations et recommandations vaccinales 2024.
- L'immunodépression induite par la chimiothérapie entraîne un risque accru d'infections et particulièrement d'infections sévères mettant en jeu le pronostic vital. Certaines de ces infections peuvent être prévenues par des vaccins, en particulier dirigés contre le pneumocoque, la grippe saisonnière ou la COVID-19. Ces vaccins ont donc un intérêt potentiel chez l'immunodéprimé.
- Certains patients en bon état général porteurs de cancers bronchiques traités par chimiothérapie "au long cours" (cas des chimiothérapies de maintenance par exemple) sont susceptibles de voyager dans des zones à risque (fièvre jaune, choléra, hépatite A…).
- Certaines vaccinations sont susceptibles d’entraîner des maladies vaccinales chez l'immunodéprimé. Il s'agit essentiellement des vaccins vivants qui sont donc contre-indiqués chez les patients sous chimiothérapie et pendant les 6 mois qui suivent la chimiothérapie :
- BCG
- vaccin contre la rougeole
- vaccin contre les oreillons
- vaccin contre la rubéole
- vaccin contre les rotavirus
- vaccin contre la fièvre jaune
- vaccin contre la poliomyélite par voie orale (n'est plus utilisé en France)
- vaccin contre la varicelle (VARILRIX®, VARIVAX®)
- vaccin contre le zona (ZOSTAVAX®)
- vaccin contre la grippe par voie nasale (FLUENZ®)
- vaccins viraux réplicatifs contre le SARS-CoV-2.
- Il n'y a pas de risque supplémentaire à vacciner les patients immunodéprimés avec des vaccins inactivés, ni d'augmentation des effets indésirables associés (Vollaard, 2017).
- Tableau récapitulatif :
| Vaccins contre-indiqués en cours de chimiothérapie et dans les 6 mois qui suivent son arrêt | Vaccins autorisés en cours de traitement | ||
| Vaccins vivants atténués | Vaccins inactivés | ||
| Vaccins anti-viraux | Vaccins anti-bactériens | Micro-organisme entier tué | Déterminants antigéniques |
| Rougeole | BCG | Grippe | Coqueluche acellulaire |
| Oreillons | Hépatite A | Diphtérie | |
| Rubéole | Poliomyélite (voie inj) | Tétanos | |
| Varicelle | Rage | Hépatite B | |
| Zona | Encéphaliye japonaise | Haemophilus influenza B | |
| Fièvre jaune | Encéphalite à tiques | Pneumocoque (conjugué et polysaccharidique) | |
| Grippe (voie nasale) | Typhoïde | Méningocoque (conjugué) | |
| Rotavirus | Typhoïde | ||
| Grippe | |||
| HPV | |||
- Le traitement immunosuppresseur entraîne une diminution de l'immunogénicité (baisse du nombre et de la fonctionnalité des lymphocytes T CD4, des Ig M et Ig A), et potentiellement de l'efficacité des vaccins (Mackall, 2000). Cela a été montré pour le vaccin anti-grippal avec un taux de séroconversion inférieur après vaccination chez les patients porteurs de cancers, mais néanmoins une efficacité clinique constatée chez les patients porteurs de cancers vaccinés par rapport aux patients porteurs de cancers non vaccinés, permet d'être très en faveur de la vaccination (Beck, 2012).
- Le bénéfice net de la vaccination anti-grippale est confirmé chez les patients atteints de tumeur solide ; l'efficacité est moindre chez les patients avec une hémopathie maligne (Blanchette, 2019).
- Il est probable que l'immunodépression entraîne également une diminution de la durabilité de la réponse vaccinale. Augmenter la dose d'antigène (à la première injection, rappels…), améliorer la présentation de l'antigène (adjuvants, voie intra-dermique) sont des pistes pour améliorer l'immunogénicité mais ne font pas, à ce stade, l'objet de recommandations de pratique clinique.
- Ne pas oublier d'associer à la vaccination, le port du masque et le lavage des mains.
- Si possible au moins 10 jours avant la chimiothérapie mais il n'y a pas de contre-indication à vacciner le jour de la chimiothérapie (J0).
- Pour les patients déjà sous chimiothérapie :
- de préférence entre 2 cures de chimiothérapie
- éviter le nadir
- mais les données sont rassurantes quant à l'efficacité selon le moment du cycle (Keam, 2017).
- A l’arrêt de la chimiothérapie : attendre au moins 6 mois pour l’administration de vaccins vivants.
- Pour l’ensemble des vaccinations du calendrier vaccinal et compte tenu de la baisse des anticorps lors de la chimiothérapie, au moins une injection de rappel sera effectuée systématiquement 3 à 6 mois après l’arrêt de la chimiothérapie. En effet, en fonction de l’histoire vaccinale et de l’âge du patient, une ou plusieurs doses supplémentaires pourront être nécessaires pour mettre à jour les vaccinations (pour diphtérie, tétanos, poliomyélite, coqueluche, vaccination antipneumococcique).
- Il n’y a aucune contre-indication à vacciner avec plusieurs vaccins inactivés le même jour (en 2 points d'injection distants).
- Les vaccins recommandés en 2024 sont :
- les vaccins du calendrier vaccinal non vivants
- les vaccins anti-grippal inactivé (en période endémique) et antipneumococcique (notamment en cas de splénectomie ou d'irradiation splénique)
- les vaccins contre le SARS-CoV-2 selon les modalités en vigueur.
- Il est possible de proposer le virus respiratoire syncytial (AREXVY) chez les patients de plus de 60 ans, mais celui-ci n'a pas de remboursement (note de cadrage HAS).
- Le patient, quelles que soient les modalités de son traitement, l'entourage du patient et les professionnels de santé susceptibles de le prendre en charge.
- L’entourage des personnes immunodéprimées est une source potentielle de transmission d’agents infectieux par voie aérienne ou cutanée. En raison de la moindre immunogénicité des personnes sous chimiothérapies, il est fortement recommandé :
- de vacciner l'entourage immédiat défini comme toute personne vivant sous le même toit
- de vacciner l'entourage susceptible d'être en contact fréquent (famille, garde-malade...).
Cette recommandation s’applique aux vaccinations contre :- la rougeole et par extension contre les oreillons et la rubéole en vérifiant que la seconde dose soit bien réalisée pour toutes les personnes nées après 1980 selon les recommandations générales
- la grippe saisonnière en contre-indiquant la vaccination par le vaccin vivant atténué
- la varicelle et le zona en l’absence d’antécédents à l’interrogatoire et en cas de sérologie négative (en cas de rash ou d’éruption secondaire à la vaccination contre la varicelle ou zona, tout contact avec la personne immunodéprimée doit être évité jusqu’à résolution complète de l’éruption, en raison du risque de transmission du virus vaccinal).
- de vérifier et mettre à jour si besoin la vaccination des professionnels de santé susceptibles de les prendre en charge.
Cette recommandation s’applique aux vaccinations contre :- la rougeole et par extension contre les oreillons et la rubéole en vérifiant que la seconde dose soit bien réalisée pour toutes les personnes nées après 1980 selon les recommandations générales
- la coqueluche : à l’occasion d’un rappel décennal de DTP ou avec un délai minimal de 2 ans par rapport au dernier rappel
- la grippe saisonnière
- la varicelle et le zona en l’absence d’immunisation antérieure et en cas de sérologie négative (en cas de rash ou d’éruption secondaire à la vaccination contre la varicelle ou le zona, tout contact avec la personne immunodéprimée doit être évité jusqu’à résolution complète de l’éruption, en raison du risque de transmission du virus vaccinal).
Vaccins
contre-indiqués
Tous les vaccins vivants
sont contre-indiqués
pendant et au moins 6 mois
après la fin de la
chimiothérapie
* Diphtérie, Tétanos, Poliomyélite, Coqueluche
Vaccins
recommandés
comme en
population générale
Patient sous
chimiothérapie pour
tumeur solide ou
hémopathie maligne
- DTPC*
- Haemophilus influenzae B
- Hépatite B
- Méningocoque C (conjugué)
- Papillomavirus
Vaccins
spécifiquement
recommandés
- Grippe saisonnière
(vaccin inactivé)
(vaccin inactivé)
- Pneumocoque
- COVID
- Zona (Shingrix)
- L'immunodépression multiplierait le risque d'infection invasive à pneumocoque chez l'adulte immunodéprimé d'un facteur 5 à 23 (Klemets, 2010 ; Kyaw, 2005).
- Un vaccin pneumococcique recommandé est disponible et remboursé chez l’adulte :
- Standard : vaccin antipneumococcique polyosidique conjugué (20-valent, adsorbé) VPC20 (PREVENAR 20).
Le vaccin doit être administré par voie musculaire en dose unique.
- Standard : vaccin antipneumococcique polyosidique conjugué (20-valent, adsorbé) VPC20 (PREVENAR 20).
⇒ RAPPORT D'ÉVALUATION HAS : Stratégie de vaccination contre les infections à pneumocoque - Place du vaccin pneumococcique polyosidique conjugué (20-valent, adsorbé) chez l’adulte (juillet 2023)
- Recommandations issues du Calendrier vaccinal 2024 concernant la vaccination antipneumococcique chez les personnes en cours de chimiothérapie :
-
pour les personnes non antérieurement vaccinées : primovaccination pneumococcique par une dose unique de vaccin VPC20
-
pour les personnes n’ayant reçu antérieurement qu’une seule dose de VPC13 (PREVENAR 13) ou qu’une seule dose de VPP23 (PNEUMOVAX) : une dose de VPC20, si la vaccination antérieure remonte à plus de 1 an
-
pour les personnes déjà vaccinées avec la séquence VPC13-VPP23 : une dose de VPC20 en respectant un délai minimal de 5 ans après la précédente injection de VPP23, sachant qu’à ce jour, des données complémentaires sont nécessaires avant de recommander des injections de rappel.
-
- Option : Dans le cas où le vaccin VPC20 ne serait pas disponible ou adapté, le schéma VPC13 puis VPP23 reste utilisable.
- En France, la couverture vaccinale en oncologie ne dépasse probablement pas 30 % des patients (Loulergue, 2008), pourtant fréquemment âgés de plus de 65 ans, ce qui est très insuffisant, par défaut d'information (médecin traitant, oncologue, IDEC, pharmacien...), doutes sur l'efficacité, méconnaissance des modalités de réalisation pratique…
- Les médecins traitants sont demandeurs d'informations complémentaires pour participer plus activement à la promotion de la vaccination en général dans cette population (Glavier, 2019).
- Recommandations HSCP 2015 concernant la vaccination anti-grippale chez les personnes en cours de chimiothérapie :
- dès la mise à disposition du vaccin (fin septembre) et jusqu’au pic épidémique, en général janvier-février
- en cours de chimiothérapie et dans les 6 mois suivant l'arrêt de la chimiothérapie
- une revaccination à un mois d’intervalle est recommandée en période endémique chez les patients vaccinés en début de saison et encore sous traitement par chimiothérapie.
- Les thérapies ciblées (anticorps monoclonaux, inhibiteurs de kinase) semblent ne pas avoir d’impact négatif sur la réponse vaccinale concernant la vaccination anti-grippale (Chisholm, 2005 ; Rousseau, 2012).
- Une sérologie de l’hépatite B doit être réalisée avant toute thérapie du cancer et/ou corticothérapie au long cours afin de dépister les porteurs chroniques et les patients à risque (Ag HBs, AC anti-HBS et HBc).
- Chez les patients non immuns (Ag HBS, Ac anti-HBs, HBc négatifs) et à risque d’infection (détenus, partenaires sexuels multiples, usagers de drogues, professions à risque d’exposition aux liquides biologiques, susceptibles d’être transfusés à de multiples reprises…), il est fortement recommandé de réaliser une vaccination contre l’hépatite B et un contrôle des anti-corps vaccinaux à 4 semaines.
- Une sérologie VIH est également recommandée chez tous les patients.
- La vaccination contre le Covid-19 est recommandée chaque année, à l'automne, pour les personnes âgées de 65 ans et plus et les personnes à risque de forme grave de Covid-19.
- L’injection d’une dose supplémentaire de vaccin est recommandée au printemps pour les personnes âgées de 80 ans et plus, les personnes immunodéprimées et les résidents en EHPAD et USLD, en respectant un délai d'au moins trois mois depuis la dernière dose de vaccin ou la dernière infection.
-
La vaccination contre le zona est recommandée chez les personnes âgées de 18 ans et plus, immunodéprimées (déficit immunitaire primitif ou acquis, traitement immunosuppresseurs) (recommandation HAS 2024). Cette recommandation concerne donc les patients présentant un cancer broncho-pulmonaire traités par chimiothérapie, thérapies ciblées, immunothérapie ou radiothérapie.
-
Seul le vaccin Shingrix (Antigène glycoprotéine E du Virus Varicelle-Zona) est actuellement utilisable chez ces patients (remboursement obtenu en décembre 2024).
-
Il doit être administré selon un schéma à deux doses espacées de deux mois (au maximum 6 mois).
-
Idéalement, il doit être réalisé le plus en amont possible du début du traitement immunosuppresseur, afin que le schéma vaccinal soit complété 14 jours avant l’initiation du traitement. Pour ce faire, l'intervalle entre les deux doses de vaccin peut être réduit à 1 mois si nécessaire.
-
Actuellement, la nécessité d'une dose de rappel après la primovaccination n'est pas établie.
(Adapté de la proposition Département Infectiologie CHU de Dijon 2014)
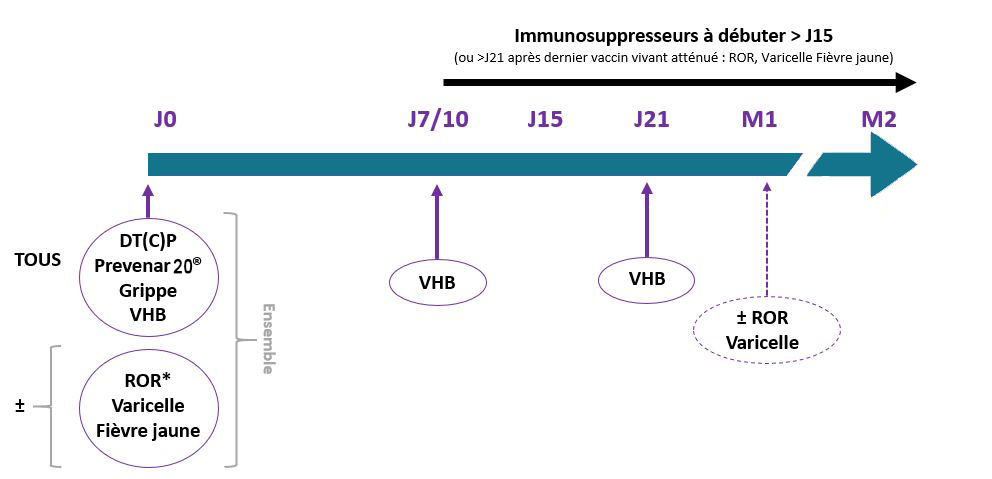
*ROR, varicelle, fièvre jaune :
- ROR : 1 dose pour :
- les personnes nées après 1980 et n'ayant pas reçu 2 doses de vaccin (1 ou 2 doses à 1 mois d'intervalle)
OU
- les personnes nées avant 1980, sans antécédent de rougeole, non vaccinées
ET
- les personnels de santé ou de la petite enfance.
- les personnes nées après 1980 et n'ayant pas reçu 2 doses de vaccin (1 ou 2 doses à 1 mois d'intervalle)
- Varicelle : si pas d'antécédent de varicelle et sérologie de la varicelle négative : 2 doses espacées de 4 à 8 ou 6 à 10 semaines selon le vaccin utilisé.
- Fièvre jaune : pour les voyageurs (pour les personnes déjà vaccinées ou originaires de la zone d'endémie, décision après contrôle de la sérologie).
- En dehors des chimiothérapies, les vaccins vivants atténués sont contre-indiqués chez les sujets recevant un autre type de traitement immunosuppresseur, une biothérapie et/ou une corticothérapie à dose immunosuppressive.
- Le BCG est contre-indiqué dans tous les cas.
- La vaccination contre les infections invasives à pneumocoque doit se faire avec le vaccin polyosidique conjugué 13-valent selon le schéma adapté à l’âge, suivi de l’administration du vaccin polyosidique non conjugué 23-valent, après un délai minimum de 2 mois (si âge >2 ans).
- Après l’arrêt d’un traitement immunosuppresseur (autre qu'une chimiothérapie), d’une biothérapie ou d’une corticothérapie à dose immunosuppressive : le délai à respecter pour l’administration d’un vaccin vivant est au minimum de 3 mois (6 mois après un traitement par rituximab).
- En cas de radiothérapie incluant la rate dans le champ d’irradiation, les vaccinations doivent être prévues comme dans le cas des patients aspléniques (avis d’expert).
- Pas d’études dans les autres cas de radiothérapie.
- Cependant, une modulation des réponses immunitaires de l’hôte est clairement décrite pendant la radiothérapie (Formenti, 2009). Cette immunomodulation induite par la radiothérapie dépendrait de la dose et du mode d’irradiation (fractionnement ou non). Actuellement, la majorité des études ont rapporté une stimulation des réponses immunitaires contre la tumeur, ce qui justifie les nombreux essais cliniques de combinaison de la radiothérapie avec l’immmunothérapie (Rubner, 2012 ; Gandhi, 2015).
- Néanmoins, une immunosuppression systémique transitoire est également décrite durant la radiothérapie (Formenti, 2009) et en l’absence d’évaluation de son impact sur l’efficacité vaccinale, il parait logique de différer toute vaccination de 3 à 4 semaines après les séances de radiothérapie.
- La question concernant les thérapies ciblées est plus complexe car il existe plusieurs cibles moléculaires qui en plus peuvent relayer différentes voies cellulaires et métaboliques interconnectées. L’impact de ces traitements sur le système immunitaire ne peut être vu qu’à l’échelle individuelle du médicament ciblant. Ainsi :
- aucune donnée de la littérature n’a étudié l’effet des ITK de l’EGFR sur les vaccins
- aucune étude n’a rapporté un impact délétère de ces ITK de l’EGFR sur le système immunitaire dans le cancer bronchique
- les thérapies ciblées (anticorps monoclonaux, inhibiteurs de kinase) ne semblent pas avoir d'impact négatif sur la réponse vaccinale à la vaccination anti-grippale (Chisholm, 2005 ; Rousseau, 2012).
- En l’absence de contre-indication, ces patients peuvent être vaccinés pendant le traitement selon le schéma vaccinal décrit ci-dessus.
- Pour le thorax, cette classe concerne actuellement les anti-PD1, anti-PD-L1 et anti-CTLA4.
- Peu de données et de recul sont disponibles.
- Le rapport bénéfice-risque éventuel de la vaccination pour un patient doit être discuté au cas par cas.
- Les vaccins vivants restent CONTRE-INDIQUÉS (BCG, ROR, fièvre jaune et vaccins SARS-COV-2 à vecteur vivant réplicatif).
- La vaccination anti-grippale :
- n'augmente pas le risque d'effets indésirables immuno-induits (Wijn, 2018), notamment graves (myocardite) (Awadalla, 2019) voire elle les diminue possiblement (Awadalla, 2019)
- est très efficace :
- en terme de séroprotection/séroconversion (Bersanelli, 2019)
- et significativement plus que pendant une chimiothérapie (Keam, 2020)
- et indépendamment de la chronologie de l'administration du vaccin par rapport à celle de l'immunothérapie : avant le début du traitement par immunothérapie, le jour de l'administration de la première cure, ultérieurement (Chong, 2020)
- et notamment 7 jours après l'injection de l'immunothérapie (Bayle, 2020).
- ne semble pas avoir d'impact sur l'efficacité thérapeutique des inhibiteurs de point de contrôle (Bersanelli, 2018).
- Il n'y a pas d'argument pour ne pas vacciner les patients durant le traitement par immunothérapie (notamment la vaccination anti-grippale qui est recommandée).
- Il y a peu de données concernant le vaccin antipneumococcique chez les patients sous immunothérapie.
Concernant la vaccination contre le SARS-CoV-2, il n’est pas noté de signal défavorable lors de son utilisation en cours de traitement pour ICI, voire même de possibles bénéfices réciproques (Brest, 2022).
- Awadalla M, Golden DLA, Mahmood SS, et al.
Influenza vaccination and myocarditis among patients receiving immune checkpoint inhibitors.
- Bayle A, Khettab M, Lucibello F, et al.
Immunogenicity and safety of influenza vaccination in cancer patients receiving checkpoint inhibitors targeting PD-1 or PD-L1.
Ann Oncol. 2020 ; 31(7) : 959-961.
- Beck CR, McKenzie BC, Hashim AB, et al.
Influenza vaccination for immunocompromised patients: systematic review and meta-analysis by etiology.
J Infect Dis. 2012 ; 206(8) : 1250-1259.
- Bersanelli M, Buti S, De Giorgi U, et al.
State of the art about influenza vaccination for advanced cancer patients receiving immune checkpoint inhibitors: When common sense is not enough.
Crit Rev Oncol Hematol. 2019 ; 139 : 87-90.
- Bersanelli M, Giannarelli D, Castrignanò P, Fornarini G et al.
INfluenza Vaccine Indication During therapy with Immune checkpoint inhibitors: a transversal challenge. The INVIDIa study.
Immunotherapy. 2018 ; 10(14) : 1229-1239.
- Blanchette PS, Chung H, Pritchard KI et al.
Influenza vaccine effectiveness among patients with cancer : a population-based study using health administration and laboratory testing data from Ontario, Canada.
J Clin Oncol. 2019 ; 37(30) : 2795-2804.
-
Brest P, Mograbi B, Hofman P, Milano G.COVID-19 vaccination and cancer immunotherapy : should they stick together ?
- Chisholm J, Howe K, Taj M, Zambon M.
Influenza immunisation in children with solid tumours.
Eur J Cancer. 2005 ; 41 : 2280-2287.
- Chong CR, Park VJ, Cohen B, et al.
Safety of Inactivated Influenza Vaccine in Cancer Patients Receiving Immune Checkpoint Inhibitors
Clin Infect Dis. 2020 ; 70 : 193-199.
- Formenti SC, Demaria S.
Systemic effects of local radiotherapy.
Lancet Oncol. 2009 ; 10 : 718-726.
- Gandhi S, Schwalm JD, Velianou JL, et al.
Comparison of Dual-antiplatelet Therapy to Mono-antiplatelet Therapy After Transcatheter Aortic Valve Implantation: Systematic Review and Meta-analysis.
Can J Cardiol. 2015 ; 31 : 775-784.
- Glavier M, Puyade M, Roblot F, Rammaert B.
Vaccination of cancer patients treated with chemotherapy: A survey among general practitioners.
Med Mal Infect. 2019 ; 49(8) : 586-592.
- HCSP Haut Conseil de la Santé Publique
Avis du 07/11/2014
Vaccinations des personnes immunodéprimées ou aspléniques. Recommandations.
- HCSP Haut Conseil de la Santé Publique
Avis du 25/04/2013.
Recommandations de la vaccination pour les adultes et les enfants âgés de plus de 2 ans à risque d’infection invasive à pneumocoque.
- Keam B, Kang CK, Jun KI, Moon SM et al.
Immunogenicity of Influenza Vaccination in Patients with Cancer Receiving Immune Checkpoint Inhibitors.
Clin Infect Dis. 2020 ; 71 : 422-425.
- Keam B, Kim M, Choi Y et al.
Optimal timing of influenza vaccination during 3-week cytotoxic chemotherapy cycles.
Cancer. 2017 ; 123(5) : 841-848.
- Klemets P, Lyytikäinen O, Ruutu P, Ollgren J et al.
Risk of invasive pneumococcal infections among working age adults with asthma.
Thorax. 2010 ; 65(8) : 698-702
- Kourie HR, Klastersky JA.
Side-effects of checkpoint inhibitor-based combination therapy
Curr Opin Oncol. 2016 ; 28(4) : 306-313.
- Kourie HR, Awada G, Awada AH
Rare side-effects of checkpoint inhibitors.
Curr Opin Oncol. 2016 ; 28(4) : 295-305.
- Kyaw MH, Rose CE Jr, Fry AM, et al.
The influence of chronic illnesses on the incidence of invasive pneumococcal disease in adults.
Infect Dis. 2005 ; 192(3) : 377-86.
- Loulergue P, Mir O, Alexandre J, et al.
Low influenza vaccination rate among patients receiving chemotherapy for cancer.
Ann Oncol. 2008 ; 19(9) : 1658.
- Mackall CL.
T-cell immunity following antineoplasic therapy : a review.
Stem Cells. 2000 ; 18(1) : 10-8.
- Pennock GK, Chow LQM.
The Evolving Role of Immune Checkpoint Inhibitors in Cancer Treatment.
Oncologist. 2015 ; 20(7) : 812-822.
- Rousseau B, Loulergue P, Mir O, et al.
Immunogenicity and safety of the influenza A H1N1v 2009 vaccine in cancer patients treated with cytotoxic chemotherapy and/or targeted therapy: the VACANCE study.
Ann Oncol. 2012 ; 23(2) : 450-457.
- Rubner Y, Wunderlich R, Rühle PF, et al.
How does ionizing irradiation contribute to the induction of anti-tumor immunity?
Front Oncol. 2012 ; 2 : 75.
- Sharpe AH.
Introduction to checkpoint inhibitors and cancer immunotherapy.
Immunol Rev. 2017 ; 276(1) : 5-8.
- Vollaard A, Schreuder I, Slok-Rajimakers L, Opstelten W et al.
Influenza vaccination in adult patients with solid tumors treated with chemotherapy.
Eur J Cancer. 2017 ; 76 : 134-143.
- Wijn DH, Groeneveld GH, Vollaard AM, Muller M et al.
Influenza vaccination in patients with lung cancer receiving anti-programmed death receptor 1 immunotherapy does not induce immune-related adverse events.
Eur J Cancer. 2018 ; 104 : 182-187.


