Sommaire
Collaborateurs
Coordonnateurs régionaux
CHEVAUX Jean-Baptiste
CHRU de Nancy (54)
BACHELLIER Philippe
HU de Strasbourg (67)
KOCH Stéphane
CHU de Besançon (25)
Rédacteurs
AYAV Ahmet
CHRU de Nancy (54)
BOINETTE Aurélien
CHU de Besançon (25)
CALAME Paul
CHU de Besançon (25)
SAVA Elena Claudia
Uneos (57)
STOUVENOT Morgane
CHU de Besançon (25)
Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 20 décembre 2021.
- Cette référence présente la démarche diagnostique et thérapeutique ainsi que la surveillance devant une tumeur kystique du pancréas (TKP).
- Les lésions les plus fréquentes :
- Cystadénome séreux
- Cystadénome mucineux
- Tumeur Intra Papillaire et Mucineuse du Pancréas (TIPMP)
- Tumeur Pseudo-Papillaire et Solide (TPPS) ou tumeur de Frantz.
- Ni les lésions moins fréquentes (ni les lésions bénignes) ne seront abordées :
- pseudo-kyste du pancréas
- tumeur endocrine kystique
- adénocarcinome kystique
- pancréatoblastome
- tératome et kyste desmoïde
- tumeurs kystiques à cellules acineuses
- métastases pancréatiques kystiques.
- Bilan sanguin : il n'existe pas de bilan discriminant à orientation diagnostique.
- Bilan d'imagerie : il repose sur les 3 examens suivants :
- TDM thoraco-abdomino-pelvien : examen de première intention, avec au minimum les acquisitions suivantes :
- acquisition sans injection : recherche d'éventuelles calcifications au sein de la lésion, en périphérie ou parenchymateuses
- acquisitions après injection de produit de contraste iodé à la phase artérielle différée (40 s) et à la phase portale (70 s), en coupes submillimétriques
- avec reformations multiplanaires.
- IRM pancréatique comportant au minimum (séquences conventionnelles T1/ T2 sans injection et une séquence de diffusion) :
- une exploration canalaire biliopancréatique
- une exploration multiphasique du parenchyme pancréatique après injection du produit de contraste.
- Echoendoscopie biliopancréatique :
- à réaliser avec un échoendoscope linéaire afin d’effectuer une exploration complète de la glande pancréatique
- ± associée à une ponction guidée sous échoendoscopie
- ± associée à une échographie de contraste en cas de suspicion de nodule tissulaire.
- Le PET-Scan n'est pas indiqué en 1ère intention.
- TDM thoraco-abdomino-pelvien : examen de première intention, avec au minimum les acquisitions suivantes :
- Le matériel recueilli (souvent sans microfragment tissulaire) est partagé entre l’analyse biochimique (ACE, lipase, glucose intrakystique) et la cytopathologie et doit être immédiatement inclus sur un fixateur.
- Analyse biochimique intrakystique :
- matériel frais, liquidien, recueilli dans un tube sec (1 à 2 mL)
- si le matériel recueilli est minime, favoriser le dosage de l'ACE par rapport à la lipase (disctinction tumeur mucineuse et non mucineuse)
- si le matériel est suffisant, possibilité de réaliser un string-test
- dosage de la glycémie.
- Analyse anatomo-pathologique :
- le matériel recueilli doit immédiatement être inclus sur un fixateur
- le cytopathologiste doit disposer de tous les renseignements nécessaires pour la démarche diagnostique.
- Mode de diagnostic
- Données sociodémographiques
- Etat général, indice OMS, IMC, comorbidités
- Antécédents personnels et familiaux
- Description des symptômes éventuels
- Résultats de l'imagerie actuelle et antérieure :
- scanner thoraco-abdomino-pelvien
- IRM pancréatique
- échoendoscopie (avec ponctions).
- Résultats de l'analyse intrakystique (biochimique et cytopathologique).
- Diagnostic :
- Atteinte du canal principal :
- épaississement de sa paroi
- dilatation ≥ 6 mm
- Atteinte des canaux secondaires :
- présence d'une communication
- Imagerie :
- en cas d'atteinte du canal principal, qu'elle soit isolée ou associée à une atteinte d'un canal secondaire, le risque de dégénérescence à 5 ans est de l'ordre de 50 %. 40 à 50 % des patients opérés présentent un carcinome invasif à l'anatomo-pathologie.
- en cas d'atteinte isolée des canaux secondaires, le risque de dégénérescence à 5 ans est <5 % lorsque les patients sont asymptomatiques. Moins de 10 % des patients opérés présentent un carcinome invasif à l'anatomo-pathologie.
- Atteinte du canal principal :
- Traitement : chirurgie
| Indications de chirurgie | |
| Indications absolues | Indications relatives |
| Cytologie positive/Dysplasie de haut grade | Extension ≥ 5 mm/an |
| Masse solide | Taux sanguin de CA 19.9 >37 U/mL (en absence d'ictère) |
| Ictère (en rapport avec la tumeur) | Dilatation du canal pancréatique principal entre 5 et 9,9 mm |
| Nodule ≥ 5 mm avec prise de contaste | Diamètre de la lésion ≥ 40 mm |
| Dilatation du canal pancréatique principal ≥ 10 mm | Apparition d'un diabète |
| Pancréatite aiguë secondaire à la TIPMP | |
|
Nodule <5 mm avec prise de contraste
|
|
- Type d’exérèse :
-
privilégier l'éxèrèse droite (duodénopancréatectomie céphalique = DPC) ou pancréatectomie gauche avec examen extemporané obligatoire de la tranche de section.
-
la duodénopancréatectomie totale (DPT) doit rester une indication d'exception. Une alternative à la DPT est de traiter les lésions principales (selon les critères) et de surveiller les autres lésions.
-
curage ganglionnaire dans le même temps (identique à un adénocarcinome pancréatique)
-
option : radiofréquence en cas de patient inopérable après avis RCP.
-
-
Examen extemporané sur la recoupe du canal communicant :
- dysplasie de bas grade : pas de recoupe.
- dysplasie de haut grade : il faut faire une recoupe et refaire un examen extemporané.
- Surveillance postopératoire :
- dans la mesure du possible, les examens non irradiants sont à privilégier.
- si le compte-rendu anatomo-pathologique définitif retrouve une TIPMP sans critères de dégénérescence : poursuite de la surveillance
- si le compte-rendu anatomo-pathologique définitif retrouve une dégénérescence en adénocarcinome : voir la prise en charge des adénocarcinomes du pancréas.
- En cas de mauvais état général ou chez le patient inopérable : arrêt de la surveillance.
Pas d'indication de chirurgie
Indications de chirurgie ?
Suspicion à l'imagerie
de TIPMP
Chirurgie
Surveillance :
- examen clinique
- IRM ou échoendoscopie
tous les 6 mois pendant 1an
puis tous les ans
Surveillance à vie si
pancréatectomie partielle
Surveillance intensive :
- examen clinique
- dosage CA 19.9
- IRM ou échoendoscopie
tous les 6 mois
Indications relatives
Indications absolues
(1 ou plus)
(1 ou plus)
Patient avec comorbidités
(ou courte espérance de vie)
et une seule indication relative
pour la chirurgie
(ou courte espérance de vie)
et une seule indication relative
pour la chirurgie
- Patient sans comorbidité
et plus d'une indication relative
pour la chirurgie - Patient avec comorbidités
et plus de 2 indications relatives
pour la chirurgie
- Epidémiologie : femme âgée (60-70 ans)
- Le diagnostic est porté sur l’imagerie
-
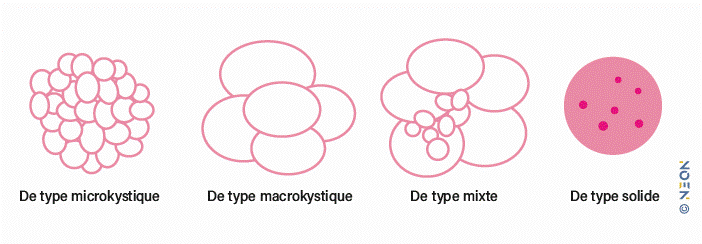
4 types sont retrouvés à l'imagerie + absence de communication avec le canal pancréatique principal :
- microkystique
- macrokystique
- type mixte : macro- et microkystes
- type solide.
- Définition de la « biochimie intrakystique typique » non mucineuse :
- ACE intrakystique <5 ng/mL
- lipase intrakystique basse.
- Le cystadénome séreux n’a pas de potentiel de dégénérescence
- En cas de diagnostic formel, aucune surveillance ne doit être proposée
- La chirurgie et le traitement endoscopique ne doivent être réservés qu’aux complications.
- Epidémiologie : femme jeune (40-50 ans)
- Définition de « l'imagerie typique » :
- aspect macro kystique uni- ou macroloculaire
- absence de prise de contraste
- absence de calcification (ou parfois périphérique)
- discret hypersignal du contenu sur les séquences en pondération T1 avant injection de produit de contraste
- pas de communication avec le canal pancréatique principal
- présence de septas possible mais non obligatoire
- localisation préférentielle : jonction corps-queue (partie postérieure).
- Définition de la « biochimie typique mucineuse » :
- ACE intrakystique élevé (80 % des cystadénomes mucineux ont un taux d’ACE >200 ng/mL)
- lipase intrakystique basse
- glucose intrakystique <0,5 g/L.
- Traitement :
- devant toute suspicion de cystadénome mucineux, si le patient est opérable, proposer une chirurgie d'exérèse pancréatique réglée
- indications formelles de chirurgie : >4 cm et/ou critères de dégénérescence
- indications relatives de chirurgie : <4 cm sans critères de dégénérescence : une surveillance peut être proposée.
- devant toute suspicion de cystadénome mucineux, si le patient est opérable, proposer une chirurgie d'exérèse pancréatique réglée
- Surveillance postopératoire :
- si anatomo-pathologie définitive retrouve un cystadénome mucineux (CM) bénin : pas de surveillance
- si anatomo-pathologie définitive retrouve un cystadénome mucineux (CM) dégénéré : voir la prise en charge de l'adénocarcinome du pancréas.
- pour les patients non opérables : pas de surveillance.
- Epidémiologie : lésion de la femme jeune de 20-30 ans
- Il n'existe pas d'imagerie typique, ni de marqueurs tumoraux spécifiques
- Faible grade de malignité, agressivité locale, bon pronostic si exérèse curative
- Ponction sous échoendoscopie : à discuter en RCP (Karsenti, 2020)
- En cas de certitude diagnostique : réaliser une chirurgie carcinologique d’emblée (Yepuri, 2020).
RCP
Risque de dégénérescence
Cystadénome
mucineux
TIPMP
Cystadénome séreux
typique
Pas de risque de dégénérescence
- TDM-IRM
- échoendoscopie
- ± cytoponction
- ± échographie de contraste
Découverte d'une tumeur kystique du pancréas
Maladie non mucineuse
Lipase haute ?
Cystadénome
séreux
Pseudo-kyste
Cystadénome
mucineux
TIPMP
Lipase haute ?
Maladie mucineuse
Dosage ACE intrakystique >200 ng/mL ?
Glucose intrakystique <0,5 g/L *
* (McCarty, 2021)
- European Study Group on Cystic Tumours of the Pancreas.
European evidence-based guidelines on pancreatic cystic neoplasms.
Gut. 2018 ;67:789-804.
- Jais B, Rebours V, Malleo G, Salvia R et al.
Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas).
Gut. 2016 ;65:305-12.
- Karsenti D, Caillol F, Chaput U, Perrot B et al; from the GRAPHE.
Safety of Endoscopic Ultrasound-Guided Fine-Needle Aspiration for Pancreatic Solid Pseudopapillary Neoplasm Before Surgical Resection: A European Multicenter Registry-Based Study on 149 Patients.
Pancreas. 2020 ;49:34-38.
- McCarty TR, Garg R, Rustagi T
Pancreatic cyst fluid glucose in differentiating mucinous from nonmucinous pancreatic cysts: a systematic review and meta-analysis
Gastrointest Endosc. 2021; 5:1-15.
- Tanaka M, Fernández-Del Castillo C, Kamisawa T, Jang JY et al.
Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas.
Pancreatology. 2017;17:738-753.
- Vege SS, Ziring B, Jain R, Moayyedi P and the Clinical Guidelines Committee
American gastroenterological association institute guideline on the diagnosis and management of asymptomatic neoplastic pancreatic cysts.
Gastroenterology. 2015 ;148:819-22; quize12-3.
- Yepuri N, Naous R, Meier AH, Cooney RN et al.
A systematic review and meta-analysis of predictors of recurrence in patients with Solid Pseudopapillary Tumors of the Pancreas.
HPB (Oxford). 2020 ;22:12-19.


