Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels des DSRC de Bourgogne-Franche-Comté (OncoBFC), du Grand Est (NEON) et d'Île-de-France (ONCORIF), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 16 mai 2024.
- Cette référence a pour objectif d’aider les professionnels :
- à connaître les principaux éléments indispensables à une prise en charge de qualité
- à préparer le dossier du patient en vue, soit d’une validation, soit d’une discussion de la stratégie de prise en charge en Réunion de Concertation Pluridisciplinaire (RCP)
- à informer le patient des modalités de prise en charge qui peuvent lui être proposées.
- Les cancers bronchiques non à petites cellules (CBNPC) représentent les formes histologiques les plus fréquentes des cancers bronchiques (environ 85 % des cas).
- Les carcinomes neuroendocrines bronchiques à grandes cellules sont abordés dans la référence corrrespondante.
- La prise en charge des nodules pulmonaires n'est pas abordée dans cette référence.
- Les modalités de prise en charge du patient font l’objet d’une discussion en RCP, le cas échéant en RCP moléculaire, tenant compte de son âge, du Performance Status, de ses comorbidités, du stade TNM, des caractéristiques biologiques de la tumeur et de la situation sociale. Les informations sont transmises dans les meilleurs délais au médecin traitant.
- Les différents aspects de la maladie et des traitements sont expliqués au patient et à ses proches.
- Des documents d’information sur les différents aspects de la maladie et des thérapeutiques sont disponibles et remis au patient, ainsi qu’un document traçant le Programme Personnalisé de Soins.
- Les protocoles et schémas thérapeutiques sont écrits, disponibles, connus et régulièrement actualisés. Il existe des protocoles relatifs à la prise en charge des effets indésirables.
- Le patient doit pouvoir bénéficier d’une aide à l’arrêt du tabagisme qui sera systématiquement proposée (HAS, 2014 ; INCa, 2016).
- Le patient doit pouvoir bénéficier d’une prise en charge de la douleur.
- Le patient doit bénéficier de soins de support (diététique, réhabilitation…) tout au long de la prise en charge. Le patient peut bénéficier de soins palliatifs par une équipe et/ou une structure spécialisée, fixe ou mobile.
- Le patient et sa famille peuvent bénéficier d’une prise en charge psychologique.
- Le patient et sa famille peuvent bénéficier d’une prise en charge sociale.
- Une recherche d’exposition professionnelle, en vue d'une éventuelle déclaration et réparation, doit être systématique :
- En cas de constatation de plusieurs cas de cancers dans la famille du patient, une consultation d’oncogénétique peut être proposée.
- La participation à un protocole de recherche clinique doit être envisagée à toutes les étapes de la maladie.
- Une évaluation gériatrique peut être proposée pour aider la prise en charge médicale.
- Le diagnostic doit privilégier les prélèvements histologiques, même si les cytoblocs peuvent également permettre la réalisation d’études moléculaires. Le pathologiste doit veiller à préserver le matériel pour ces études et si possible limiter les analyses immunohistochimiques. Au cas où la biopsie diagnostique initiale ne permet pas l'analyse moléculaire faute de matériel ou par échec d'amplification, une deuxième biopsie doit être réalisée.
- Le nombre de biopsies bronchiques doit être supérieur à 5 pour le diagnostic et idéalement 5 en plus pour le phénotypage sur les zones suspectes, soit 10 au total (Dietel, 2016). En cas de biopsies transthoraciques pour des lésions périphériques, il est nécessaire de réaliser plusieurs prélèvements (calibre de l'aiguille de 20G ou 18G par système co-axial). Les renseignements cliniques et le compte-rendu de l'endoscopie bronchique doivent être transmis au pathologiste.
- La fixation des prélèvements histologiques doit utiliser le formol 4 %. Il faut proscrire les fixateurs à base d’acide picrique et d’AFA et éviter les sur-fixations et sous-fixations. En cas de décalcification* sur métastase osseuse, l’utilisation d’acide fort n’est pas recommandée. La qualité du matériel ADN et ARN peut en effet être dégradée. EDTA et acide formique sont à privilégier.
* Différents protocoles de décalcification. Impacts sur les techniques d’analyse complémentaires. Bulletin de la Division Française de l’Académie internationale de Pathologie n°63 juin 2016
- En l’absence de différenciation malpighienne ou glandulaire reconnaissable sur la coloration classique HES, il est recommandé de réaliser une recherche de mucines par coloration histochimique et une étude immunohistochimique avec les anticorps anti-TTF1 ou P40 (les marqueurs CK5-6 sont moins spécifiques). Selon l’aspect morphologique, il peut être utile d’exclure également un carcinome neuroendocrine à grandes cellules à l’aide d’anticorps comme la chromogranine A, synaptophysine, INSM1 et CD56. La réalisation systématique de marqueurs neuroendocrines sans profil morphologique évocateur n’est pas recommandée (Yatabe, 2019).
Adénocarcinome
d'architecture solide
Immunohistochimie
anti-TTF1 et anti P40 ?
TTF1 -
P40 +
TTF1 +
P40 -
TTF1 -
P40 -
CBNPC dont le
phénotype
est en faveur d'un
carcinome malpighien
CBNPC
dont le phénotype
est en faveur d'un
adénocarcinome
CBNPC NOS
sur la morphologie
des cellules
(Not Otherwise Specified)
CBNPC dont le
phénotype est en faveur
d'un adénocarcinome ou
d'un carcinome adénosquameux
TTF1 +
P40 +
Mucines ?
(neutres et/ou acides)
Carcinomes non à petites cellules
sans morphologie glandulaire malpighienne
ou neuroendocrine en histologie standard
- Une recherche de l'expression de PD-L1 en immunohistochimie sur les cellules tumorales doit être systématique dès le diagnostic initial pour tous les carcinomes non à petites cellules à un stade avancé ou métastatique dans le respect des recommandations internationales et nationales d'assurance qualité.
- Une recherche d’altérations moléculaires doit systématiquement être demandée pour les patients ne relevant pas d’un traitement locorégional (gènes EGFR, RET, ALK, ROS1 en priorité et c-MET (exon 14), HER2, KRAS G12C, BRAF, NTRK et NRG1 pour la deuxième ligne). (Patients atteints d'un cancer bronchique non à petites cellules : Indications des tests moléculaires en vue de la prescription de traitements de précision, INCa 2023).
- en cas de cancer non épidermoïde (adénocarcinome et NOS)
- en cas de tout autre cancer bronchique chez les non fumeurs, les personnes qui ont fumé <100 cigarettes au total, ou petits fumeurs, <15PA ou des ex-fumeurs ayant arrêté depuis plus de 10 ans (Planchard, 2018)
- d'autres altérations moléculaires peuvent être recherchées, selon les indications : sujet jeune, épuisement des lignes thérapeutiques standards
- en l’absence d’anomalies moléculaires et selon les indications, il peut être justifié de présenter le dossier à l’une des RCP France Médecine Génomique des cancers (AURAGEN ou SeqOIA).
- Pour les patients présentant un CBNPC de stade IB à IIIA réséqué, une recherche de mutation de l'EGFR (notamment del 19 et L858R) est recommandée en vue d'un traitement adjuvant par immunothérapie (Avis HAS du 19 Janvier 2022 favorable au remboursement dans cette indication).
- L'immunohistochimie ALK peut être suffisante pour établir le diagnostic sous réserve de respect des critères qualités.
- Selon les recommandations 2017 émises par la Société Française de Pathologie (SFP) et l’Association Française d’Assurance Qualité en Anatomie Pathologie (AFAQAP) pour le testing ALK dans les CBNPC :
- Si test immunohistochimique (IHC) ALK score 3+ (intensité forte) = pas de contrôle systématique. Indication à une thérapie ciblée.
- Si test IHC ALK score 2+ ou 1+ = contrôle du réarrangement par une technique moléculaire complémentaire.
- Si test IHC ALK score 0 = pas de contrôle systématique. Pas d’indication à une thérapie ciblée.
- L'IHC ROS1 ne dispose pas à ce jour des mêmes performances et n'est pas suffisante.
- Selon les recommandations 2018 émises par la SFP et l’AFAQAP pour le testing ROS-1 dans les CBNPC : l’immunohistochimie peut être utilisée comme un outil de dépistage. Tous les cas positifs, quels que soient l’intensité et le pourcentage de cellules marquées, doivent être contrôlés par FISH ou par technique moléculaire.
- Si le prélèvement tissulaire est insuffisant ou si l'ADN est non amplifiable, une recherche de mutations est recommandée sur l'ADN tumoral circulant.
- D'autres recherches de biomarqueurs pourront être réalisées selon les modalités de chaque plateforme INCa, en l'absence des précédentes altérations moléculaires et/ou dans le cadre d'essais cliniques.
- L’interprétation du résultat de biologie moléculaire devra tenir compte du pourcentage de cellules tumorales, de la sensibilité des techniques de détection utilisées ainsi que des panels de mutations identifiées par les techniques.
4.1.
Bilan pré-thérapeutique d'un cancer bronchique (adapté de INCa, 2011) :
- La fibroscopie bronchique est un examen permettant de réaliser un diagnostic histologique, mais également d'évaluer l'opérabilité (distance par rapport à la carène, aux bifurcations bronchiques).
- En cas de lésion distale ou non accessible en fibroscopie bronchique, une ponction transthoracique peut être réalisée soit :
- sous échographie en cas de contact pleural
- sous contrôle scanographique (lésion sans contact pleural).
- En cas de cancer bronchique avéré ou suspecté, un scanner thoraco-abdomino-pelvien et une IRM cérébrale (à défaut un scanner cérébral) doivent être réalisés, quel que soit le stade, y compris en l'absence de signe neurologique.
- Pour les patients relevant potentiellement d’un traitement locorégional à visée curative, une TEP-TDM au 18F-FDG doit être réalisée.
- En cas d’adénomégalies médiastinales au scanner (≥ 10 mm petit axe en TDM) si TEP-TDM au 18F-FDG négative sur les N médiastinaux et présence d'au moins 1 des 3 facteurs suivants : 1) cN1, 2) T >3 cm, 3) tumeur centrale (guidelines ESTS, 2014 ; ESMO), une confirmation histocytologique est recommandée si cela doit changer la prise en charge.
- Plusieurs méthodes permettent d’explorer l’atteinte ganglionnaire médiastinale, en cas d’adénomégalies au scanner thoracique et/ou fixant à la TEP-TDM au 18F-FDG et en l’absence de diffusion métastatique :
- les ponctions transbronchiques et/ou transœsophagiennes sous échoendoscopie
- les biopsies transthoraciques sous TDM
- la médiastinoscopie ou autre exploration chirurgicale du médiastin
- la thoracoscopie gauche
Si elle est disponible, la première méthode à appliquer est l'EBUS mais doit être confirmée par un staging invasif chirurgical dont la médiastinoscopie reste la référence (Rami-Porta, 2018 ; De Leyn, 2014 ; Bousema, 2023).
- Une imagerie spécifique adaptée à l’évaluation de l’atteinte vasculaire, neurologique ou pariétale (IRM ou angio-TDM) peut être utile (par exemple : IRM en cas de tumeur de l'apex).
- En cas de suspicion de maladie oligométastatique, il est recommandé d’obtenir une preuve histocytologique si un site suspect de métastase est facilement accessible.
- Un épanchement pleural doit être exploré par ponction pleurale et en cas de négativité par biopsies sous vidéo-thoracoscopie si cela doit modifier la prise en charge thérapeutique.
- Une scintigraphie osseuse peut être réalisée en cas de points d'appels osseux et quand la TEP-TDM au 18F-FDG n'est pas indiquée ou accessible rapidement (car la maladie n'est pas accessible à un traitement locorégional). La scintigraphie osseuse peut être couplée à un scanner ("SPECT-CT"). Sinon, elle peut être complétée par une IRM ou un scanner des zones suspectes (pour une prise en charge locale).
- Les marqueurs tumoraux sanguins ne sont d’aucune utilité pour le dépistage, le diagnostic et le suivi des CBNPC.
- Une évaluation des fragilités gériatriques est souhaitable en fonction de l’état général du patient et l’âge. Le dépistage d'une fragilité est proposé chez les patients à partir de 70 ans, via le questionnaire G8. Une évaluation oncogériatrique dédiée et approfondie est indiquée en cas de G8 inférieur ou égale à 14.
- L'évaluation de la réserve cardio-respiratoire avant chirurgie du cancer bronchique peut être faite selon les recommandations européennes (Brunelli, 2009) ou américaines (Brunelli, 2013) :
4.2.1.
Evaluation préopératoire de la fonction respiratoire selon les recommandations de l'ERS/ESTS (Brunelli, 2009)
- % : toutes les valeurs sont exprimées en pourcentage de la valeur théorique
- DLCOpop : valeur postopératoire prédite de la diffusion pulmonaire du monoxyde de carbone
- VEMSpop : valeur postopératoire prédite du volume maximum expiré en 1 seconde
- VO2 max : consommation maximale d'oxygène (mL/kg/min)
(>20 mL/kg/min)
(en % de la VT)
- Réaliser une spirométrie
- Mesure de la DLCO
- Evaluation cardiologique
| Facteurs de risques | Score |
| Créatinine >176 µmoles/L | 1 |
| Cardiopathie ischémique | 1,5 |
| Maladie cérébro-vasculaire | 1,5 |
| Pneumonectomie envisagée | 1,5 |
- Des explorations complémentaires cardio-vasculaires doivent être demandées à l'issue de l'évaluation clinique, de l'ECG et de la créatininémie si le score est >1,5.
4.2.3.
Evaluation préopératoire de la fonction respiratoire selon les recommandations de l'ACCP (adapté de Brunelli, 2013)
à faible risque
- Une scintigraphie pulmonaire de ventilation et de perfusion peut être utile en cas de réserve respiratoire limite.
- Classification TNM 8ème édition
- Cartographie ganglionnaire (2011)
hors cytologie
plèvre/péricarde
(stades IA à IB)
envahie :
traitement local
endobronchique
Chimiothérapie
selon statut pN
Chimiothérapie
(Cf. stade IIIA)
réséqués, après chimiothérapie
ou en cas d'atteinte ganglionnaire :
Chimio-immunothérapie (à discuter en RCP)
Si c/i : carboplatine/paclitaxel
adjuvante*
- La chirurgie du cancer bronchique doit être pratiquée par un chirurgien qualifié (ayant validé le DESC de chirurgie thoracique et cardiovasculaire et l’examen du Collège Français de Chirurgie Thoracique et Cardio-Vasculaire dans l’option thoracique) dans un établissement autorisé (le seuil minimal d'activité spécifique est de 30 interventions par an et par établissement et de 20 interventions majeures curatives par an et par chirurgien (recommandations INCa)).
- Pour les chirurgiens diplômés d'autres pays européens, la validation du European Board of Thoracic Surgery est une garantie de qualité et d’homogénéité.
- Exérèse complète
- La résécabilité de la tumeur ainsi que l'opérabilité du patient seront validées en RCP en présence du chirurgien thoracique.
- L'intervention sera réalisée selon les modalités techniques recommandées par la Société Française de Chirurgie Thoracique et Cardio-Vasculaire (objectif = résection R0).
- L’exérèse complète comporte nécessairement une exérèse anatomique associée à un curage ganglionnaire complet. L’étendue de l’exérèse anatomique (segmentectomie, lobectomie, bilobectomie, pneumonectomie) est définie en fonction du volume de la tumeur, de la topographie par rapport à la scissure, à l’arbre bronchique et aux vaisseaux. Un élargissement peut être nécessaire s’il y a une extension aux structures de voisinage (péricarde, oreillette gauche, diaphragme, paroi thoracique entre autres). L’étendue de l’exérèse est également conditionnée par les EFR, les comorbidités et l’âge.
- La segmentectomie anatomique peut être envisagée car elle est non inférieure à la lobectomie pour des tumeurs périphériques situées dans le tiers externe et <2 cm de diamètre, avec un ratio de consolidation >0,5. Un curage ganglionnaire interlobaire, intersegmentaire, scissural, hilaire et médiastinal sera systématiquement réalisé (Saji, 2022 ; Licht, 2022) Un consensus d'expert, sous l'égide de l'European Society of thoracic surgery, a rapporté des recommandations de bonnes pratiques techniques pour la réalisation des segmentectomies (Brunelli, 2023).
- Un curage ganglionnaire systématique est recommandé. Il concerne les ganglions interlobaires et scissuraux, hilaires et médiastinaux. Le curage doit porter sur au moins trois loges ganglionnaires médiastinales (à droite : paratrachéal, sous-carénaire et le site du ligament triangulaire ; à gauche : pré et sous-aortiques, sous-carénaire et le site du ligament triangulaire). Une analyse extemporanée systématique des ganglions intersegmentaires est recommandée afin de pouvoir transformer la résection segmentaire en une lobectomie en cas d’envahissement (Fei Xiao, 2018).
- Pour les petites tumeurs périphériques, il est nécessaire d'informer les patients sur les différentes voies d'abord disponibles que sont la thoracotomie, la vidéothoracoscopie et la chirurgie robotique. Les avantages et les inconvénients de chacune d'elles seront exposés aux patients avant de prendre la décision opératoire. Les techniques mini-invasives (thoracoscopie ou robot) sont recommandées pour les tumeurs de stade I (<4 cm) sans atteinte ganglionnaire (Scott, 2007 ; Allen, 2011).
- Options d'économie de parenchyme :
- Comme alternative à la pneumonectomie, la lobectomie avec bronchoplastie et/ou angioplastie est une alternative valable à condition qu’elle procure une résection complète. La lobectomie avec bronchoplastie permet de réduire la mortalité par comparaison à la pneumonectomie. Elle peut donc être pratiquée chez l'insuffisant respiratoire qui ne tolérerait pas la pneumonectomie, mais aussi de principe chaque fois qu’elle est réalisable.
- Il est possible de proposer une segmentectomie chez un patient ayant des EFR "limites", âgé ou fragile et si la taille de la tumeur et sa localisation le permettent. La radiothérapie stéréotaxique est une alternative à discuter en RCP.
- Le statut EGFR doit être systématiquement recherché sur la pièce opératoire.
- Options de traitements périopératoires :
- Une chimiothérapie néoadjuvante peut être proposée en option dans le cadre d’un essai clinique uniquement ; elle n’est pas indiquée dans le stade I et ne dispose pas de preuve factuelle dans les stades IIA.
- Une chimiothérapie immunothérapie néoadjuvante doit être discutée en RCP pour tous CBNPC de stade IIB à IIIA PD-L1 positif (selon 7ème classification TNM), une autorisation d'accès précoce ayant été validée par l'HAS en septembre 2023 pour les cancers à haut risque de récidive (exprimant PD-L1 au seuil ≥ 1 %). Or les cancers à haut risque de récidive y sont définis, entre autres, comme les tumeurs résécables ≥ 5 cm ou en cas d'atteinte ganglionnaire alors que les critères d'inclusion de l'étude Checkmate 816 sur lesquels est basé cet accès précoce, portait sur les patients stade IB avec tumeur ≥ 4 cm.
- Le geste chirurgical qui avait été prévu après chimio-immunothérapie doit toujours être réalisé, même si la réponse au traitement est très importante.
- Après 3 cures d'induction, il est recommandé de réaliser un nouveau bilan d'évaluation cérébral et TAP.
- En cas de T3 par atteinte pariétale, si l’exérèse a été complète, il n’y a pas de nécessité de réaliser une radiothérapie postopératoire. Elle doit être discutée en RCP en cas de doute sur le caractère complet de l’exérèse.
| Résection R | Définitions |
| R0 | Marges vasculaires, bronchiques, périphérie des structures réséquées en bloc histologiquement saines |
| R1 | Marges histologiquement non saines Cytologie d’un épanchement pleural ou péricardique positive |
| R2 | Résidus tumoraux ou ganglionnaires macroscopiques laissés en place |
- Définition SFCTCV et classification IASLC de la qualité de la résection :
- R0 : Marges vasculaires, bronchiques, périphérie des structures réséquées en bloc histologiquement saines et aucune des caractéristiques ci-dessous.
- R1 : Résidus microscopiques : marges histologiquement non saines, ganglion connu comme envahi mais non réséqué (si connu du chirurgien : R2), effraction extra-capsulaire ganglionnaire.
Cytologie d'un épanchement pleural ou péricardique positive. - R2 : Résidus tumoraux ou ganglionnaires macroscopiques laissés en place (idem que pour R1 mais macroscopiques)
- Run (unkown) : Pas d'argument pour un résidu tumoral post-opératoire mais curage ganglionnaire incomplet, dernier ganglion du curage envahi, présence de carcinome in situ sur la tranche de section, lavage pleural cytologiquement positif (absence de pleurésie en per op).
- Exérèse incomplète
- Un résidu macroscopique R2 est une indication d'une radiothérapie ou d'une association chimioradiothérapie comme pour un cancer localement avancé.
- Un résidu microscopique R1 correspond principalement à 2 entités différentes :
- la présence de carcinome in situ au niveau de la section muqueuse, justifie une surveillance attentive. En option, un traitement local (endobronchique) peut être proposé.
- la présence de carcinome invasif sur une tranche de section doit faire discuter une reprise chirurgicale (si l'état fonctionnel et général du patient le permet) ou une radiothérapie ou une association chimioradiothérapie, si le volume cible est identifiable avec précision (clips chirurgicaux, aspect TDM de la suture sans infiltration péribronchique).
- En cas d’exérèse complète, une radiothérapie médiastinale postopératoire, quel que soit le statut ganglionnaire, n'est plus recommandée (Lung Art). Il s’agit d’une option à discuter en RCP.
- En cas d’exérèse incomplète, une radiothérapie postopératoire doit être discutée en RCP et sera réalisée en fonction de l’état général du patient et du repérage par l’équipe.
- La chimiothérapie postopératoire systématique, chez tous les patients en état de la recevoir, est indiquée pour les stades IIA, IIB et IIIA. L'association vinorelbine-cisplatine (4 cycles) possède le meilleur niveau de preuve.
- La chimiothérapie doit être débutée si possible dans les 4 à 8 semaines suivant l’acte chirurgical.
- Options :
- en cas de contre-indication documentée au cisplatine (âge, PS, comorbidités…), une chimiothérapie par carboplatine-paclitaxel pourra être réalisée.
- une chimiothérapie adjuvante par cisplatine-pemetrexed a montré sa non-infériorité dans les histologies non épidermoïdes (étude JIPANG) (Kenmotsu, 2019).
- Pour les stades pIA et pIB, la chimiothérapie postopératoire n’est pas proposée en dehors d’un essai thérapeutique.
- Les tumeurs de mauvais pronostic (atteinte de la plèvre viscérale PT2 par exemple) mais n’ayant pas atteint le seuil de 4 cm (entre 3 et 4 cm) peuvent faire l’objet d'une discussion RCP pour l’indication d’une chimiothérapie adjuvante. Une inclusion dans un essai thérapeutique est également possible (14-GENE, le successeur éventuel de Mermaid, etc).
- En cas de mutation EGFR L858R ou Del19 (statut EGFR à rechercher systématiquement), l’osimertinib est indiqué pour les patients de stades IB et II (TNM 7) réséqués, après chimiothérapie adjuvante lorsqu’elle est indiquée ou réalisable, et restant PS 0-1, pour une durée de 3 ans. Si la chimiothérapie n’est pas réalisable, l’osimertinib est prescrit d’emblée. Actuellement, ces recommandations se basent sur l’amélioration de la SSP et de la survie globale (Masahiro, 2023).
- La non opérabilité du patient devra être validée par un chirurgien thoracique qualifié, après optimisation des comorbidités, sevrage tabagique et éventuel séjour en SSR respiratoire d’un patient atteint de BPCO (traitement de référence de sa maladie de fond).
- Si l'état général du patient le permet et en l'absence de contre-indication, une radiothérapie, en conditions stéréotaxiques, à visée curative est recommandée.
- En cas d’impossibilité d’obtenir un diagnostic histocytologique, la radiothérapie stéréotaxique peut être réalisée sur une lésion suspecte hypermétabolique à la TEP-TDM au 18F-FDG et évolutive, après avoir éliminé une étiologie infectieuse.
- Si la radiothérapie stéréotaxique n’est pas possible, discuter d’une radiothérapie conventionnelle 3D (RT3D) ou conformationnelle avec modulation d’intensité (RCMI), externe seule ou associée à une chimiothérapie (si preuve histocytologique de cancer).
- En cas de contre-indication à toute radiothérapie, une chimiothérapie peut être discutée s'il existe une preuve histocytologique de cancer.
- Une exérèse atypique peut être proposée dans le but d'obtenir un diagnostic histologique.
- Une recherche de variants pathogènes exhaustive par NGS doit être réalisée. A minima, les variants pathogènes EGFR et de réarrangements ALK doivent être systématiquement recherchés. En cas d'analyse EGFR négative, voire non contributive, sur une biopsie pré-opératoire, une analyse EGFR doit être renouvelée sur la pièce opératoire.
T2b
en l'absence de progression et si pas
et quelque soit le taux de PD-L1.
réséqués, après chimiothérapie
pour tous CBNPC de stade IIa à IIIb (N2) PD-L1 positif (accès précoce nivolumab)
| ACCP | Diagnostic N2 | Résécabilité |
| 1 | Infiltrant | Pas d'exérèse |
| 2 | Lors de la thoracotomie (peropératoire) malgré un bilan préopératoire bien conduit | Continuer l'exérèse si la résection complète est réalisable.
Si résection complète non réalisable, se reporter aux modalités de prise en charge des stades "non-résécables". |
| 3 |
Atteinte N2 évidente au scanner ou à la TEP-TDM au 18F-FDG,
n'entrant pas dans le cadre du groupe 1
|
Résécabilité à discuter au cas par cas en RCP |
- ACCP 1 : patients présentant un aspect scanographique d'infiltration ganglionnaire médiastinale qui encercle les vaisseaux et/ou les voies respiratoires. Les ganglions lymphatiques ne peuvent plus être discernés ou mesurés en tant qu'unités indépendantes.
- ACCP 3 : patients présentants un ou plusieurs adénomégalie(s) médiastinale(s). La taille des ganglions discrets peut être mesurée.
(Silvestri, 2013)
concomitante *
(durvalumab
en l'absence de
progression dans
1 à 6 semaines
après la fin de la
chimioradiothérapie
concomitante)
(2013)
en l'absence de
progression dans
1 à 6 semaines
après la fin de la
chimioradiothérapie
concomitante)
de la chimio-immunothérapie néoadjuvante.
- L'attitude thérapeutique sera discutée en RCP : elle dépend de la possibilité d'une résection complète de la tumeur et du geste nécessaire (notamment si pneumonectomie).
- Une recherche moléculaire exhaustive par NGS est indispensable.
- La discussion de la résécabilité ne concerne que les stades IIIA, en fonction de l'envahissement ganglionnaire homolatéral (N2). En effet, si les adénopathies circonscrites de petit volume à droite, para-trachéales basses ou inter-trachéo-bronchiques, à gauche sous-aortiques, para-aortiques ou inter-trachéo-bronchiques, peuvent être réséquées en totalité, les adénopathies para-trachéales hautes volumineuses constituent une contre-indication opératoire. La réalisation d'une échoendoscopie bronchique et/ou œsophagienne et/ou d’une médiastinoscopie doit être systématiquement discutée en RCP afin de ne pas récuser abusivement ni d’opérer à tort certains patients.
- En cas de forte suspiscion de N2, en cas d'EBUS négative, une exploration chirurgicale médiastinale doit être faite.
- Il est démontré qu'un envahissement microscopique est de moins mauvais pronostic qu'un envahissement massif et qu'une atteinte d'un seul relais ganglionnaire est moins péjorative qu'une atteinte de plusieurs niveaux (Garelli, 2016 ; Riquet, 2014).
- Les stades IIIB (T4N2 ou TxN3) sont jugés non résécables sauf quelques cas particuliers. Leur traitement repose sur une chimioradiothérapie concomitante.
- Une chimiothérapie ou une radiothérapie séquentielle peuvent être discutées en cas de contre-indication de l'association. La radiothérapie est délivrée à une dose équivalente de 66 à 70 Gy (fractionnement de 1,8 à 2 Gy/séance), éventuellement selon un schéma hypofractionné (Kaster, 2015).
- Pas d’accès à une immunothérapie en néoadjuvant actuellement. Néanmoins une demande d'AMM est en cours pour nivolumab selon les résultats de CHEKMATE 816. Inclusion possible dans des essais cliniques (chimio-immunothérapie néoadjuvante).
- Une chimio-immunothérapie néoadjuvante doit être discutée en RCP pour tous CBNPC de stade IIa à IIIb (N2) PD-L1 positif (accès précoce).
- En cas de PD-L1 négatif, une chimio-immunothérapie est peut être envisagée sous réserve d'une certitude quand à l'absence d'addiction oncogénique.
- En cas d'atteinte N2 prouvée, 2 attitudes peuvent être proposées :
- 4 cycles de chimiothérapie à base de sels de platine en péri-opératoire avec chirurgie d'exérèse (curage ganglionnaire hilaire et médiastinal complet).
Bilan de réévaluation après 2 cycles par imagerie cérébrale (IRM de préférence, sinon scanner injecté) et TAP-TDM (le TEP-TDM n'est pas validé dans cette indication). - chirurgie première avec chimiothérapie postopératoire comprenant 3 à 4 cycles de doublet à base de sels de platine (dans un délai de 6 semaines postopératoire) (Pignon, 2008). L'utilisation de facteurs de croissance en prophylaxie primaire peut se justifier notamment chez les patients pneumonectomisés ou en cas de fragilité identifiée (comorbidités, âge..) (non recommandée si une pneumectomie est hautement probable sur les données de l'imagerie).
- chimio-immunothérapie néoadjuvante nivolumab et sels de platine (AAP septembre 2023) 3 cures chez patients stade IIA (≥ 4cm) à IIIB d'emblée résécables (Forde, 2022 ; décision d'accès précoce HAS, 2023).
- 4 cycles de chimiothérapie à base de sels de platine en péri-opératoire avec chirurgie d'exérèse (curage ganglionnaire hilaire et médiastinal complet).
- ll n'y a pas d'indication à une radiothérapie postopératoire systématique (essai Lung Art).
L'indication éventuelle d’une radiothérapie postopératoire peut toutefois être discutée en RCP en cas de facteurs de risque de récidive locale chez les patients pN2 (nombre de ganglions envahis, ruptures capsulaires significatives, ratio ganglions envahis/ganglions prélevés) ou en cas de résection R1 si le volume cible est identifiable ou en cas de résection R2 (chimioradiothérapie). -
En cas de mutation EGFR L858R ou Del19, l’osimertinib est indiqué pour les patients de stades IIIA (TNM 7) réséqués, après chimiothérapie adjuvante lorsqu’elle est indiquée ou réalisable, et restant PS 0-1, pour une durée de 3 ans. Si la chimiothérapie n’est pas réalisable, l’osimertinib est prescrit d’emblée. Ces recommandations se basent sur l’amélioration de la survie sans progression (SSP) et de la survie globale.
-
En cas de réarrangement de ALK, l'alectinib est indiqué en adjuvant (AP) (Wu, 2024).
- Une association de chimiothérapie et de radiothérapie est recommandée si l’état du patient le permet :
- la chimiothérapie doit comporter 4 à 6 cures à base d'un sel de platine
- et être associée à une radiothérapie à une dose d'au moins 66 Gy (66 à 70 Gy) en standard.
- Hors essai clinique, l'augmentation de dose au-delà de 70 Gy (2 Gy/fr) n'est pas recommandée (RTOG 0617).
- Des EFR avec DLCO sont indispensables avant le début de la radiothérapie.
- Une technique conformationnelle est indispensable avec évaluation précise des volumes pulmonaires irradiés conformément. Une radiothérapie conformationnelle avec modulation d’intensité est recommandée si elle est disponible (Guide national des procédures de radiothérapie SFRO-SFPM) (Khalifa, 2022).
- L'association chimioradiothérapie concomitante est :
- recommandée chez les patients avec PS 0 ou 1, de moins de 70 ans
- la chimiothérapie doit être un doublet à base d'un sel de platine (à dose cytotoxique), mais sans gemcitabine et sans bévacizumab.
(Cf. Liste des médicaments pris en charge en sus).
- L'association chimiothérapie-radiothérapie séquentielle est possible voire préconisée chez les patients PS 2 et/ou âgés et/ou fragiles.
- La radiothérapie est délivrée à la dose de 66 Gy (66-70 Gy) en fractionnement classique après 4 premiers cycles de chimiothérapie. Un schéma hypofractionné peut être proposé en cas de modalité séquentielle (55 Gy en 20 fractions par exemple).
- Les 3 schémas de chimiothérapie les plus utilisés en concomitant de la radiothérapie sont :
- carboplatine AUC 2 + paclitaxel 45 mg/m2 hebdomadaire (option : carboplatine toutes les 3 semaines AUC 4 ou 5 + paclitaxel 45 mg/m2 hebdomadaire)
- cisplatine 80 mg/m2 (J1-J22) + vinorelbine 15 mg/m² (J1-J8-J22-J29)
- cisplatine 50 mg/m² (J1-J8-J29-J36) + étoposide 50 mg/m2 (J1-J5-J29-J33)
Option : pour les carcinomes non-épidermoïdes : cisplatine 75 mg/m² + pémétrexed 500 mg/m² (toutes les 3 semaines) (Senan, 2016).
- L’utilisation du durvalumab pendant 12 mois en débutant dans les 1 à 6 semaines après la fin de la chimioradiothérapie concomitante dans les stades III non opérables non progressifs a démontré une efficacité importante contre placébo en termes de survie sans progression (essai PACIFIC : Spigel, 2022). De même, l’immunothérapie adjuvante après radio-chimiothérapie séquentielle est possible avec une durée de 1 an, basée sur les données de l'essai PACIFIC 6 (phase 2) (Garassino, 2022). Le durvalumab a aussi montré une réduction du risque métastatique. Tous les patients sont éligibles au durvalumab quel que soit leur statut PD-L1. Une pneumopathie radique de grade >2 est une contre-indication au durvalumab. Ces résultats ne peuvent pas être appliqués aux autres anti-PD-L1.
- En cas de mutation EGFR ou réarrangement ALK, il n’y a pas de bénéfice à une immunothérapie d’un an avec un risque de toxicité surajoutée.
- Il n'y a pas d'indication validée de chimiothérapie avant chimioradiothérapie mais le début de la radiothérapie, souvent décalé pour des raisons organisationnelles, la chimiothérapie peut être débutée dans l'attente de la mise en place de la chimioradiothérapie.
- Il n'y a pas d'indication de chimiothérapie de consolidation, après chimioradiothérapie.
T4 N2
PS 0-2
- Chimioradiothérapie séquentielle
- Traitement systémique
si non irradiable
(durvalumab1 en l'absence de
progression dans 1 à 6 semaines
après la fin de la
chimioradiothérapie
concomitante)
(durvalumab1 en l'absence de
progression et sans mutation EGFR
après la fin de la chimioradiothérapie
- Chimioradiothérapie séquentielle
- Puis durvalumab1 en l'absence de
progression et sans mutation EGFRni réarrangement ALK dans 1 à 6 semaines
après la fin de la chimioradiothérapieconcomitante
- Traitement systémique
si non irradiable
- L'accès en RTU est possible pour le PD-L1 <1%. Accès normal pour PD-L1 ≥ 1%.
- Une pneumopathie radique de grade >2 est une contre-indication au durvalumab
- Ces résultats ne peuvent pas être appliqués aux autres anti-PD-L1
(durvalumab
en l'absence de
progression dans
1 à 6 semaines
après la fin de la
chimioradiothérapie
concomitante)
(durvalumab en l'absence de
progression et sans mutation EGFR
après la fin de la chimioradiothérapie
concomitante)
- Une suspicion d'atteinte vertébrale doit faire réaliser une IRM vertébrale dans le but d'une meilleure stratégie chirurgicale.
- Une suspicion d'atteinte de la jonction cervico-thoracique doit faire réaliser une IRM de cette jonction à la recherche d'un envahissement vasculaire (vaisseaux sous-claviers) et nerveux (plexus brachial).
- L'imagerie scanographique doit comporter des coupes cervico-thoraciques injectées et bénéficier d'une analyse précise de l'extension osseuse au niveau des vertèbres et des côtes.
- La chirurgie doit être réalisée par un chirurgien qualifié en chirurgie thoracique et ayant l'expérience de ce type de chirurgie. Cette chirurgie est réservée à des équipes de centres de référence.
- Dès la première RCP, l'opérabilité doit être définie par un chirurgien thoracique qualifié et expérimenté. En cas de N2 prouvé (par médiastinoscopie ou ponction sous EBUS), les patients ne tirent aucun bénéfice d'un acte chirurgical.
- Il est recommandé de réaliser d’emblée une association concomitante de chimiothérapie (doublet à base de sels de platine) et de radiothérapie entre 40 et 46 Gy, puis une réévaluation en vue d'une chirurgie et/ou poursuite de la chimiothérapie, jusqu’à une dose comprise entre 66 et 70 Gy (sans interrompre la radiothérapie, le temps du bilan et de la prise de décision en RCP).
- Chez les patients non opérables, une association chimioradiothérapie concomitante est le standard (PS0-1) et séquentielle pour les patients (PS 2 ou fragiles).
- Pour les CBNPC non épidermoïdes et en cas de cancer épidermoïde chez des non-fumeurs ou qui ont fumé <100 cigarettes au total, ou petits fumeurs, <15PA ou des ex-fumeurs ayant arrêté depuis plus de 10 ans, il est nécessaire de disposer d'une analyse de biologie moléculaire avant de débuter le traitement (thérapie ciblée disponible au remboursement en 1ère ligne) si l'état général du patient le permet.
ciblée
oncogénique ?
ciblée accessible ?
en l'absence d'addiction oncogénique"
- Une maladie oligométastatique doit faire discuter un traitement systémique en association au traitement local bifocal (chirurgie ou radiothérapie)
(Cf. référence Maladie oligométastatique).
- Pour les carcinomes non épidermoïdes, la première ligne de traitement ne doit se décider qu'avec la connaissance des altérations moléculaires éventuelles et du statut PD-L1 :
- PD-L1 ≥ 50 % : soit :
- Pembrolizumab (200 mg toutes les 3 semaines) (Reck, 2016).
(Si le pembrolizumab est bien toléré et la maladie tumorale contrôlée, il est possible de délivrer le pembrolizumab à la dose de 400 mg toutes les 6 semaines). - Pembrolizumab (200 mg toutes les 3 semaines) + sels de platine + pemetrexed, 4 cures suivies d'une maintenance par pemetrexed + pembrolizumab (Gandhi, 2018).
- Cemiplimab : avis favorable au remboursement de la CT du 06 octobre 2021 (Khalife, 2021)
- L'association immunothérapie + chimiothérapie est à privilégier en cas de lésions menaçantes avec un risque d'hyperprogression.
- Les facteurs suivants sont associés à une moins bonne réponse à la mono-immunothérapie :
- PS ≥ 2
- corticoïdes à forte dose
- antibiothérapie dans les 30 jours précédant le traitement
- le fait d'être non-fumeur.
- Dans ces cas, l'association chimiothérapie + immunothérapie est privilégiée sauf pour les PS supérieurs ou égaux à 2.
- Pembrolizumab (200 mg toutes les 3 semaines) (Reck, 2016).
- PD-L1 ≥ 50 % : soit :
- En cas de contre-indication au pembrolizumab : bithérapie à base de sels de platine +/- bevacizumab.
- Atezolizumab : AMM mais pas de remboursement
- PD-L1 <50 % : pembrolizumab + sels de platine + pémétrexed (Gandhi, 2018).
- En cas de contre-indication à l’immunothérapie : bithérapie à base de sels de platine ± bévacizumab
- L'association atézolizumab + carboplatine + paclitaxel + bévacizumab possède une AMM (mais ne bénéficie pas de remboursement)
-
L'association de la chimiothérapie (2 cures) avec nivolumab et ipilimumab possède une AMM mais pas de remboursement (étude Checkmate 9LA)
- Durée optimale de la chimiothérapie de 1ère ligne dans les stades IV :
- 4 à 6 cures (hors immunothérapie) sauf si progression ou intolérance
- si stabilité ou association au pembrolizumab : maximum de 4 cures.
2ème ligne
de 2ème ligne
ou stabilisation ?
- Standard :
- pembrolizumab
+ sels de platine
+ pémétrexed
(4 cycles) - pembrolizumab *
- cemiplimab
- Option :
Sels de platine ± pémétrexed
± bévacizumab
- pembrolizumab
- Standard :
carboplatine
+ paclitaxel hebdo
4 à 6 cycles - Options :
- pembrolizumab *
- carboplatine
+ pémétrexed - monothérapie :
gemcitabine, paclitaxel.
- Standard : carboplatine
+ paclitaxel hebdomadaire
4 à 6 cycles - Options : selon l'état général
et/ou évaluation gériatrique :- si PS 0 ou 1 :
pembrolizumab * - cemiplimab??
- chez des patients sélectionnés :
carboplatine
+ pémétrexed
+ pembrolizumab - carboplatine
+ pémétrexed - monothérapie :
gemcitabine, docétaxel,
paclitaxel, vinorelbine
- si PS 0 ou 1 :
- pembrolizumab
+ pémétrexed - pémétrexed
- bévacizumab (si administrée au départ)
- option :
pémétrexed + bévacizumab
(si cisplatine-pémétrexed-bévacizumab
au départ)
pembrolizumab seul :
discuter la possibilité d'arrêter à 2 ans
(selon réponse au traitement
sur TEP-TDM au 18F-FDG ,
CTAP ± IRM cérébrale)
de 2ème ligne
stabilisation ?
de 2ème ligne
carboplatine
+ paclitaxel hebdo
(4 à 6 cycles)
- carboplatine + pémétrexed
- monothérapie : gemcitabine,
docetaxel, paclitaxel, vinorelbine
support
- pémétrexed + pembrolizumab
- pémétrexed
- bevacizumab
(si administrée au départ) - pémétrexed + bévacizumab
(si administrés au départ)
selon l'état général et/ou
après évaluation gériatrique
- chez des patients sélectionnés :
carboplatine (4 cycles)
+ pémétrexed
+ pembrolizumab - carboplatine + pémétrexed
- monothérapie : gemcitabine,
docétaxel, paclitaxel, vinorelbine
+ sels de platine
+ pémétrexed
(4 cycles)
sels de platine
pémétrexed
± bévacizumab
sans addiction oncogénique
1ère ligne de traitement
PD-L1 <50 %
- Dans les essais d'enregistrement, le pembrolizumab est administré pour une durée maximale de 2 ans associé au pémétrexed (arrêt si intolérance) en cas d'association chimio-immunothérapie d'emblée. Néanmoins, selon l'AMM, le pembrolizumab est poursuivi jusqu'à progression ou intolérance. L'arrêt du pembrolizumab peut être proposé au-delà de 2 ans selon l'évaluation à 2 ans, la tolérance et l'avis du patient.
- Pour les patients restant PS 0 ou 1, répondeurs ou stables après 4 cycles de doublet de chimiothérapie à base de sels de platine :
- poursuite du bévacizumab si cette molécule a été administrée au départ
- poursuite du pémétrexed en traitement d'entretien toutes les 3 semaines (à l'exception des sujets âgés)
- option : poursuite du bévacizumab associé au pémétrexed chez des patients sélectionnés après discussion du dossier en RCP.
- Le traitement de maintenance n'est pas indiqué au-delà de 70 ans.
- En sus des marqueurs recherchés en première ligne, il est souhaitable de disposer des résultats des altérations moléculaires des gènes cMET, HER2, KRAS G12C, NTRK, BRAF avant de débuter la deuxième ligne.
- A partir de la deuxième ligne, la durée du traitement dépend de la tolérance, de l'efficacité du traitement et de l'état général.
En cas d’oligo-progression sous immunothérapie, la poursuite de l’immunothérapie peut être discutée en RCP après un traitement local du site témoin de la progression.
- En cas de chimiothérapie seule en 1ère ligne :
- immunothérapie seule : atézolizumab, nivolumab (quel que soit le statut PD-L1)
- immunothérapie seule : pembrolizumab (si statut PD-L1 ≥ 1 %)
- en cas de contre-indication à l'immunothérapie : chimiothérapie seule (pémétrexed, docétaxel, gemcitabine, paclitaxel ou vinorelbine)
- option : paclitaxel hebdomadaire-bévacizumab.
- En cas de chimio-immunothérapie en première ligne : chimiothérapie (docétaxel, schéma hebdomadaire possible ; gemcitabine, paclitaxel hebdomadaire). L'association paclitaxel hebdomadaire et bévacizumab est une option qui a démontré une meilleure efficacité que le docétaxel (Cortot, 2020) mais ne bénéficie pas d’AMM au moment de la rédaction de cette référence.
- En cas d'immunothérapie seule en première ligne : bithérapie à base de sels de platine ± bévacizumab en deuxième ligne possible.
- En cas de chimiothérapie seule : immunothérapie seule (atézolizumab, nivolumab (quel que soit le statut PD-L1) ; pembrolizumab (si statut PD-L1 ≥ 1 %)).
en 1ère ligne ?
support
seule
sans addiction oncogénique
- docétaxel (schéma
hebdomadaire possible) - paclitaxel (hebdomadaire)
- gemcitabine
- vinorelbine
- Option : paclitaxel
hebdomadaire
- bévacizumab
- Standard
- Immunothérapie :
- atézolizumab
- nivolumab
- pembrolizumab (si PD-L1 ≥ 1 %)
- Si contre-indication à l'immunothérapie :monochimiothérapie :
- pémétrexed
- docétaxel
- paclitaxel
- gemcitabine
- vinorelbine
- Immunothérapie :
- Option : paclitaxel hebdomadaire - bévacizumab
- carboplatine
+ paclitaxel
hebdomadaire - autre doublet à
base de platine - docétaxel
- paclitaxel
- gemcitabine
- vinorelbine
- sels de platine + pémétrexed
± bévacizumab - carboplatine + paclitaxel
± bévacizumab - cisplatine + docétaxel
- cisplatine + gemcitabine
- cisplatine + vinorelbine
- pémétrexed
- bévacizumab (si administré au départ)
- option : pémétrexed-bévacizumab
si cisplatine + pémétrexed+bévacizumab au départ
- Le traitement de 1ère ligne se décide en fonction du statut PD-L1 :
- PD-L1 ≥ 50 % :
- Soit pembrolizumab (à la dose de 200 mg toutes les 3 semaines) (Reck, 2016). Lorsque le pembrolizumab est bien toléré et la maladie tumorale contrôlée, il est possible de délivrer le pembrolizumab à la dose de 400 mg toutes les 6 semaines.
- Soit pembrolizumab (200 mg en dose unique) + carboplatine (AUC 6) + paclitaxel (175 à 200 mg/m2) J1/J22 pour 4 cycles, suivi d'une poursuite du pembrolizumab jusqu'à progression ou toxicité (Paz-Ares, 2018).
- Soit cemiplimab : avis favorable au remboursement de la Commission de Transparence du 6 octobre 2021 (Khalifa, 2021).
- Soit atézolizumab : AMM disponible mais non remboursé.
- L'association immunothérapie + chimiothérapie est à privilégier en cas de lésions menaçantes avec un risque d'hyperprogression.
- Les facteurs suivants sont associés à une moins bonne réponse à la mono-immunothérapie :
- PS ≥ 2
- corticoïdes à forte dose
- antibiothérapie dans les 30 jours précédant le traitement
- le fait d'être non-fumeur.
- Dans ces cas, l'association chimiothérapie + immnothérapie est privilégiée sauf pour les PS ≥ 2.
- En cas de contre-indication au pembrolizumab : bithérapie à base de sels de platine.
- PD-L1 ≥ 50 % :
- PD-L1 <50 % :
- Pembrolizumab (200 mg en dose unique) + carboplatine (AUC 6) + paclitaxel (175 à 200 mg/m2) J1/J22 pour 4 cycles, suivi d'une poursuite du pembrolizumab jusqu'à progression ou toxicité (Paz-Ares, 2018).
- En cas de contre-indication à l'immunothérapie, bithérapie à base de sels de platine pour 4 ou 6 cycles selon la tolérance et l’efficacité.
- En cas de contre-indication à l’immunothérapie : bithérapie à base de sels de platine ± bévacizumab.
- L'association de la chimiothérapie (2 cures) avec nivolumab et ipilimumab possède une AMM mais pas de remboursement (étude Checkmate 9LA).
- Poursuite du pembrolizumab à la même dose après carboplatine/paclitaxel/pembrolizumab (4 cycles d’induction) jusqu'à progression ou toxicité inacceptable (Paz-Ares, 2018).
- Option : gemcitabine chez les répondeurs après 4 cycles de cisplatine + gemcitabine.
- pembrolizumab
- gemcitabine
- docétaxel
- vinorelbine
- pembrolizumab
(après carboplatine +
paclitaxel + pembrolizumab) - gemcitabine
(après cisplatine + gemcitabine)
- pembrolizumab
- cemiplimab
- gemcitabine
- docétaxel
- vinorelbine
- pembrolizumab
- cemiplimab
- carboplatine
+ paclitaxel
+ pembrolizumab (4 cycles)
- cisplatine + docétaxel
- cisplatine + gemcitabine
- cisplatine + vinorelbine
- carboplatine + paclitaxel
- Standard :
carboplatine
+ paclitaxel hebdomadaire - Options : selon l'état général
et/ou évaluation gériatrique- gemcitabine
- docétaxel
- vinorelbine
- Standard :
carboplatine
+ paclitaxel hebdomadaire - Options :
- gemcitabine
- docétaxel
- vinorelbine
- pembrolizumab
(après carboplatine +
paclitaxel + pembrolizumab) - gemcitabine
(après cisplatine + gemcitabine)
- carboplatine
+ paclitaxel
+ pembrolizumab (4 cycles)
ou - bithérapie à base
de sels de platine- cisplatine + docétaxel
- cisplatine + gemcitabine
- cisplatine + vinorelbine
- carboplatine + paclitaxel
- En cas d’oligo-progression sous immunothérapie, la poursuite de l’immunothérapie peut être discutée en RCP après un traitement local du site témoin de la progression.
- En cas d'immunothérapie seule en 1ère ligne : bithérapie à base de sels de platine sans pémétrexed.
- En cas de chimio-immunothérapie en 1ère ligne : chimiothérapie seule (docétaxel, gemcitabine, paclitaxel ou vinorelbine).
- En cas de chimiothérapie seule en 1ère ligne :
- immunothérapie seule : atézolizumab, nivolumab (quel que soit le statut PD-L1)
- immunothérapie seule : pembrolizumab (si statut PD-L1 ≥ 1 %)
- en cas de contre-indication à l'immunothérapie : chimiothérapie seule (docétaxel, gemcitabine, paclitaxel ou vinorelbine).
- La durée du traitement dépend de la tolérance et de l'efficacité du traitement ainsi que de l'état général du patient.
+ immunothérapie
à base de sels de platine :
- carboplatine-paclitaxel
- cisplatine-docétaxel
- cisplatine-gemcitabine
- cisplatine-vinorelbine
support
- docétaxel
- paclitaxel
- gemcitabine
- vinorelbine
- carboplatine-paclitaxel
hebdomadaire - options :
- docétaxel
- paclitaxel
- gemcitabine
- vinorelbine
- atézolizumab
- nivolumab
- pembrolizumab PD-L1 ≥ 1 %
- docétaxel
- paclitaxel
- gemcitabine
- vinorelbine
- Patients <70 ans mais PS ≥ 2 : l'association à privilégier est carboplatine-paclitaxel hebdomadaire. L'utilisation du pembrolizumab en monothérapie est également une option si PD-L1 ≥ 50 %.
- Patients >70 ans :
- évaluation gériatrique favorable, PS 0 ou 1 :
- l'association à privilégier est carboplatine-paclitaxel hebdomadaire (Quoix, 2011)
- l'utilisation du pembrolizumab en monothérapie est également une option si PD-L1 ≥ 50 %.
- évaluation gériatrique défavorable, PS 2 :
- soins de support à proposer
- option : monothérapie par gemcitabine, paclitaxel hebdomadaire, vinorelbine.
- évaluation gériatrique défavorable, PS >2, quel que soit l'âge : soins de support.
- évaluation gériatrique favorable, PS 0 ou 1 :
favorable ?
favorable ?
- gemcitabine
- paclitaxel
- docétaxel
- vinorelbine
- Standard : carboplatine - paclitaxel
hebdomadaire (4 à 6 cycles)
pas de maintenance - Options :
- pembrolizumab
- autre doublet à base de sels
de platine
- Standard : carboplatine - paclitaxel
hebdomadaire (4 cycles)
pas de maintenance - Option : autre doublet à base
de sels de platine
oligométastatique
- l'observance
- les interactions médicamenteuses
- les interactions non médicamenteuses
- ± dosage pharmaceutique (liste des centres)
- biopsie, ADN circulant
selon bénéfice clinique
- Poursuite du ITK
- Discuter d'un traitement local du site
- Eviter la radiothérapie panencéphalique
(EGFR, ALK, ROS1, RET)
- Nouveau ITK/thérapie ciblée
adaptée au mécanisme de résistance identifié si possible - Doublet de chimiothérapie à base de sels de platine
sans immunothérapie ± bévacizumab - Essai clinique
- La recherche d'une addiction oncogénique doit être systématique au moment du diagnostic du stade avancé :
- de tout carcinome non épidermoïde, quel que soit le profil clinique
- en cas de tout autre cancer bronchique non à petites cellules chez des non-fumeurs ou qui ont fumé <100 cigarettes au total, ou petits fumeurs, <15PA ou des ex-fumeurs ayant arrêté depuis plus de 10 ans (Planchard, 2018).
- Cette recherche doit comprendre :
- de manière indispensable :
- mutations d'EGFR
- réarrangements d'ALK, de ROS1 et de RET.
- de manière indispensable :
- de manière recommandée pour le choix de traitements de 2ème ligne (selon AMM ou AAP ou AAC) :
- mutations de BRAF V600E
- mutations exon 14 de Met
- mutations de KRAS G12C
- réarrangements de NTRK
- mutations d'HER2 (dans la partie facultative car pas d’accès précoce ce jour)
- réarrangements NRG1
- amplification de MET.
- Différentes techniques de biologie moléculaires permettent le diagnostic des anomalies géniques : Encourager à recourir à la NGS (ADN et ARN) systématique pour rechercher / identifier les transcrits de fusion et les co-mutations.
Tableau 1 : Analyses de biologie moléculaire à effectuer au diagnostic
| Analyses indispensables | Analyses fortement recommandées | Analyses optionnelles | |
| AMM en 1ère ligne | AMM/AAP en 2ème ligne | Essais cliniques | |
| Mutations | EGFR (toutes mutations) | BRAF V600E | HER2 |
| MET exon 14 | |||
| KRAS G12C | |||
| Réarrangements | ALK | NTRK | autres (NRG1...) |
| ROS1 | |||
| RET | |||
| Amplification | HER2, MET |
Tableau 2 : Différentes techniques de biologie moléculaires permettant le diagnostic des anomalies moléculaires
| Mutations | Réarrangements | Amplifications | |
| Test unitaire | |||
| IHC | + (ALK, ROS1) | ||
|
PCR*, PCR digitale ou techniques ciblées multiplex**
|
+ | + | |
| FISH | + | + | |
| Panel NGS | |||
| ADN*** | + | + | + |
| ARN | + | + |
* Une seule mutation est recherchée à la fois avec un puits de PCR utilisé par mutation, possibilité de recherche jusqu'à épuisement de l'échantillon. La technique est très sensible : elle est en particulier appliquée à la détection de mutations dans l'ADN tumoral circulant du plasma (ou autres liquides) ou en cas de très faible cellularité tumorale du tissu analysé.
** Seules certaines mutations sont recherchées dans un exon ou plusieurs exons d'un gène considéré(s) selon les panels des sondes utilisées.
*** Séquençage de nouvelle génération ou NGS : séquençage de différents exons des gènes du panel et pas forcément sur l'ensemble du gène : attention au panel NGS utilisé.
- La présence d’une addiction oncogénique doit faire privilégier une séquence thérapeutique favorisant l’utilisation d’un ITK avant l’exposition à une immunothérapie lorsque cela est possible.
Lorsque la séquence débute par un doublet de chimiothérapies, l’adjonction d’une immunothérapie peut être discutée en fonction d’autres éléments :- tabagisme
- nature de l’addiction
- présence d’autres anomalies moléculaires.
- S'il est fait le choix d’ajouter une immunothérapie à la chimiothérapie, celle-ci devra être arrêtée pour une durée suffisante (>3 semaines) avant d’introduire l’ITK, afin d’éviter un risque de majoration de la toxicité de l’ITK. Une surveillance rapprochée de ce risque sera mis en place.
- Pour les CBNPC avec PD-L1 ≥ 50 %, l’utilisation d’une monothérapie d’immunothérapie doit faire l’objet d’une discussion sur le rapport bénéfice-risque de cette stratégie :
- inefficacité vs moindre toxicité de la CT-IO
- risque d’hyperprogression
- risque de toxicité majorée à l’introduction rapide de l’ITK après la mono-immunothérapie.
- Par ailleurs, il existe un risque majoré de toxicité lorsque les inhibiteurs de kinase sont prescrits après une immunothérapie et donc la séquence thérapeutique à privilégier est de positionner les ITK avant les ICI.
(Mazières, 2019)
- Avant de débuter un traitement par immunothérapie, il convient d'attendre les résultats de biologie moléculaire même en ayant reçu le résultat de l'IHC de PD-L1 car :
- l'expression de PD-L1 est inhérente à l'addiction oncogénique et non synonyme d'une réponse immunitaire anti-tumorale (Berghoff, 2019 ; Gettinger, 2016)
- une efficacité globalement moins importante des inhibiteurs de point de contrôle immunitaire est observée dans ces situations (Mazières, 2019)
- un risque accru de toxicité existe en cas de séquence rapprochée immunothérapie puis inhibiteur de kinase (Schoenfeld, 2019 ; Spigel, 2018).
- Les rares situations d'urgence vitale faisant indiquer le début d'un traitement systémique sans attendre les résultats de biologie moléculaire seront traitées par une chimiothérapie à base de sels de platine, éventuellement associée au bévacizumab mais sans immunothérapie (en cas de forte suspicion d'addiction, non-fumeur, ancien petit fumeur, origine asiatique).
- La surveillance cérébrale des patients présentant une addiction oncogénique doit être réalisée si possible par une IRM cérébrale avec injection de gadolinium plutôt qu'un scanner cérébral en raison du tropisme cérébral particulier des CBNPC avec addiction oncogénique et d'une plus grande sensibilité de l'IRM.
- La progression sous ITK en cas d'addiction oncogénique :
- doit faire réaliser une rebiopsie (tissu et/ou biopsie liquide) pour documenter des mécanismes de résistance histo-moléculaire (ADN/ARN tissulaire, ADN tumoral circulant) et permettre l'adaptation éventuelle de la stratégie de traitement ultérieur
- doit faire rechercher un défaut d'observance et/ou la présence d'une interaction médicamenteuse. Un dosage plasmatique de l'ITK peut être utile selon l'ITK (Cf. liste des centres) (Mueller-Schoell, 2021)
- si elle est lente et/ou peu symptomatique, autoriser la poursuite de l'ITK
- si elle est oligométastatique, la poursuite de l'ITK peut être discutée ainsi qu'un traitement local du ou des sites progresseur(s) en évitant si possible la radiothérapie cérébrale pan-encéphalique
- si elle est multifocale, changer le traitement systémique. Il sera adapté aux données de la rebiopsie. En l'absence de mécanisme de résistance ciblable, une chimiothérapie à base de sels de platine ± bévacizumab sans immunothérapie sera privilégiée. L'ITK ne sera alors arrêté que quelques jours avant le début de la nouvelle ligne de traitement afin d'éviter les phénomènes de rebond tumoral (effet "flare-up").
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
| Traitement | Délétion exon 19 et mutations L858R exon 21 de l'EGFR | Insertions exon 20 de l'EGFR | Autre mutation rare activatrice de l'EGFR |
| 1ère ligne |
|
|
|
| 2ème ligne | amivantamab + chimio (essai MARIPOSA, en AP) (Passaro, 2024) |
|
|
- En cas d’oligo-progression sous ITK, la poursuite de l'ITK peut être discutée en RCP après un traitement local du site témoin de la progression.
- L'immunothérapie seule ou en association n'est pas indiquée.
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
| Traitement | Options | |
| 1ère ligne |
alectinib*
ou brigatinib* (Camidge, 2020) ou lorlatinib (Shaw 2020)
|
crizotinib
ou ceritinib**** |
| lignes ultérieures |
alectinib, brigatinib, lorlatinib, ceritinib**
|
|
| Après ITK |
|
|
- En cas d’oligo-progression sous ITK, la poursuite de l'ITK peut être discutée en RCP après un traitement local du site témoin de la progression.
- L'immunothérapie seule ou en association n'est pas indiquée.
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
- Le traitement par crizotinib est recommandé (AMM mais non remboursé en première ligne, remboursement en deuxième ligne) (Avis HAS favorable au remboursement du 13 mai 2020).
- En deuxième ligne, une chimiothérapie à base de sels de platine + pémétrexed ± bévacizumab est recommandée.
- Le ceritinib, le lorlatinib ont une activité anti-ROS1 mais ne sont actuellement pas remboursés dans cette indication. Le repotrectinib a également un accès compassionnel.
- Le brigatinib a une activité anti-ROS in vitro et en phase II.
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
- Première ligne :
- un traitement par dabrafenib et trametinib a montré son efficacité mais n’a pas le remboursement.
- à défaut : chimiothérapie à base de sels de platine + pémétrexed ± bévacizumab. L'utilisation d'une immunothérapie sera préférée en troisième ligne (il y a un risque de surtoxicité sévère (syndrome d'activation macrophagique ou FAM) si association dabrafenib et trametinib donnée après l'immunothérapie).
- En deuxième ligne :
- un traitement par dabrafenib et trametinib est efficace (AMM et remboursement en situation avancée, en deuxième ligne et plus, après échec d'une première ligne de chimiothérapie et/ou immunothérapie) (Commission de transparence, 8 janvier 2020).
- alternative thérapeutique : chimiothérapie et/ou immunothérapie (taux de réponse à l'immunothérapie plus faible en cas de mutation V600E par rapport aux autres mutations de BRAF).
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
| Traitement | Mutation d'épissage de l'exon 14 cMET |
| 1ère ligne |
Chimiothérapie : sels de platine + pémétrexed
± bévacizumab ou essai thérapeutique
|
| 2ème ligne |
|
- L'immunothérapie sera préférée en troisième ligne (risque de surtoxicité si thérapie ciblée après l'immunothérapie).
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
- Le larotrectinib est disponible (AMM mais pas de remboursement chez l'adulte) (Drilon, 2020).
- Le selitrectinib est arrêté depuis le 02 aout 2021 mais il est disponible pour les patients dont le traitement a été initié en renouvellement de prescription en AAC.
- L’entrectinib dispose d’une AMM (européenne) sans remboursement (Drilon, 2020).
- A défaut ou pour les lignes ultérieures, une chimiothérapie doit être proposée.
- Une inclusion dans un essai clinique est à privilégier, quelle que soit la ligne de traitement.
- Si une anomalie moléculaire chez un patient non fumeur est suspectée, ne pas commencer d'immunothérapie dans la période d'attente des résultats de biologie moléculaire.
| Traitement | Réarrangement de RET |
| 1ère ligne |
selpercatinib (Drilon, 2020)
|
| 2ème ligne |
Chimiothérapie : sels de platine + pémétrexed ± bévacizumab
|
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
| Traitement | Mutations G12C de KRAS |
| 1ère ligne | Sels de platine +
pémétrexed ± pembrolizumab* ou chimiothérapie : sels de platine + pémétrexed ± bévacizumab |
|
2ème ligne et 3ème ligne
|
Adagrasib (AAP)
ou chimiothérapie ou immunothérapie si non reçue en 1ère ligne
|
- L'inclusion dans un essai clinique doit être privilégiée, quelle que soit la ligne de traitement.
- Hors essai clinique, le poziotinib pourrait être une option en accès compassionnel (Le, 2020) (poziotinib en accès précoce pour les mutations de HER2).
- Dans le but d'allonger la survie, l'objectif des consultations et des examens est de diagnostiquer une rechute ou un second cancer accessible à un traitement performant.
- Aucun consensus n'existe concernant les modalités et la fréquence de surveillance pour détecter une rechute ou un second cancer, que le patient ait été traité par chirurgie, chimiothérapie et/ou radiothérapie. Une surveillance annuelle par l'oncologue radiothérapeute est cependant obligatoire pendant 5 ans après la radiothérapie.
- L'arrêt du tabac est impératif (HAS, 2014 ; INCa, 2016).
- En complément, il est possible d'utiliser, des méthodes digitalisées d'aide à la surveillance.
- Pour les patients opérés :
- Une imagerie thoracique régulière doit être proposée par radiographie ou scanner.
L’utilité d’un scanner thoraco-abdominal injecté semestriel pendant les 2 premières années n’est pas démontrée. Un scanner thoracique annuel peut être proposé pour la détection des deuxièmes cancers, tout en tenant compte du risque lié à l’irradiation et à l’injection. - L'endoscopie bronchique de surveillance n’est pas recommandée en cas de résection complète.
- L'utilisation du TEP-TDM en systématique n'est pas recommandée pour la surveillance sous traitement et en post-traitement.
- Une imagerie thoracique régulière doit être proposée par radiographie ou scanner.

-
ABBV-399 : Étude ouverte de phase 2 sur l'innocuité et l'efficacité du télisotuzumab védotin (ABBV-399) chez des sujets atteints d'un cancer du poumon non à petites cellules (c-Met+) précédemment traité.
- Statut : Ouvert (10-10-2018 - 24-09-2025)
- Promoteur : AbbVie
-
MARIGOLD : Étude randomisée en double aveugle visant à comparer l’efficacité, la pharmacocinétique, la sécurité d’emploi et l’immunogénicité de l’ABP 234 à celles du Keytruda® (pembrolizumab) chez des patients atteints d’un cancer du poumon non à petites cellules non épidermoïde avancé ou métastatique
- Statut : Ouvert (09-09-2024 - 14-02-2028)
- Promoteur : Amgen
-
AcceleRET-Lung : Etude de phase III, randomisée et ouverte sur le pralsetinib par rapport au traitement standard en première ligne du cancer du poumon non à petites cellules métastatique avec fusion RET
- Statut : Ouvert (24-07-2020 - 31-12-2024)
- Promoteur : Hoffmann-La Roche
-
ADVENTIG-302 : Étude de phase 3 randomisée en double aveugle de BGBA1217, un anticorps antiTIGIT, en association au tislelizumab comparé au pembrolizumab chez des patients atteints d'un cancer du poumon non à petites cellules avancé, non résécable et métastatique non traité, sélectionné pour PD-L.
- Statut : Ouvert (18-11-2021 - 18-11-2022)
- Promoteur : BeiGene, Ltd.
-
AEGEAN : Etude internationale de phase III, en double aveugle, multicentrique, contrôlée versus placebo évaluant le durvalumab en traitement néoadjuvant / adjuvant chez des patients
atteints d’un cancer du poumon non à petites cellules de stade II et III résécable (AEGEAN)
- Statut : Ouvert (27-01-2022 - 30-04-2024)
- Promoteur : Astra Zeneca
-
APPLE : Faisabilité et activité du traitement par AZD9291 (osimertinib) sur T790M dans le plasma chez les patients atteints de CBNPC avec mutation de l'EGFR.
- Status : Ouvert (10-10-2017 - 28-02-2022)
- Promoteur : European Organisation for Research and Treatment of Cancer - EORTC
-
B-FAST : Etude multicentrique de phase II/III évaluant l’efficacité et la sécurité d’emploi de multiples thérapies ciblées chez des patients présentant un cancer du poumon non à petites cellules localement avancé ou métastatique, contenant des mutations somatiques actionnables détectées dans le sang (B-FAST : Blood-First Assay Screening Trial).
- Statut : Ouvert (22-09-2017 - 18-09-2021)
- Promoteur : Laboratoire ROCHE
-
BOEHRINGER BI 1443-0002 : Une étude visant à tester différentes doses de BI 836880 associé à l'ezabenlimab chez des patients atteints d'un cancer du poumon non à petites cellules avancé suivi d'autres types de tumeurs solides avancées
- Statut : Ouvert (03-05-2018 - 06-08-2024)
- Promoteur : Boehringer Ingelheim
-
Boehringer 1280.018 : Etude de phase Ib visant à évaluer la tolérance du xentuzumab et de l’abémaciclib chez des patients ayant une tumeur solide localement avancée ou métastatique ou une tumeur du sein HR+, HER2- localement avancée ou métastatique en association avec un traitement hormonal.
- Statut : Ouvert (04-05-2017 - 26-02-2022)
- Promoteur : Boehringer Ingelheim
-
Brigatinib-5007 : Etude observationnelle de cohorte visant à décrire la survenue d'événements pulmonaires d'apparition précoce chez les patients atteints d'un cancer du poumon non à petites cellules avancé présentant la kinase du lymphome anaplasique et traités par Brigatinib : une étude de sécurité d'emploi après autorisation
- Statut : Ouvert (01-11-2021 - 31-05-2026)
- Promoteur : Takeda
-
CA209-234 / NIVOPASS : Profil d’utilisation et d’innocuité/d’efficacité du nivolumab dans la pratique oncologique courante
- Statut : Ouvert (31-07-2016 - 31-03-2024)
- Promoteur : Bristol-Myers Squibb
-
CACZ885T2301 : étude de phase 3 comparant l’efficacité et la sécurité du canakinumab en adjuvant avec celle d’un placebo chez des patients ayant un cancer du poumon non à petites cellules de stade II-IIIA ou IIIB, complètement réséqué (R0).
- Status : Ouvert (16-03-2018 - 01-03-2022)
- Promoteur : Novartis Pharma
-
CARMEN-LC03 : Etude de phase 3, évaluant l’efficacité du SAR408701 par rapport au docétaxel, chez des patients précédemment traités, ayant un cancer bronchique non à petites cellules non épidermoïde métastasique, avec tumeurs CEACAM5 positives
- Statut : Ouvert (06-02-2020 - 17-02-2025)
- Promoteur : Sanofi
-
CC-90011-ST-001 : Etude de phase I visant à évaluer la sécurité d’emploi, la tolérance, la pharmacocinétique et l’efficacité du CC-90011 chez des patients ayant des tumeurs solides avancées ou des lymphomes non hodgkiniens.
- Statut : Ouvert (01-09-2016 - 24-03-2021)
- Promoteur : Celgene
-
CHECK'UP : Etude de cohorte visant à évaluer les facteurs prédictifs de réponse aux antagonistes de PD-1 ou PD-L1.
- Status : Ouvert (27-06-2018 - 01-12-2025)
- Promoteur : UNICANCER
-
CHRYSALIS / CR108064 : Etude de phase I évaluant une escalade de dose du JNJ-61186372, chez des patients ayant une cancer du poumon non à petites cellules avancé
- Statut : Ouvert (03-04-2019 - 30-03-2021)
- Promoteur : Janssen Research & Development
-
CINC280A2201 : Etude de phase II, évaluant l’efficacité et la tolérance du capmatinib (INC280), un inhibiteur de cMET, chez des patients ayant un cancer du poumon non à petites cellules avancé ou métastatique EGFR non muté.
- Statut : Clos aux inclusions (11-06-2015 - 10-05-2021)
- Promoteur : Novartis Pharma
-
COMBO / MS201781-0031 : Etude de phase Ib évaluant la sécurité, la tolérance et la pharmacocinétique de l’avélumab en association avec du NHS-IL12 chez des patients ayant des tumeurs solides localement avancées non résécables ou métastatiques.
- Status : Ouvert (10-07-2019 - 22-08-2022)
- Promoteur : Merck-Serono
-
DeLLphi-301 : Etude de phase 2 évaluant l'efficacité, l'innocuité, la tolérabilité et la pharmacocinétique du tarlatamab chez des sujets atteints d'un cancer du poumon à petites cellules récidivant ou réfractaire après deux lignes de traitement ou plus
- Statut : Ouvert (01-12-2021 - 29-11-2024)
- Promoteur : AMGEN
-
GCT1046-06 / ABBIL1TY NSCLC-06 : Étude de phase III, prospective, en ouvert et randomisée évaluant l’acasunlimab (GEN1046) en association avec le pembrolizumab par rapport au docétaxel chez des patients atteints d’un cancer du poumon non à petites cellules métastatique PD-L1 positif précédemment traités par un inhibiteur de PD-1/PD-L1 et une chimiothérapie à base de platine (ABBIL1TY NSCLC-06)
- Statut : Ouvert (25-11-2024 - 31-01-2027)
- Promoteur : Genmab
-
DESTINY-Lung04 : Une étude visant à étudier l'efficacité et l'innocuité du trastuzumab deruxtecan comme première option de traitement pour le cancer du poumon non à petites cellules non résécable, localement avancé/métastatique avec mutations HER2
- Statut : Ouvert (28-10-2021 - 01-03-2027)
- Promoteur : AstraZeneca
-
DICIPLE IFCT 1701 : Etude de phase III randomisée, comparant une continuation du doublet d’immunothérapie Nivolumab-Ipilimumab jusqu’à progression à une observation chez des patients naïfs de traitement présentant un Cancer Bronchique Non à Petites Cellules (CBNPC) PD-L1 positif après un traitement d’induction par Nivolumab-Ipilimumab
- Status : Ouvert (02-05-2018 - 02-05-2023)
- Promoteur : Intergroupe Francophone de Cancérologie Thoracique (IFCT)
-
DUART : Étude de phase 2 internationale, ouverte, multicentrique, évaluant le durvalumab après radiothérapie chez des patients atteints de cancer du poumon non à petites cellules non
résécable de stade III qui ne sont pas éligibles à la chimiothérapie (étude DUART)
- Statut : Ouvert (01-02-2022 - 30-06-2023)
- Promoteur : Astra Zeneca
-
EPITOP-01 : Etude de phase 4 évaluant la sécurité et la qualité de vie des patients âgés ayant un mélanome ou un cancer du poumon non à petites cellules localement avancé ou métastatique traité par immunothérapie
- Statut : Ouvert (09-08-2019 - 31-12-2022)
- Promoteur : Institut Paoli-Calmettes
-
ESME-AMLC : Programme de recherche en stratégie épidémiologique et médico-économique (ESME) / Plateforme académique de données du monde réel : Évolution de la prise en charge thérapeutique dans le cancer du poumon avancé ou métastatique en France depuis 2013.
- Statut : Ouvert (02-10-2017 - 31-12-2023)
- Promoteur : Unicancer
-
EVOKE-01 : Étude de phase 3 ouverte, globale, multicentrique, randomisée, du sacituzumab govitecan par rapport au docétaxel chez les patients atteints de cancer du poumon non à petites cellules (CPNPC) avancé ou métastatique ayant progressé pendant ou après une chimiothérapie à base de platine et une immunothérapie anti-PD-1/PD-L1.
- Statut : Ouvert (17-11-2021 - 31-05-2024)
- Promoteur : Galaad Sciences
-
EVOKE-02 : Étude en ouvert, multicentrique, de phase 2, évaluant les associations du sacituzumab govitécan pour le traitement de première ligne de patients atteints d'un cancer bronchique non à petites cellules (CBNPC) avancé ou métastatique sans altérations génomiques activables
- Statut : Ouvert (30-05-2022 - 28-02-2026)
- Promoteur : Gilead Sciences
-
EX2TRICAN : Etude évaluant la place de la stratégie d'analyse de l'exome dans l'identification de facteurs de prédisposition génétique dans les formes précoces de cancer
- Statut : Ouvert (22-10-2019 - 07-04-2026)
- Promoteur : Centre Georges François Leclerc
-
EXOMA : Etude exploratoire visant à évaluer l’impact d’une analyse du profil génétique par la technique « Next Generation sequencing » (NGS) à haut débit sur la décision thérapeutique chez des patients ayant une tumeur solide
- Statut : Ouvert (12-05-2016 - 26-06-2021)
- Promoteur : Centre Georges François Leclerc
-
GUIDE2REPAIR : Etude de phase II évaluant de l'efficacité d’une double immunothérapie par durvalumab et trémélimumab associée à un traitement par olaparib chez des patients ayant un cancer solide porteurs d’une mutation d’un gène de la recombinaison homologue, en réponse ou stables après 8 semaines de traitement par olaparib
- Status : Ouvert (06-07-2020 - 01-03-2023)
- Promoteur : Centre Georges François Leclerc
-
HYCUDES : Essai randomisé comparant l'apport de l'hypnose versus une prise en charge standard sur l'anxiété et la douleur des patients lors d'un désappareillage en curiethérapie
- Statut : Ouvert (02-11-2019 - 01-11-2021)
- Promoteur : Institut de Cancérologie de Lorraine
-
IFCT 1802 / SAVIMMUNE : Etude de phase II évaluant la tolérance et l'efficacité du durvalumab chez les patients ayant un Performance Status ECOG 2-3, naifs de traitement et présentant un Cancer Bronchique Non à petites Cellules (CBNPC) de stade IV exprimant fortement le PD-L1
- Statut : Ouvert (01-02-2020 - 31-01-2022)
- Promoteur : IFCT
-
IFCT-1805 ELDERLY : Etude de phase III randomisée, étudiant l’atezolizumab chez des patients âgés présentant un Cancer du Poumon Non à Petites Cellules de stade avancé et recevant une chimiothérapie par carboplatine mensuel et paclitaxel hebdomadaire
- Statut : Ouvert (07-12-2018 - 31-08-2022)
- Promoteur : Intergroupe Francophone de Cancérologie Thoracique (IFCT)
-
IFCT 1902 - ORAKLE : Etude de phase II non-randomisée, mono-bras, en ouvert, multicentrique évaluant l’efficacité et la tolérance du lorlatinib en monothérapie après échec en 1ère ligne de traitement d’un inhibiteur d’ALK de 2ème génération chez des patients présentant un Cancer Bronchique Non à Petites Cellules (CBNPC) de stade avancé ALK positif
- Status : Ouvert (03-06-2020 - 31-12-2021)
- Promoteur : Intergroupe Francophone de Cancérologie Thoracique (IFCT)
-
IFCT-1904 / ENCO-BRAF : Etude de phase II évaluant l’inhibiteur de BRAF encorafenib en combinaison avec l’inhibiteur de MEK binimetinib chez des patients atteints d’un cancer non à petites cellules présentant une mutation BRAF V600E
- Statut : Ouvert (19-01-2021 - 30-03-2025)
- Promoteur : INTERGROUPE FRANCOPHONE DE CANCEROLOGIE THORACIQUE
-
IFCT-2002 14-GENE : Essai prospectif randomisé de chimiothérapie adjuvante chez des patients présentant un Cancer Bronchique Non à Petites Cellules non-épidermoïde complétement réséqué de stade I ou IIA identifié comme étant à risque élevé ou intermédiaire par le test pronostique 14-Gene
- Statut : Ouvert (11-09-2020 - 15-05-2025)
- Promoteur : INTERGROUPE FRANCOPHONE DE CANCEROLOGIE THORACIQUE
-
IFCT-2003 / ALBATROS : Étude de phase II mono-bras, multicentrique évaluant l’efficacité et la tolérance du lorlatinib en monothérapie après échec en 1ère ligne de traitement d’un inhibiteur de tyrosine kinase chez des patients présentant un cancer bronchique non à petites cellules (CBNPC) de stade avancé ROS1-positif
- Statut : Ouvert (19-03-2021 - 30-12-2026)
- Promoteur : INTERGROUPE FRANCOPHONE DE CANCEROLOGIE THORACIQUE
-
IFCT 2101 MASTERPROTOCOL ALK : Étude de phase II randomisée, ouverte, multicentrique évaluant l’efficacité et la tolérance en 1ère ligne de traitement du brigatinib en combinaison avec carboplatine – pemetrexed ou du brigatinib en monothérapie chez des patients présentant un Cancer Bronchique Non à Petites Cellules (CBNPC) de stade avancé ALK positif.
- Statut : Ouvert (18-05-2022 - 31-10-2028)
- Promoteur : Intergroupe Francophone de Cancerologie Thoracique
-
IFCT-2102 Lung KG12Ci : Evaluation et suivi des patients porteurs d’un cancer pulmonaire non à petites cellules (CBNPC) métastatique muté KRAS G12C traité par sotorasib dans le cadre de l’ATU
- Statut : Ouvert (09-03-2022 - 01-05-2024)
- Promoteur : Intergroupe Francophone de Cancerologie Thoracique
-
IFCT-2103 DIAL : Essai de phase II-III randomisé, ouvert, évaluant une maintenance par pembrolizumab (± pemetrexed) jusqu’à progression versus observation (± pemetrexed) après 6 mois de traitement d’induction par chimiothérapie à base de platine + pembrolizumab chez des patients porteurs d’un Cancer Bronchique Non à Petites Cellules (CBNPC) de stade IV
- Statut : Ouvert (02-05-2022 - 30-06-2029)
- Promoteur : Intergroupe Francophone de Cancerologie Thoracique
-
IFCT-2105 LURBICLIN : Evaluation et suivi des patients porteurs d’un cancer pulmonaire à petites cellules (CPC) métastatique traité par lurbinectedin dans le cadre de l’ATU
- Statut : Ouvert (01-04-2022 - 31-12-2022)
- Promoteur : Intergroupe Francophone de Cancerologie Thoracique
-
i RTCT : Modulation des réponses des cellules T Anti-tumorales chez des patients atteints de cancer traités par radiochimiothérapie concomitante
- Statut : Ouvert (29-05-2017 - 31-08-2022)
- Promoteur : CHU Besançon
-
IMMUNO-REA : Caractéristique et prise en charge des patients atteints d'une tumeur solide traités par immunothérapie admis en réanimation
- Status : Ouvert (01-09-2018 - 30-09-2021)
- Promoteur : CHU de Grenoble
-
IMpower 030 : Etude de phase III, multicentrique, randomisée, en ouvert, comparant l'atézolizumab en association à la chimiothérapie adjuvante à base d'anthracycline/taxane versus chimiothérapie seule chez des patients atteints d'un cancer du poumon non à petites cellules (CPNPC)
- Status : Ouvert (24-04-2018 - 20-11-2024)
- Promoteur : Hoffmann-La Roche
-
Imreal : Etude observationnelle (pharmaco-épidémiologique) visant à décrire la tolérance d'atezolizumab en vie réelle chez des patients atteints de cancer bronchique non à petites cellules (CBNPC)
- Status : Ouvert (13-11-2019 - 02-06-2025)
- Promoteur : Hoffman-La Roche
-
IPPEM : Association entre les inhibiteurs de la pompe à protons et la toxicité hématologique du pemetrexed
- Status : Ouvert (02-05-2018 - 02-11-2020)
- Promoteur : CHU de Reims
-
ITHER : Etude visant à évaluer l’intérêt de la réponse immune anti-télomérase des lymphocytes auxiliaires T CD4+ comme marqueur prédictif de l’efficacité des immunothérapies ciblant PD-1/PD-L1
- Status : Ouvert (01-07-2016 - 22-06-2021)
- Promoteur : Centre Hospitalier Universitaire de Besançon
-
KBP ESCAPE 2020 : Recueil des nouveaux cas de cancer bronchique primitif diagnostiqués dans les CH généraux en 2020
- Status : Ouvert (01-01-2020 - 01-01-2026)
- Promoteur : Collège des Pneumologues des Hôpitaux Généraux
-
KEYLYNK-007 / MK-7339-007 : Étude de phase II sur l’olaparib (MK-7339) en association avec le pembrolizumab (MK-3475) pour le traitement de patients atteints d’un cancer de stade avancé présentant une mutation des gènes de réparation par recombinaison homologue (RRH) ou un déficit de recombinaison homologue (DRH)
- Status : Ouvert (18-11-2019 - 11-12-2023)
- Promoteur : Merck Sharp & Dohme
-
KEYNOTE 3475-789 : Etude de phase III évaluant l'efficacité et la sécurité du pémétrexed associé à une chimiothérapie à base de sel de platine et associé à du pembrolizumab ou non chez des patients ayant un cancer du poumon non à petites cellules métastasique avec une mutation de type EGFR résistant à un inhibiteur de la tyrosine kinase.
- Status : Ouvert (11-10-2018 - 11-10-2023)
- Promoteur : Merck Sharp & Dohme (MSD)
-
KRYSTAL-12 : Étude de phase 3 du MRTX849 (adagrasib) contre le docétaxel chez des patients atteints d'un cancer du poumon non à petites cellules avancé avec mutation KRAS G12C (KRYSTAL-12)
- Statut : Ouvert (29-01-2021 - 30-08-2023)
- Promoteur : MIRATI Therapeutics Inc.
-
LIBELULE : Étude de phase III, randomisée, évaluant la faisabilité et la pertinence clinique de la biopsie liquide chez les patients avec suspicion de cancer du poumon métastatique - LIquid Biopsy for the Early detection of LUng cancer LEsion
- Statut : Ouvert (10-04-2019 - 01-07-2021)
- Promoteur : Centre Léon Bérard
-
LIST : Etude multicentrique , longitudinale, prospective, observationnelle et multi-cohortes de patients atteints d'un cancer du poumon non à petites cellules avancé traités par nivolumab en France après au moins un traitement antérieur par chimiothérapie ( LIST , Lung Initiative on Sequence Therapy)
- Statut : Ouvert (28-09-2020 - 15-09-2025)
- Promoteur : BRISTOL MYERS SQUIBB
-
LUNGART - CSET2006/1202 : Essai de phase III comparant une radiothérapie médiastinale conformationnelle post-opératoire en l'absence de radiothérapie après chirurgie complète chez des patients présentant un carcinome bronchique non à petites cellules (CBNPC) avec envahissement médiastinal N2.
- Statut : Ouvert (20-02-2009 - 20-02-2022)
- Promoteur : Institut de Cancérologie Gustave Roussy
-
MARIPOSA2 : Etude de phase 3, ouverte et randomisée de l'amivantamab et du lazertinib en association avec une chimiothérapie à base de platine par rapport à une chimiothérapie à base de platine chez des patients atteints d'un cancer du poumon non à petites cellules localement avancé ou métastatique muté par l'EGFR après échec de l'osimertinib
- Statut : Ouvert (17-11-2021 - 17-11-2025)
- Promoteur : Janssen Research & Development
-
MK2870-023 : Etude de phase 3, évaluant le pembrolizumab en association avec une chimiothérapie à base de carboplatine/taxane prolongée par une maintenance du pembrolizumab avec ou sans MK-2870 dans le traitement de première ligne du cancer du poumon épidermoïde non à petites cellules métastatiques
- Statut : Ouvert (10-06-2024 - 12-01-2029)
- Promoteur : MSD
-
MK 7339 006 / KEYLYNK-006 : Etude de phase III évaluant l'association du pembrolizumab avec le pemetrexed et un sel de platine (carboplatine ou cisplatine), suivie d'une phase de maintenance par pembrolizumab et olaparib versus pembrolizumab et pemetrexed en traitement de première ligne chez des patients présentant un cancer du poumon métastatique non à petites cellules non épidermoide
- Status : Ouvert (28-06-2019 - 13-08-2024)
- Promoteur : Merck Sharp & Dohme Corp
-
MK 7339 008 / KEYLYNK-008 : Etude de phase III évaluant le pembrolizumab en association avec du carboplatine/taxane (paclitaxel ou nab-paclitaxel) suivi par du pembrolizumab avec ou sans traitement de maintenance par de l'olaparib, en première ligne de traitement, chez des patients présentant un cancer du poumon non à petites cellules, épidermoide et à un stade métastatique
- Status : Ouvert (28-06-2019 - 06-05-2024)
- Promoteur : Merck Sharp & Dohme
-
MO40653 : étude portant sur les résultats et la sécurité de l'Atezolizumab en conditions réelles d'utilisation
- Status : Ouvert (07-02-2019 - 18-01-2024)
- Promoteur : Hoffmann-La Roche
-
MORPHEUS Lung : Etude de phase 1b/2 randomisée évaluant l’efficacité et la sécurité d’immunothérapies en traitement combiné chez des patients ayant un cancer du poumon non à petites cellules métastatique
- Statut : Ouvert (02-01-2018 - 01-08-2025)
- Promoteur : Hoffmann-La Roche
-
MS200647-0024 : Etude de phase Ib-II randomisée évaluant la sécurité et l’efficacité du M7824 associé à une chimiothérapie chez des patients ayant un cancer bronchique non à petites cellules de stade 4
- Statut : Ouvert (11-07-2019 - 28-10-2021)
- Promoteur : Merck-Serono
-
NIRVANA-poumon : Etude de phase III randomisée évaluant l’efficacité du nivolumab associé à une radiothérapie sur divers sites tumoraux chez des patients ayant un carcinome des poumons non à petites cellules de stade avancé.
- Status : Ouvert (15-01-2019 - 15-05-2022)
- Promoteur : UNICANCER
-
NSCLC : Etude de phase 2, randomisé, évaluant l’efficacité et la tolérance d’un traitement associant le relatlimab, le nivolumab et une chimiothérapie par rapport au nivolumab seul associé à une chimiothérapie, comme traitement de 1ère intention, chez des patients atteints d’un cancer du poumon non à petites cellules (CPNPC) de stade IV ou récidivant
- Statut : Ouvert (17-02-2021 - 23-09-2024)
- Promoteur : Bristol-Myers Squibb
-
Optim-UCPVax : Évaluation de l'UCPVax Plus Nivolumab comme traitement de deuxième ligne dans le cancer du poumon non à petites cellules avancé
- Statut : Ouvert (09-09-2020 - 30-09-2025)
- Promoteur : Centre Hospitalier Universitaire de Besancon
-
PACIFIC-4 / RTOG-3515 : Étude de phase III portant sur le durvalumab à la suite d’une radiothérapie stéréotaxique corporelle pour le traitement des patients atteints d’un cancer du poumon non à petites cellules de stade I/II non réséqué sans envahissement ganglionnaire lymphatique
- Status : Ouvert (02-12-2019 - 28-06-2024)
- Promoteur : AstraZeneca
-
PACIFIC-8 : Étude internationale de phase III, randomisée, en double aveugle, contrôlée par placebo, multicentrique, de Durvalumab plus Domvanalimab(AB154) chez des participants atteints d'un cancer du poumon non à petites cellules localement avancé (stade III), non résécable et dont la maladie n'a pas progressé après une chimioradiothérapie concomitante définitive à base de sels de platine.
- Statut : Ouvert (18-02-2022 - 27-06-2028)
- Promoteur : AstraZeneca
-
PAPILLON : Etude de phase 3, randomisée comparant un traitement associant l’amivantamab, le carboplatine et le pémétrexed par rapport à l’association du carboplatine-pémétrexed seuls, chez des patients présentant un cancer du poumon non à petites cellules avec une mutation EGFR Exon 20ins localement avancé ou métastasique.
- Statut : Ouvert (13-10-2020 - 31-01-2025)
- Promoteur : Janssen Research & Development, LLC
-
PERSEE : Essai de phase III randomisé, ouvert et contrôlé comparant l'association de chimiothérapie à base de pembrolizumab-platine et de pembrolizumab en monothérapie dans le traitement de première intention des cancers du poumon non à petites cellules (CPNPC) avec une expression PDL1 ≥50%
- Statut : Ouvert (22-12-2020 - 22-12-2025)
- Promoteur : CHU Brest
-
PEVOsq : Etude basket de phase 2 évaluant l’efficacité de la combinaison de pembrolizumab et de vorinostat chez des patients atteints d’un cancer
- Statut : Ouvert (28-10-2020 - 31-10-2024)
- Promoteur : UNICANCER
-
PNEUMOFRAC : Étude de phase I/II de diminution de l’étalement de l’irradiation en conditions stéréotaxiques des tumeurs broncho-pulmonaires primitives de stade IA – IB (T1NOMO ou T2aNOMO) non opérées
- Statut : Ouvert (24-11-2015 - 31-12-2021)
- Promoteur : ICANS
-
POSITHES : Etude non-interventionnelle, multicentrique, longitudinale et transversale, chez des patients atteints de cancer bronchique non à petites cellules métastatique ou localement avancé, présentant une mutation activatrice de l’EGFR, en France.
- Statut : Ouvert (12-05-2021 - 15-01-2026)
- Promoteur : AstraZeneca
-
SUNRAY-01 : Une étude pivot mondiale menée auprès de participants atteints d'un cancer du poumon non à petites cellules localement avancé ou métastatique et mutant pour le gène KRAS G12C, comparant le traitement de première intention par LY3537982 et pembrolizumab vs placebo et pembrolizumab chez ceux dont l'expression de PD-L1 est ≥50 % ou au LY3537982 et au pembrolizumab, Pemetrexed, Platinum vs Placebo et Pembrolizumab, Pemetrexed, Platinum Indépendamment de l'expression de PD-L1
- Statut : Ouvert (21-12-2023 - 31-10-2026)
- Promoteur : Eli Lilly and Company
-
PRISM : Etude de cohorte évaluant la prise en charge après traitement anti-résorption osseuse injectable et son influence sur la qualité de vie chez des patients ayant des métastases osseuses
- Statut : Ouvert (30-05-2016 - 30-05-2022)
- Promoteur : Centre Hospitalier Universitaire de Besançon
-
PROTECT-01 : Évolution de la condition physique des patients traités pour un cancer
- Statut : Ouvert (17-09-2019 - 01-06-2021)
- Promoteur : ICANS
-
QUARTIER : Suivi moléculaire de l'ADNc par ddPCR dans le cancer du poumon non à petites cellules traité par immunothérapie.
- Statut : Ouvert (27-05-2021 - 27-05-2023)
- Promoteur : Hopitaux universitaires de Strasbourg
-
REGENERON - REGN5093 : Etude de phase 1-2, évaluant la sécurité, la tolérance et l’efficacité de REGN5093, chez des patients ayant un cancer bronchique non à petites cellules avec altération du gène MET, notamment des mutations du gène MET sur l’exon 14, une amplification du gène MET ou des taux élevés de protéine MET
- Statut : Ouvert (07-01-2020 - 20-10-2024)
- Promoteur : Regeneron Pharmaceuticals
-
SAPPHIRE : Étude de phase 3 de Sitravatinib Plus Nivolumab vs Docetaxel chez des patients atteints d'un cancer du poumon non épidermoïde non à petites cellules avancé ( SAPPHIRE )
- Statut : Ouvert (15-07-2019 - 30-07-2023)
- Promoteur : MIRATI Therapeutics Inc.
-
SAVANNAH / D5084C00007 : Etude de phase II, évaluant une traitement associant l'osimertinib et le savolitinib après un premier traitement par osimertinib, chez des patients ayant un cancer du poumon non à petites cellules, EGFRm+/MET+
- Statut : Ouvert (08-01-2020 - 24-08-2021)
- Promoteur : AstraZeneca
-
SKYSCRAPER-03 : Une étude de l’atezolizumab et du tiragolumab comparée au durvalumab chez des participants atteints d’un cancer du poumon non à petites cellules (CPNPC) de stade III localement avancé et non résécable (SKYSCRAPER-03)
- Statut : Ouvert (14-08-2020 - 30-08-2024)
- Promoteur : Hoffmann-La Roche
-
SKYSCRAPER-06 : Une étude de phase II/III, randomisée, en double aveugle, contrôlée par placebo, du tiragolumab en association avec l'atezolizumab plus pemetrexed et carboplatine/cisplatine par rapport au pembrolizumab plus pemetrexed et carboplatine/cisplatine chez des patients atteints d'un cancer du poumon non à petites cellules avancé et précédemment non traité.
- Statut : Ouvert (14-12-2020 - 14-05-2027)
- Promoteur : Hoffmann-La Roche
- STELLAR-001 : Etude de phase I évaluant l'innocuité, la tolérance et l'activité antitumorale du IPH5401 associé à du durvalumab chez des patients adultes ayant des tumeurs solides avancées sélectionnées
-
STEREO-OS : Essai de phase III évaluant l'ajout d'une radiothérapie Stéréotaxique (SBRT) en complément du traitement standard chez les patients atteints d'une tumeur solide (cancer du sein, de la prostate et du poumon) avec entre 1 à 3 métastases osseuses
- Statut : Ouvert (01-01-2018 - 24-01-2026)
- Promoteur : UNICANCER
-
THASSOS-INTL : Étude en situation réelle des données relatives au cancer broncho-pulmonaire non à petites cellules (CBNPC) au stade précoce (stade I, II ou III) : prévalence des mutations de l’EGFR, traitement et résultats
- Statut : Ouvert (03-11-2021 - 31-10-2022)
- Promoteur : AstraZeneca
-
Telocap02 : Étude de l'immunité anti-télomérase T CD4 dans le cancer du poumon métastatique
- Statut : Ouvert (01-12-2015 - 30-06-2021)
- Promoteur : CHRU Besançon
-
TROPION-LUNG01 : Étude randomisée de phase 3 sur le DS-1062a par rapport au docétaxel dans les cas de cancer du poumon non à petites cellules avancé ou métastatique précédemment traités.
- Statut : Ouvert (21-12-2020 - 27-06-2024)
- Promoteur : AstraZeneca
-
TusaRav-QT : Effet du tusamitamab ravtansine sur l'intervalle QTc chez les participants atteints de tumeurs solides métastatiques
- Statut : Ouvert (03-10-2022 - 03-12-2024)
- Promoteur : Sanofi
-
UCPVax : Etude de phase 1-2, évaluant l’efficacité et la tolérance d’un vaccin thérapeutique anti-cancer appelé vaccin universel anticancer (UCPVax), utilisant des peptides dérivés de la télomérase, chez des patients ayant un cancer bronchique non à petites cellules (CBNPC) métastatique.
- Status : Ouvert (20-04-2016 - 15-01-2021)
- Promoteur : CHRU de Besançon
-
WU-KONG1 : Évaluation d'un inhibiteur oral de l'EGFR, DZD9008, chez des patients atteints d'un cancer du poumon non à petites cellules avancé avec mutation de l'EGFR ou de HER2
- Statut : Ouvert (09-07-2019 - 31-03-2023)
- Promoteur : Dizal Pharmaceuticals
-
ZEAL 1 (GSK 213400) : Une étude de phase 3, randomisée, en double aveugle, contrôlée par placebo et multicentrique comparant le niraparib plus le pembrolizumab au placebo plus le pembrolizumab comme traitement d'entretien chez les participants dont la maladie est restée stable ou qui ont répondu à la chimiothérapie de première ligne à base de platine avec le pembrolizumab pour le stade IIIB ou IV Cancer du poumon non à petites cellules
- Statut : Ouvert (26-10-2020 - 28-10-2024)
- Promoteur : GSK
| TX | Tumeur primaire non connue ou tumeur prouvée par la présence de cellules malignes dans les sécrétions broncho-pulmonaires mais non visible aux examens radiologiques et endoscopiques |
| T0 | Absence de tumeur identifiable |
| Tis | Carcinome in situ |
| T1 | Tumeur ≤ 3 cm dans sa plus grande dimension, entourée par du poumon ou de la plèvre viscérale, sans évidence bronchoscopique d'invasion de la bronche souche |
| T1a(mi) | Adénocarcinome minimalement invasif |
| T1a | Tumeur ≤ 1 cm |
| T1b | Tumeur >1 cm et ≤ 2 cm |
| T1c | Tumeur >2 cm et ≤ 3 cm |
| T2 | Tumeur >3 cm et ≤ 5 cm dans sa plus grande dimension et présentant une des caractéristiques suivantes : - envahissement d'une bronche souche quelle que soit sa distance par rapport à la carène mais sans envahissement de la carène - envahissement de la plèvre viscérale - présence d'une atélectasie ou d'une pneumopathie obstructive s'étendant à la région hilaire ((sub)lobaire ou pulmonaire) |
| T2a | Tumeur >3 cm et ≤ 4 cm dans sa plus grande dimension |
| T2b | Tumeur >4 cm et ≤ 5 cm dans sa plus grande dimension |
| T3 | Tumeur >5 cm et ≤ 7 cm ou associée à un(des) nodule(s) tumoral(aux) distinct(s) et dans le même lobe, ou ayant au moins un des caractères invasifs suivants : - atteinte de la paroi thoracique (y compris tumeur de Pancoast) - atteinte du nerf phrénique - atteinte de la plèvre pariétale ou du péricarde |
| T4 |
Tumeur >7 cm ou associée à un(des) nodule(s) pulmonaire(s) distinct(s) dans deux lobes différents du même poumon,
comportant un envahissement quelconque parmi les structures suivantes : médiastin, cœur, ou gros vaisseaux, trachée, diaphragme, nerf récurrent, œsophage, corps vertébraux, carène
|
| Nx | Envahissement locorégional inconnu |
| N0 | Absence de métastase dans les ganglions lymphatiques régionaux |
| N1 | Métastases ganglionnaires péri-bronchiques homolatérales et/ou hilaires homolatérales incluant une extension directe |
| N2 | Métastases dans les ganglions médiastinaux homolatéraux ou dans les ganglions sous-carénaires |
| N3 | Métastases ganglionnaires médiastinales controlatérales ou hilaires controlatérales ou scalènes, sus-claviculaires homo- ou controlatérales |
| Mx | La présence de métastase(s) à distance ne peut être évaluée |
| M0 | Absence de métastase à distance |
| M1 | Présence de métastase(s) à distance : |
| M1a | Nodules tumoraux séparés dans un lobe controlatéral ou nodules pleuraux ou pleurésie maligne ou péricardite maligne |
| M1b | 1 seule métastase dans un seul site métastatique |
| M1c | Plusieurs métastases dans un seul site ou plusieurs sites atteints |
| Stade | T | N | M |
| Cancer occulte | Tx | N0 | M0 |
| Stade 0 | Tis | N0 | M0 |
| Stade IA1 | T1a(mi) | N0 | M0 |
| T1a | N0 | M0 | |
| Stade IA2 | T1b | N0 | M0 |
| Stade IA3 | T1c | N0 | M0 |
| Stade IB | T2a | N0 | M0 |
| Stade IIA | T2b | N0 | M0 |
| Stade IIB | T1 | N1 | M0 |
| T2 | N1 | M0 | |
| T3 | N0 | M0 | |
| Stade IIIA | T1 | N2 | M0 |
| T2 | N2 | M0 | |
| T3 | N1 | M0 | |
| T4 | N0 | M0 | |
| T4 | N1 | M0 | |
| Stade IIIB | T1 | N3 | M0 |
| T2 | N3 | M0 | |
| T3 | N2 | M0 | |
| T4 | N2 | M0 | |
| Stade IIIC | T3 | N3 | M0 |
| T4 | N3 | M0 | |
| Stade IVA | - | - | Tout M1a |
| - | - | Tout M1b | |
| Stade IVB | - | - | Tout M1c |
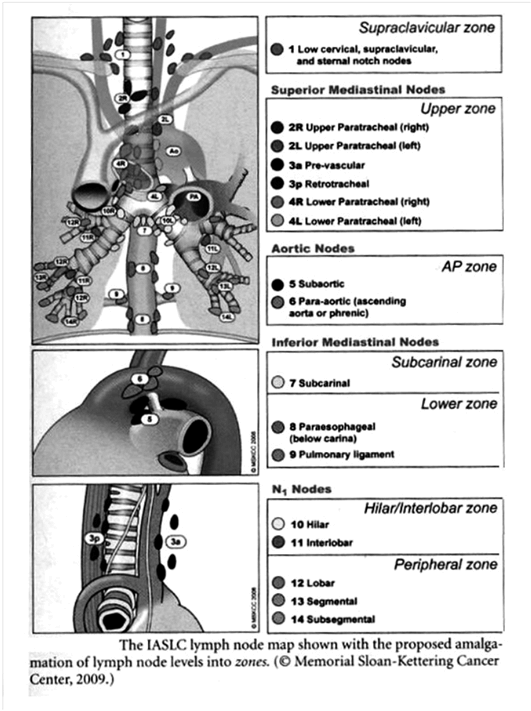
- Cliquer pour télécharger la cartographie ganglionnaire.
- Gustave Roussy/Cancer campus
- CHU de Nantes
- Assistance Publique - Hôpitaux de Paris
- CHU de Besançon
- Hospices Civils de Lyon
- CHU de Bordeaux
- CHU de Nîmes
- CHU de Grenoble
- Centre Antoine Lacassagne de Nice
- Assistance Publique - Hôpitaux de Marseille
- Institut Universitaire du Cancer de Toulouse.
- Allen JW, Farooq A, O'Brien TF, Osarogiagbon RU.
Quality of surgical resection for nonsmall cell lung cancer in a US metropolitan area.
- Aristote Référentiel
CBNPC : Stades cliniques IA à IIIA résécables, patient opérable, EGFR WT
2023
- Berghoff AS, Bellosillo B, Caux C, et al.
Immune checkpoint inhibitor treatment in patients with oncogene- addicted non-small cell lung cancer (NSCLC) : summary of a multidisciplinary round-table discussion.
- Besse B, Adjei A, Baas P et al.
2nd ESMO Consensus Conference on Lung Cancer: non-small-cell lung cancer first-line/second and further lines of treatment in advanced disease.
Ann Oncol. 2014 ; 25 : 1475-84.
- Bousema JE, Dijkgraaf MGW, van der Heijden EHFM, et al.
Endosonography With or Without Confirmatory Mediastinoscopy for Resectable Lung Cancer : A Randomized Clinical Trial.
- Brambilla E, Lantuejoul S.
New classification of pulmonary cancer: application to small size biopsy sampling.
Ann Pathol. 2010 ; 30 : 60-3. - Brunelli A, Charloux A, Bolliger CT, et al.
ERS/ESTS clinical guidelines on fitness for radical therapy in lung cancer patients (surgery and chemo-radiotherapy).
Eur Respir J. 2009 ; 34 : 17-41.
- Brunelli A, Kim AW, Berger KI, Addrizzo-Harris DJ.
Physiologic evaluation of the patient with lung cancer being considered for resectional surgery: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines.
Chest. 2013 ; 143(5s) : e166S-90S.
- Brunelli A, Varela G, Salati M, et al.
Recalibration of the revised cardiac risk index in lung resection candidates.
Ann Thorac Surg. 2010 ; 90 : 199‑203.
- Brunelli A, Decaluwe H, Gonzalez M, Gossot D, Petersen RH, Augustin F, et al.
European Society of Thoracic Surgeons expert consensus recommendations on technical standards of segmentectomy for primary lung cancer.
European Journal of Cardio-Thoracic Surgery. 1 juin 2023;63(6):ezad224.
- Camidge DR, Kim HR, Ahn MJ, et al.
Brigatinib Versus Crizotinib in Advanced ALK Inhibitor-Naive ALK-Positive Non-Small Cell Lung Cancer: Second Interim Analysis of the Phase III ALTA-1L Trial.
J Clin Oncol. 2020 ; 38 : 3592-3603.
- Cancer du poumon, Bilan initial.
Collection Recommandations et référentiels, ouvrage collectif édité par l’INCa, Boulogne-Billancourt, juin 2011
Cancer du poumon, bilan initial.
- Cortot AB, Audigier-Valette C, Molinier O, et al.
Weekly paclitaxel plus bevacizumab versus docetaxel as second- or third-line treatment in advanced non-squamous non-small-cell lung cancer : Results of the IFCT-1103 ULTIMATE study.
- De Leyn P, Dooms C, Kuzdzal J et al.
Revised ESTS guidelines for pre-operative mediastinal lymph node staging for non-small cell lung cancer.
Eur J Cardiothorac Surg 2014 ; 45 : 787-798. - Dietel M, Bubendorf L, Dingemans A-MC, et al.
Diagnostic procedures for non-small-cell lung cancer (NSCLC) : recommendations of the European Expert Group.
Thorax. 2016 ; 71 : 177-84.
- Drilon A, Oxnard GR, Tan DSW, et al.
Efficacy of Selpercatinib in RET Fusion-Positive Non-Small-Cell Lung Cancer.
N Engl J Med. 2020 ; 383 : 813-824.
- Drilon A, Moreno V, Patel J, et al.
1289P Efficacy and safety of larotrectinib in patients with tropomyosin receptor kinase (TRK) fusion lung cancer
Ann Oncol. 2020 ; 31 : S834.
- Eberhardt WEE, Mitchell A, Crowley J, et al. The IASLC Lung Cancer Staging Project :
Proposals for the Revision of the M Descriptors in the Forthcoming Eighth Edition of the TNM Classification of Lung Cancer.
J Thorac Oncol. 2015 ; 10 : 1515-22. - Forde PM, Spicer J, Lu S, et al.
Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer.
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al ; KEYNOTE-189 Investigators.
Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer.
N Engl J Med. 2018 ; 378 : 2078-2092.
- Garassino MC, Mazieres J, Reck M et al.
Durvalumab Aft er Sequenti al Chemoradiotherapy in Stage III, UnresectableNSCLC: The Phase 2 PACIFIC-6 Trial.
J Thorac Oncol. 2022 Dec;17(12):1415-1427.
- Garelli E, Renaud S, Falcoz PE, et al.
Microscopic N2 disease exhibits a better prognosis in resected non-small-cell lung cancer.
Eur J Cardiothorac Surg. 2016 ; 50 : 322-8.
- Gettinger S, Politi K.
PD-1 Axis Inhibitors in EGFR- and ALK-Driven Lung Cancer : Lost Cause ?
- Goldstraw P, Chansky K, Crowley J, at al.
The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer.
J Thorac Oncol. 2016 ; 11 : 39-51
- Kaster TS, Yaremko B, Palma DA, Rodrigues GB.
Radical-intent hypofractionated radiotherapy for locally advanced non-small-cell lung cancer: a systematic review of the literature.
Clin Lung Cancer. 2015 ; 16 : 71-9. - Kenmotsu H, Yamamoto N, Yamanaka T, et al.
Randomized phase III study of pemetrexed/cisplatin (Pem/Cis) versus vinorelbine /cisplatin (Vnr/Cis) for completely resected stage II-IIIA non-squamous non-small-cell lung cancer (Ns-NSCLC): The JIPANG study
J Clin Oncol. 2019 ; 37 : issue 15 suppl - Kerr KM, Bubendorf L, Edelman MJ, et al.
Second ESMO consensus conference on lung cancer: pathology and molecular biomarkers for non-small-cell lung cancer.
Ann Oncol. 2014 ; 25 : 1681-90.
- Khalifa J, Lerouge D, Le Péchoux C, et al.
Radiotherapy for primary lung cancer.
- Khalife N, Kordahi M, Felefly T, Saleh K.
Cemiplimab: a new option for the treatment of non-small-cell lung cancer.
Future Oncol. 2021 Jul;17(20):2559-2562.
- Le X, Goldman JW, Clarke JM, et al.
Poziotinib shows activity and durability of responses in subgroups of previously treated EGFR exon 20 NSCLC patients.
J Clin Oncol. 2020 ; 15 : 9514.
- Le Pechoux C, Pourel N, Barlesi F, et al.
Postoperative radiotherapy versus no postoperative radiotherapy in patients with completely resected non-small-cell lung cancer and proven mediastinal N2 involvement (Lung ART) : an open-label, randomised, phase 3 trial.
-
Masahiro Tsuboi et al.Overall Survival with Osimertinib in Resected EGFR-Mutated NSCLC.
- Mazieres J, Drilon A, Lusque A, et al.
Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations : results from the IMMUNOTARGET registry.
- Médicaments ciblant ALK : crizotinib, céritinib.
Collection Recommandations et référentiels, ouvrage collectif édité par l’INCa, Boulogne-Billancourt, avril 2016.
Médicaments ciblant ALK : crizotinib, céritinib - Médicaments ciblant l'EGFR : erlotinib, géfitinib, afatinib.
Collection Recommandations et référentiels, ouvrage collectif édité par l’INCa, Boulogne-Billancourt, avril 2016.
Médicaments ciblant l'EGFR : erlotinib, géfitinib, afatinib
- Mueller-Schoell A, Groenland SL, Scherf-Clavel O, et al.
Therapeutic drug monitoring of oral targeted antineoplastic drugs.
-
Olivier T, Prasad V.Neoadjuvant checkpoint inhibition in non-small cell lung cancer : Is earlier unquestionably better than later ?
- Passaro A, Wang J, Wang Y, Lee SH, Melosky B, Shih JY, et al.
Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study.
Ann Oncol. janv 2024;35(1):77‑90.
- Patients atteints d'un cancer bronchique non à petites cellules : Indications des tests moléculaires en vue de la prescription de traitements de précision
INCa, 2023
-
Paz-Ares L, Luft A, Vicente D, et al ; KEYNOTE-407 Investigators.
Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer.
N Engl J Med. 2018 ; 379 : 2040-2051. -
Pignon JP, Tribodet H, Scagliotti GV, et al.
Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group.
J Clin Oncol. 2008 ; 26 : 3552-3559.
- Planchard D, Popat S, Kerr K, et al. ; ESMO Guidelines Committee.
Metastatic non-small cell lung cancer : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up.
- Planchard D, Jänne PA, Cheng Y, Yang JCH, Yanagitani N, Kim SW, et al.
Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLC.
N Engl J Med. 23 nov 2023;389(21):1935‑48.
- Quoix E, Zalcman G, Oster JP, et al ; Intergroupe Francophone de Cancérologie Thoracique.
Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer: IFCT-0501 randomised, phase 3 trial.
Lancet. 2011 ; 378 : 1079-1088.
- Ramalingam SS, Vansteenkiste J, Planchard D, et al.
Overall Survival with Osimertinib in Untreated, EGFR-Mutated Advanced NSCLC
N Eng J Med. 2020 ; 382 : 41-50.
- Rami-Porta R, Wittekind C, Goldstraw P.
Complete Resection in Lung Cancer Surgery : From Definition to Validation and Beyond.
- Rami-Porta R, Call S, Dooms C, et al.
Lung cancer staging: a concise update.
Eur Respir J. 2018 ; 51: 1800190.
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. KEYNOTE-024 Investigators.
Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer.
N Engl J Med. 2016 ; 375 : 1823-1833. - Riquet M, Legras A, Mordant P, et al.
Number of mediastinal lymph nodes in non-small cell lung cancer: a Gaussian curve, not a prognostic factor.
Ann Thorac Surg. 2014 ; 98 : 224-231.
- Saji H, Okada M, Tsuboi M, et al.
Segmentectomy versus lobectomy in small-sized peripheral non-small-cell lung cancer (JCOG0802/WJOG4607L) : a multicentre, open-label, phase 3, randomised, controlled, non-inferiority trial.
- Schoenfeld AJ, Arbour KC, Rizvi H, et al.
Severe immune-related adverse events are common with sequential PD-(L)1 blockade and osimertinib.
- Scott WJ, Howington J, Feigenberg S, et al. ; American College of Chest Physicians.
Treatment of non-small cell lung cancer stage I and stage II : ACCP evidence-based clinical practice guidelines (2nd édition).
- Senan S.
Treatment of Stage IIIA Non-Small-Cell Lung Cancer: Charting the Next Steps.
J Oncol Pract. 2016 ; 12 : 609-610.
- Shaw AT, Bauer TM, de Marinis F, et al.
First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer.
-
Silvestri GA, Gonzalez AV, Jantz MA, et al.Methods for staging non-small cell lung cancer : Diagnosis and management of lung cancer, 3rd ed : American College of Chest Physicians evidence-based clinical practice guidelines.
- Socinski MA, Jotte RM, Cappuzzo F, et al. ; IMpower150 Study Group.
Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC.
N Engl J Med. 2018 ; 378 : 2288-2301.
- Solomon BJ, Ahn JS, Dziadziuszko R, Barlesi F, Nishio M, Lee DH, et al.
LBA2 ALINA: Efficacy and safety of adjuvant alectinib versus chemotherapy in patients with early-stage ALK+ non-small cell lung cancer (NSCLC).
Annals of Oncology. 1 oct 2023;34:S1295‑6.
- Spigel DR, Faivre-Finn C, Gray JE, et al.
Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer.
- Spigel DR, Reynolds C, Waterhouse D, Garon EB, Chandler J, Babu S, et al.
Phase 1/2 Study of the Safety and Tolerability of Nivolumab Plus Crizotinib for the First-Line Treatment of Anaplastic Lymphoma Kinase Translocation - Positive Advanced Non-Small Cell Lung Cancer (CheckMate 370).
J Thorac Oncol. mai 2018;13(5):682‑8.
- Thomas P, Dahan M, Riquet M et al.
Pratiques chirurgicales dans le traitement du cancer primitif non à petites cellules du poumon : recommandations de la SFCTCV.
Rev Mal Respir. 2008 ; 25 : 1031-6
- Travis WD, Brambilla E, Noguchi M et al.
International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma.
J Thorac Oncol. 2011 ; 6 : 244-285.
- Travis WD, Brambilla E, Nicholson AG et al.
The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification.
J Thorac Oncol. 2015 ; 10 : 1243-1260.
- Vansteenkiste J, Crinò L, Dooms C, et al.
2nd ESMO Consensus Conference on Lung Cancer : early-stage non-small-cell lung cancer consensus on diagnosis, treatment and follow-up.
Ann Oncol. 2014 ; 25 : 1462-1474.
- Wu YL, Dziadziuszko R, Ahn JS, Barlesi F, Nishio M, Lee DH, et al.
Alectinib in Resected ALK-Positive Non-Small-Cell Lung Cancer.
N Engl J Med. 2024;390(14):1265‑76.
- Xiao F, Yu Q, Zhang Z, Liu D, Guo Y, Liang C, et al.
Novel perspective to evaluate the safety of segmentectomy: clinical significance of lobar and segmental lymph node metastasis in cT1N0M0 lung adenocarcinoma.
European Journal of Cardio-Thoracic Surgery. 2018;53(1):228‑34.
- Yatabe Y, Dacic S, Borczuk AC, et al.
Best Practices Recommendations for Diagnostic Immunohistochemistry in Lung Cancer.
-
Zhou C, Tang KJ, Cho BC, Liu B, Paz-Ares L, Cheng S, et al.
Amivantamab plus Chemotherapy in NSCLC with EGFR Exon 20 Insertions.
N Engl J Med. 30 nov 2023;389(22):2039‑51.


