Collaborateurs
Coordonnateurs régionaux
CERIBELLI Cécilia
Institut de Cancérologie de Lorraine (54)
BRIGAND Cécile
HU de Strasbourg (67)
PAQUETTE Brice
CHU de Besançon (25)
Rédacteurs
BERTHET Louis
Centre de Médecine Nucléaire du Parc (21)
ELIAS Bachir
(57)
KOEHL Grégoire
Institut de Cancérologie Strasbourg (67)
Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 10 décembre 2021.
- Cette référence propose la conduite à tenir diagnostique et thérapeutique devant une carcinose péritonéale.
- Elle aborde le bilan à réaliser devant une carcinose péritonéale et les principes de base pour une présentation en RCP.
- Les principes généraux de la Chimiothérapie Hyperthermique IntraPéritonéale (CHIP) sont également rappelés, ainsi que les données pronostiques et de morbi-mortalité.
- Les étiologies digestives sont détaillées : colorectale, gastrique, appendiculaire, mésothéliale, et peuvent renvoyer vers les références correspondantes.
(Cashin, 2012 ; Cavaliere, 2011 ; Elias, 2010 ; Faron, 2015 ; Glehen, 2010)
- La carcinose péritonéale est la dissémination et l’implantation de cellules tumorales dans la cavité péritonéale.
- Plusieurs critères pronostiques permettent son évaluation :
- Il permet d’établir le score de Sugarbaker en peropératoire.
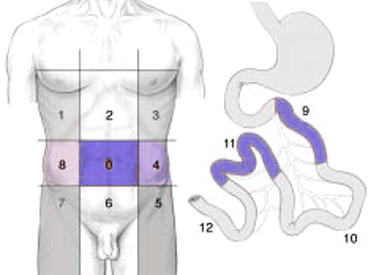
| 0 | Central | 7 | Inférieur droit |
| 1 | Supérieur droit | 8 | Flanc droit |
| 2 | Epigastre | 9 | Jéjunum proximal supérieur |
| 3 | Supérieur gauche | 10 | Jéjunum distal inférieur |
| 4 | Flanc gauche | 11 | Iléon proximal supérieur |
| 5 | Inférieur gauche | 12 | Iléon distal inférieur |
| 6 | Pelvis |
- Compter pour chaque région :
- 0 : pas de tumeur
- 1 : tumeur <0,5 cm
- 2 : 0,5 et 5 cm
- 3 : >5 cm ou nodules confluents pour chaque région
=> la somme des scores des 13 régions représente le PCI
- Calcul possible du PCI en ligne permettant une harmonisation du calcul du score : www.e-promise.org
- L'exérèse est classée comme étant complète ou incomplète :
- CC0 : absence de résidu tumoral macroscopique
- CC1 : résidu tumoral ≤ 0,25 cm
- CC2 : résidu tumoral 0,25 <R <2,5 cm
- CC3 : résidu tumoral ≥ 2,5 cm.
- Qualité d’exérèse : CC0 vs CC1 vs CC2/3
- Score PCI : <17 pour les carcinomes colorectaux
- Expérience du centre
- Absence de métastase synchrone hépatique ou ganglionnaire
- Chimiothérapie adjuvante (pour les carcinomes colorectaux seulement) (série AFC 2008).
- La chimiothérapie intrapéritonéale a l’avantage de mettre le tissu péritonéal tumoral (qui au début de l’évolution carcinomateuse est peu ou pas vascularisé), ou la maladie péritonéale micrométastatique, en contact direct avec l’agent cytotoxique. Ceci limite les concentrations systémiques de chimiothérapie et donc le risque de toxicité systémique.
- Il existe également un effet cytotoxique propre de l’hyperthermie à 42,5°C, démontré in vitro dès les années 1980. L’hyperthermie augmente enfin l’efficacité de certaines molécules comme la mitomycine, le cisplatine ou l’oxaliplatine, en augmentant leur cytotoxicité propre ou leur pénétration au sein des tissus tumoraux.
- La durée d’exposition aux molécules de chimiothérapie a un effet bénéfique sur l’efficacité, celle-ci étant maximale pendant la première heure. La morbidité postopératoire est par ailleurs directement liée au temps opératoire, il est donc nécessaire de trouver la durée d’intervention minimale efficace.
- La Chimiothérapie Hyperthermique IntraPéritonéale (CHIP) représente une technique de prise en charge de traitement ou de prévention de certaines carcinoses péritonéales d’origine digestive, chez des patients sélectionnés, en association à la chirurgie de cytoréduction.
- En dehors des indications gynécologiques, cette technique est recommandée dans le traitement des pseudomyxomes péritonéaux et celui des mésothéliomes péritonéaux qui relèvent d’un ensemble de critères à discuter en RCP et détaillés ci-dessous.
- Pour les carcinoses d'origine colique ou gastrique, les décisions sont prises au cas par cas en RCP de cancérologie.
- Les conséquences en termes de morbi-mortalité sont à évaluer dans chaque indication, même si une méta-analyse récente semble montrer un bénéfice persistant à 5 ans en termes de qualité de vie.
- Les techniques chirurgicales, ainsi que les agents cytotoxiques utilisés en intrapéritonéal ou en intraveineux lors de l’intervention, ne sont pas des standards et peuvent varier selon les équipes.
- Les deux agents les plus communément étudiés sont la mitomycine C et le cisplatine, possiblement utilisés en combinaison.
- Antécédents personnels et familiaux
- Examen clinique incluant un toucher rectal
- Coloscopie et/ou gastroscopie avec biopsies
- Scanner thoraco-abdomino-pelvien injecté
- Option : IRM avec séquences de diffusion, particulièrement pour les pseudomyxomes, tumeurs colorectales à composante mucineuse
- Bilan biologique, ACE, CA 19.9 et CA 125
- Vérifier les indications de consultation d'oncogénétique
- TEP-TDM au 18F-FDG pour recherche de primitif, bilan d'extension de la carcinose et bilan extrapéritonéal
- En l’absence de primitif évident : cœlioscopie exploratrice avec description des lésions, macrobiopsies sans dissection pour examen anatomo-pathologique avec nécessité de mise en place des trocarts sur la ligne médiane.
- Données démographiques
- Médecin correspondant, date et lieu du diagnostic
- Etat général OMS, Poids, Taille
- Antécédents familiaux de cancer
- Comptes-rendus opératoire et anatomo-pathologique (si malade déjà opéré)
- Compte-rendu d'endoscopie et résultat écrit de l'examen anatomo-pathologique des biopsies
- Comorbidités du patient (cardiaque, rénale, hépatique, neurologique en particulier)
- Bilan d'extension tel qu'il est prévu dans la référence
- Biomarqueurs ACE, CA 19.9, CA 125 en fonction du primitif
- Recherche de mutations (profil génomique RAS, BRAF et MSI) si origine colorectale
- Décrire l'étendue des lésions selon le score de Sugarbaker. Les photos et/ou vidéos opératoires sont souhaitables si l’évaluation n’est pas faite par l’équipe chirurgicale qui réalisera la cytoréduction ± CHIP.
- Support nutritionnel
- Information du patient (et de l’équipe d’urologie) de la possibilité de pose de sondes JJ avant ou pendant le geste
- Cœlioscopie diagnostique si possible réalisée par l'équipe qui réalisera la cytoréduction ± CHIP :
- trocarts sur la ligne médiane
- proscrire tout décollement lors de la chirurgie
- sous-estime la valeur du score PCI.
- Les carcinoses péritonéales, c'est-à-dire les métastases péritonéales (MP) sont présentes dans 5 à 20 % au diagnostic et dans 10 à 44 % à la récidive.
- La présence des MP est un facteur indépendant de mauvais pronostic pour la survie globale (SG) et pour la survie sans progression (SSP).
- La SG à 5 ans des patients traités par la chimiothérapie systémique est <5 %.
- La cytoréduction complète ± chimiothérapie hyperthermique intrapéritonéale, associée à une chimiothérapie systémique
- augmente de manière significative la SSP par rapport à la chimiothérapie systémique seule (7,7 mois vs 12,6, p = 0.02)
- la survie globale à 5 ans est de 45 à 51 %.
- A qui proposer une cytoréduction complète + CHIP ?
- âge physiologique <65-70 ans
- statut OMS <2
- pas de localisation extrapéritonéale (<3 métastases hépatiques)
- carcinose résécable en totalité
- pas de progression sous chimiothérapie
- index péritonéal <20.
- Le bévacizumab a montré, dans une étude, une augmentation des complications postopératoires d’un facteur 2 et doit être utilisé avec prudence.
- Métastases ovariennes de carcinomes colorectaux :
- Discuter d'une résection chirurgicale ± CHIP
- Résection des métastases ovariennes à discuter même en cas de carcinoses péritonéales non résécables.
- "Second-look" chirurgical + CHIP :
- Après 12 cures de chimiothérapie, en comparaison à une surveillance clinique, biologique et radiologique (standard actuel), la CHIP à l'oxaliplatine n'a pas montré d'indication (essai PROPHYLOCHIP-PRODIGE 15) (Klavere, 2019) (Delhorme, 2016) (Elias, 2009) (Goere, 2020)
- Le dossier doit être discuté en centre expert pour évaluation de la chirurgie de second regard associé à une CHIP, en particulier dans les situations à très haut risque de récidive (métastases ovariennes, carcinose synchrone).
- PIPAC : Pressurized IntraPeritoneal Aerosol Chemotherapy : chimiothérapie présurisée en aérosol dans la cavité péritonéale par voie laparoscopique :
- pour une carcinose non éligible à une chirurgie de cytoréduction
- en association à la chimiothérapie intraveineuse (essai PIPOX)
- doit être discutée en centre expert.
- coloscopie
- cœlioscopie avec biopsies
(à réaliser de préférence par l'équipe
qui réalisera la cytoréduction ± CHIP)
Consultation multidisciplinaire
ou RCP en centre expert
ou RCP en centre expert
Chimiothérapie
d'induction
d'induction
Chimiothérapie
adjuvante
Tumeur primitive
symptomatique * ?
Chirurgie première **
Cytoréduction
****
±
CHIP
Chimiothérapie
systématique
Chirurgie possible ***
et absence de métastases
et absence de métastases
extra-péritonéales ?
Cytoréduction
****
±
CHIP
RCP et adresser
en centre expert
Bilan pré-thérapeutique :
- TDM-TAP
- TEP-TDM au 18F-FDG
- ± IRM de diffusion
* Occlusion, perforation ou hémorragie active
** Dérivation externe en cas d'occlusion
Résection de la tumeur primitive en cas de perforation
Résection de la tumeur primitive en cas de perforation
ou d'hémorragie active
+ exploration abdominale (score PCI) ± péritonéale
± échographie hépatique
*** Maladie résécable et patient opérable
+ exploration abdominale (score PCI) ± péritonéale
± échographie hépatique
*** Maladie résécable et patient opérable
**** Exploration abdominale (score PCI)
± échographie hépatique
± échographie hépatique
+ résection macroscopiquement complète de la carcinose
+ omentectomie
+ annexectomie
± CHIP
Chimiothérapie
adjuvante
Carcinose péritumorale
Exploration abdominale
+ score PCI
+ score PCI
+ biopsies
± échographie hépatique
PCI <3 ?
Avis
centre expert
Chirurgie de la tumeur primitive par laparotomie
+ exploration complète abdominale
+ résection R0 de la carcinose péritonéale
RCP
Chimiothérapie
Avis
centre expert
(Glehen, 2010 ; Yang, 2011 ; Bonnot, 2019 ; Eveno, 2018)
- En cas de carcinose péritonéale d’origine gastrique, la seule stratégie thérapeutique permettant une survie à long terme est la réalisation, chez des patients très sélectionnés, d'une résection carcinologique du primitif avec cytoréduction complète et CHIP. Cette stratégie permet alors d’atteindre un taux de survie à 5 ans de 23 %.
- Chez les patients présentant un adénocarcinome gastrique :
- la CHIP peut être curative dans un centre expert en fonction du score PCI :
- PCI ≤ 6 : indication de CHIP
- 6 < PCI ≤ 10 discuter CHIP
- PCI >10 CHIP contre-indiquée.
- il n'y a pas d'indication prophylactique de CHIP pour le moment (dans l'attente des résultats de l'étude GASTRICHIP).
- PIPAC : Pressurized IntraPeritoneal Aerosol Chemotherapy : chimiothérapie présurisée en aérosol dans la cavité péritonéale par voie laparoscopique :
- pour une carcinose non éligible à une chirurgie de cytoréduction
- doit être discutée en centre expert
- essais cliniques :
- essai ESTOK 01 : si le score PCI >8, pour une carcinose non éligible à une chirurgie de cytoréduction avec estomac en place ou non : étude prospective, randomisée, de phase II comparant la chimiothérapie systémique seule et en association à la PIPAC.
- essai PIPOX : en association à la chimiothérapie intraveineuse.
- la CHIP peut être curative dans un centre expert en fonction du score PCI :
(Deraco, 2008 ; De Pangher, 2005 ; Sugarbaker, 2006 ; Yan, 2007)
- Le mésothéliome malin péritonéal est une pathologie rare qui se caractérise par l'envahissement diffus des surfaces péritonéales. Le mésothéliome malin péritonéal représente 1/5 à 1/4 de toutes les formes cliniques de mésothéliome.
- Le diagnostic doit être évoqué devant une carcinose péritonéale sans primitif.
- Particularités du bilan complémentaire des mésothéliomes péritonéaux :
- bilan standard comportant TDM TAP, cœlioscopie exploratrice et IRM pour les formes multikystiques ou papillaire
- immunohistochimie avec panel d’anticorps dont l’anti-calrétinine et relecture par les anatomopathologistes du réseau RENAPATH
- déclaration obligatoire (INVS et MESOPATH).
- Une fois le diagnostic établi, adresser les patients à un centre référent RENAPE.
- La technique de référence est la cytoréduction complète + CHIP (cisplatine et doxorubicine). En cas de maladie très étendue, jugée non opérable, une chimiothérapie seule sera administrée.
- PIPAC : Pressurized IntraPeritoneal Aerosol Chemotherapy : chimiothérapie présurisée en aérosol dans la cavité péritonéale par voie laparoscopique :
- pour une carcinose non éligible à une chirurgie de cytoréduction
- doit être discutée en centre expert.
- essais cliniques :
- essai PIPOX en association à la chimiothérapie intraveineuse
- essai MESOTIP : étude comparant en première ligne la chimiothérapie systémique seule et en association à la PIPAC.
(Dartigues, 2014 ; Journal de Chrirugie Viscérale, 2014)
- La carcinose mucineuse péritonéale est le terme clinique correspondant à la dissémination intrapéritonéale de cellules muco-sécrétantes responsables d’une accumulation de mucine dans la cavité péritonéale. L’appendice est reconnu comme le premier organe responsable, même si les carcinoses mucineuses peuvent occasionnellement provenir d’adénocarcinomes mucineux d’autres organes (vésicule biliaire, estomac, trompe, ovaire ou origine colorectale).
- Bilan minimal :
- endoscopies haute et basse
- marqueurs : ACE, CA 19.9, CA 125
- biopsies par cœlioscopie si pas d'origine évidente
- pas de TEP-TDM au 18F-FDG
- IRM abdominale avec séquences de diffusion.
- Classification : Cf. référence Tumeurs appendiculaires.
- Les carcinoses mucineuses péritonéales font partie des tumeurs rares du péritoine. Ces tumeurs, avec les mucocèles, font l’objet d’un recensement par le groupe RENAPE depuis 2011. Une relecture par l’un des pathologistes du groupe RENAPATH est recommandée depuis 2012.
Cf. fiche anatomo-pathologique standardisée du réseau RENAPE sur le pseudomyxome.
- PIPAC : Pressurized IntraPeritoneal Aerosol Chemotherapy : chimiothérapie présurisée en aérosol dans la cavité péritonéale par voie laparoscopique :
- pour une carcinose non éligible à une chirurgie de cytoréduction
- doit être discutée en centre expert
- inclusion dans l'essai PIPOX : en association à la chimiothérapie intraveineuse.
- Examen clinique + scanner TAP ou IRM abdominale de diffusion + dosage ACE, CA 19.9 et CA125 : tous les 6 mois pendant 5 ans puis tous les ans jusqu'à 10 ans.
Mucocèle
Diagnostic préopératoire ou
peropératoire
- Prélèvements pour cytologie
- + photos
- ± appendicectomie
(selon état local) - Aucun autre geste associé
Transfert en
centre expert
centre expert
Mucocèle perforée ?
Avis
centre RENAPATH
Appendicectomie
avec agrafage du bas fond cœcal
pour
diagnostic anatomo-pathologique
Découverte peropératoire
d'une carcinose mucineuse
Syndrome appendiculaire
Description de la carcinose * région par région
(photos-vidéos), prélèvements anatomo-pathogiques
± appendicectomie
* Description de l'intestin grêle, du type d'atteinte, existence ou non d'une
rétraction mésentérique, atteinte ou non des coupoles, ascite
Adresser à un centre
expert RENAPE
- Ce chapitre renvoie aux différentes références spécialisées (Côlon, Estomac, Tumeurs appendiculaires).
- Certaines localisations nécessitent des surveillances prolongées de 10 ans.
| Mitomycine 60 mg à ventre ouvert et 0,8 à 1 mg/kg à ventre fermé en intrapéritonéal pendant 90 min à 42-43°C sérum physiologique ou dialysat 2 litres/m² |
-
Cisplatine 50 mg/m² en intrapéritonéal pendant 60 min à 42-43°C
Doxorubicine 15 mg/m² en intrapéritonéal pendant 60 min à 42-43°C
dialysat 2 litres/m² - En attente des résultats de l'essai GASTRICHIP pour un traitement prophylactique.
- undefined : undefined
- undefined : undefined
- STELLAR-001 : Etude de phase I évaluant l'innocuité, la tolérance et l'activité antitumorale du IPH5401 associé à du durvalumab chez des patients adultes ayant des tumeurs solides avancées sélectionnées
-
EXOMA : Etude exploratoire visant à évaluer l’impact d’une analyse du profil génétique par la technique « Next Generation sequencing » (NGS) à haut débit sur la décision thérapeutique chez des patients ayant une tumeur solide
- Statut : Ouvert (12-05-2016 - 26-06-2021)
- Promoteur : Centre Georges François Leclerc
-
BP29842 : Etude de phase Ia/Ib visant à évaluer la sécurité, la pharmacocinétique et l’activité thérapeutique du RO6874281, une immunocytokine, variante de l’interleukine-2 (IL-2V) ciblant la protéine d’activation des fibroblastes-α (FAP), administré en monothérapie (partie A) ou en association avec le trastuzumab ou le cétuximab (partie B ou C).
- Statut : Ouvert (29-01-2018 - 30-06-2021)
- Promoteur : Hoffmann-La Roche
-
ObservAG : Etude de soins courants évaluant l’observance des thérapies anticancéreuses par voie orale chez les patients de plus de 75 ans versus de moins de 75 ans suivis au centre Georges François Leclerc
- Statut : Ouvert (30-11-2016 - 01-07-2021)
- Promoteur : Centre Georges François Leclerc
-
EX2TRICAN : Etude évaluant la place de la stratégie d'analyse de l'exome dans l'identification de facteurs de prédisposition génétique dans les formes précoces de cancer
- Statut : Ouvert (22-10-2019 - 10-10-2024)
- Promoteur : Centre Georges François Leclerc
-
XL 184-021 : Etude de phase 1b avec escalade de dose portant sur le CABOZANTINIB (XL184) administré seul ou en association avec l’atézolizumab chez des patients atteints de tumeurs solides localement avancées ou métastatiques.
- Statut : Ouvert (05-09-2017 - 31-12-2021)
- Promoteur : Exelixis
- TAS-120-202 : Etude de phase 2, visant à évaluer la sécurité d’emploi et l’efficacité du futibatinib, chez des patients ayant des aberrations du gène FGFR
Mises à jour via le site HECTOR
(Hébergement des Essais Cliniques et Thérapeutiques en Oncologie Régional) :
(Hébergement des Essais Cliniques et Thérapeutiques en Oncologie Régional) :

- Barlogie B, Corry PM, Drewinko B.
In vitro thermochemotherapy of human colon cancer cells with cis-dichlorodiammineplatinum(II) and mitomycin
Cancer Res. 1980 ;40:1165-8.
- Barton JB, Langdale LA, Cummins JS, Stelzner M et al.
The utility of routine pre-operative computed tomography scanning in the management of veterans with colon cancer.
Am J Surg 2002; 183 : 499-503.
- Bonnot PE, Piessen G, Kepenekian V, Decullier E et al ; FREGAT and BIG-RENAPE Networks.
Cytoreductive Surgery With or Without Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer With Peritoneal Metastases (CYTO-CHIP study): A Propensity Score Analysis.
J Clin Oncol. 2019 ;37:2028-2040.
- Cashin PH, Graf W, Nygren P, Mahteme H.
Cytoreductive surgery and intraperitoneal chemotherapy for colorectal peritoneal carcinomatosis: prognosis and treatment of recurrences in a cohort study.
Eur J Surg Oncol 2012 ;38, 509–515.
- Cavaliere F, De Simone M, Virzì S, Deraco M et al.
Prognostic factors and oncologic outcome in 146 patients with colorectal peritoneal carcinomatosis treated with cytoreductive surgery combined with hyperthermic intraperitoneal chemotherapy : Italian multicenter study S.I.T.I.L.O.
Eur J Surg Oncol 2011 ; 37:148–154.
- Cavaliere F, Di Filippo F, Botti C, Cosimelli M et al.
Peritonectomy and hyperthermic antiblastic perfusion in the treatment of peritoneal carcinomatosis.
Eur J Surg Oncol 2000, 26:486-91.
- Dartigues P, Isaac S, Villeneuve L, Glehen O et al.
Peritoneal pseudomyxoma: an overview emphasizing pathological assessment and therapeutic strategies.
Ann Pathol. 2014 ;34:14-25
- De Gaetano, Anna Maria, et al.
"Imaging of peritoneal carcinomatosis with FDG PET-CT: diagnostic patterns, case examples and pitfalls."
Abdominal imaging 34.3 (2009): 391-402.
- Delhorme JB, Triki E, Romain B, Meyer N et al.
Routine second-look after surgical treatment of colonic peritoneal carcinomatosis.
J Visc Surg. 2015 ;152:149-54.
- De Pangher Manzini V.
Malignant peritoneal mesothelioma.
Tumori 2005; 91:1-5.
- Deraco M, Bartlett D, Kusamura S, Baratti D.
Consensus statement on peritoneal mesothelioma.
J Surg Oncol. 2008;98:268-72.
- Desiderio J, Chao J, Melstrom L, Warner S, et al.
The 30-year experience-A meta-analysis of randomised and high-quality non-randomised studies of hyperthermic intraperitoneal chemotherapy in the treatment of gastric cancer.
Eur J Cancer 2017;79:1-14.
- Dumont F, Senellart H, Pein F, Campion L et al.
Phase I/II study of oxaliplatin dose escalation via a laparoscopic approach using pressurized aerosol intraperitoneal chemotherapy (PIPOX trial) for nonresectable peritoneal metastases of digestive cancers (stomach, small bowel and colorectal): Rationale and design.
Pleura Peritoneum. 2018 ;3:20180120.
- Elias D, Gilly F, Boutitie F, Quenet F et al.
Peritoneal colorectal carcinomatosis treated with surgery and perioperative intraperitoneal chemotherapy : retrospective analysis of 523 patients from amulticentric French study.
J Clin Oncol. 2010;28:63-8.
- Elias D, Honoré C, Dumont F, Ducreux M et al.
Results of Systematic Second-look Surgery Plus HIPEC in Asymptomatic Patients Presenting a High Risk of Developing Colorectal Peritoneal Carcinomatosis
Ann Surg. 2011 ;254:289-93.
- Elias D, Lefevre JH, Chevalier J, Brouquet A et al.
Complete cytoreductive surgery plus intraperitoneal chemohyperthermia with oxaliplatin for peritoneal carcinomatosis of colorectal origin.
J Clin Oncol. 2009;27:681-5.
- Eveno C, Jouvin I, Pocard M.
PIPAC EstoK 01: Pressurized IntraPeritoneal Aerosol Chemotherapy with cisplatin and doxorubicin (PIPAC C/D) in gastric peritoneal metastasis: a randomized and multicenter phase II study.
Pleura Peritoneum. 2018 ;3:20180116.
- Eveno C, Passot G, Goéré D, Soyer P et al.
Bevacizumab Doubles the Early Postoperative Complication Rate after Cytoreductive Surgery with Hyperthermic Intraperitoneal Chemotherapy (HIPEC) for Peritoneal Carcinomatosis of Colorectal Origin.
Ann Surg Oncol 2014-21: 1792-1800.
- Faron, M., Macovei, R., Goéré, D., Honoré C. et al.
Linear Relationship of Peritoneal Cancer Index and Survival in Patients with Peritoneal Metastases from Colorectal Cancer.
Ann Surg Oncol. 2015 May 27. [Epub ahead of print
- Franko J, Shi Q, Goldman CD, Pockaj BA et al.
Treatment of Colorectal Peritoneal Carcinomatosis With Systemic Chemotherapy : A Pooled Analysis of North Central Cancer Treatment Group Phase III Trials N9741 and N9841.
Journal of Clinical Oncology 2012 ; 30:263–267.
- Fujimura T, Yonemura Y, Fushida S, Urade M et al.
Continuous hyperthermic peritoneal perfusion for the treatment of peritoneal dissemination in gastric cancers and subsequent second-look operation.
Cancer 1990; 65:65-71.
- Gao B, Lindemann K, Anderson L, Fereday S, et al.
Serous ovarian and primary peritoneal cancers: A comparative analysis of clinico-pathological features, molecular subtypes and treatment outcome.
Gynecol Oncol. 2016;142:458-464.
- Gauthé M, Richard-Molard M, Cacheux W, Michel P et al.
Role of fluorine 18 fluorodeoxyglucose positron emission tomography/computed tomography in gastrointestinal cancers.
Dig Liver Dis. 2015 ; 19 : S1590-8658.
- Glehen O, Beaujard AC, Arvieux C, Huber O. et al.
Les carcinoses péritonéales. Traitement chirurgical, péritonectomies et chimiohyperthermie intrapéritonéale.
Gastroenterol Clin Biol 2002; 26:210-5.
- Glehen O, Gilly FN, Arvieux C, et al.
Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy.
Ann Surg Oncol 2010; 17:2370-7.
- Glehen O, Gilly FN, Boutitie F, Bereder JM et al.
Toward curative treatment of peritoneal carcinomatosis from nonovarian origin by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy : a multi-institutional study of 1,290 patients.
Cancer 2010 ; 116:5608–5618.
- Glehen O, Mithieux F, Osinsky D, Beaujard AC et al.
Surgery combined with peritonectomy procedures and intraperitoneal chemohyperthermia in abdominal cancers with peritoneal carcinomatosis: a phase II study.
J Clin Oncol 2003; 21:799-806.
- Glehen O, Passot G, Villeneuve L, Vaudoyer D et al.
GASTRICHIP: D2 resection and hyperthermic intraperitoneal chemotherapy in locally advanced gastric carcinoma: a randomized and multicenter phase III study.
BMC Cancer. 2014;14 :183.
- Goéré D, Glehen O, Quenet F, Guilloit JM et al; BIG-RENAPE group.
Second-look surgery plus hyperthermic intraperitoneal chemotherapy versus surveillance in patients at high risk of developing colorectal peritoneal metastases (PROPHYLOCHIP-PRODIGE 15): a randomised, phase 3 study.
Lancet Oncol. 2020 ;21:1147-1154.
- Goéré D, Souadka A, Faron M, Cloutier AS et al.
Extent of Colorectal Peritoneal Carcinomatosis: Attempt to Define a Threshold Above Which HIPEC Does Not Offer Survival Benefit: A Comparative Study.
Ann Surg Oncol. 2015;22(9):2958-2964.
- Journal de Chirurgie Viscérale.
Hors-série 2 : recommandations de bonnes pratiques : Pseudomyxomes et mésothéliomes péritonéaux - Diagnostic, traitement et surveillance.
J Visc Surg.2014;151 : S5-S63.
- Kim BJ, Passot G.
Perioperative Management for Colorectal Peritoneal Metastases.
Clin Colorectal Cancer. 2018 Dec;17(4):249-250.
- Klaver CEL, Wisselink DD, Punt CJA, Snaebjornsson P et al; COLOPEC collaborators group.
Adjuvant hyperthermic intraperitoneal chemotherapy in patients with locally advanced colon cancer (COLOPEC): a multicentre, open-label, randomised trial.
Lancet Gastroenterol Hepatol. 2019 ;4:761-770.
- Low RN, Barone RM, Lucero J
Comparison of MRI and CT for predicting the Peritoneal Cancer Index (PCI) preoperatively in patients being considered for cytoreductive surgical procedures.
Ann Surg Oncol. 2015 ;22:1708-15.
- Maciver AH, Lee N, Skitzki JJ et al.
Cytoreduction and hyperthermic intraperitoneal chemotherapy (CS/HIPEC) in colorectal cancer: Evidence-based review of patient selection and treatment algorithms.
Eur J Surg Oncol. 2017;43:1028-1039.
- Mauchley DC, Lynge DC, Langdale LA, Stelzner MG et al.
Clinical utility and cost-effectiveness of routine operative computed tomography scanning in patients with colon cancer.
Am J Surg 2005; 189 : 512-7.
- Passot G, Dumont F, Goéré D, Arvieux C et al.
BIG-RENAPE Surgery Working Group. Multicentre study of laparoscopic or open assessment of the peritoneal cancer index (BIG-RENAPE).
Br J Surg. 2018 ;105:663-667.
- Pestieau SR, Belliveau JF, Griffin H, et al.
Pharmacokinetics of intraperitoneal oxaliplatin: experimental studies.
J Surg Oncol 2001; 76:106-14.
- Quénet F, Elias D, Roca L, Goéré D et al.; UNICANCER-GI Group and BIG Renape Group.
Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy versus cytoreductive surgery alone for colorectal peritoneal metastases (PRODIGE 7): a multicentre, randomised, open-label, phase 3 trial.
Lancet Oncol. 2021 ;22:256-266.
- Seong-Jang K., and Sang-Woo L.
"Diagnostic accuracy of 18F-FDG PET/CT for detection of peritoneal carcinomatosis; a systematic review and meta-analysis."
The British journal of radiology 91.1081 (2018): 20170519.
- Sgarbura O, Gourgou S, Tosi D, Bakrin N et al.
MESOTIP: Phase II multicenter randomized trial evaluating the association of PIPAC and systemic chemotherapy vs. systemic chemotherapy alone as 1st-line treatment of malignant peritoneal mesothelioma.
Pleura Peritoneum. 2019 ;4:20190010.
- Shan LL., Saxena A., Shan BL, Morris DL.
Quality of life after cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis: A systematic review and meta-analysis
Surg Oncol 2014; 23: 199-210.
- Sugarbaker PH.
New standard of care for appendiceal epithelial neoplasms and pseudomyxoma peritonei syndrome?
Lancet Oncol 2006; 7:69-76.
- Sugarbaker PH, Yan TD, Stuart OA, Yoo D.
Comprehensive management of diffuse malignant peritoneal mesothelioma.
Eur J Surg Oncol. 2006 ;32:686-91.
- Turlakow, Alla, et al.
Peritoneal carcinomatosis: role of 18F-FDG PET.
Journal of Nuclear Medicine 44.9 (2003): 1407-1412.Verwaal VJ, van Ruth S, de Bree E, van Sloothen GW et al.
- Verwaal VJ, Bruin S, Boot H, van Slooten G et al.
8-year follow-up of randomized trial : cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy in patients with peritoneal carcinomatosis of colorectal cancer.
Ann Surg Oncol 2008; 15, 2426–2432.
- Verwaal VJ, van Ruth S, de Bree E, et al.
Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer.
J Clin. Oncol. 2003 ; 21:3737–3743.
- Weber T, Roitman M, Link KH.
Current status of cytoreductive surgery with hyperthermic intraperitoneal chemotherapy in patients with peritoneal carcinomatosis from colorectal cancer.
Clin Colorectal Cancer 2012 ; 11:167–176.
- Yan TD, Deraco M, Baratti D, Kusamura S et al.
Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma: multi-institutional experience
J Clin Oncol 2009; 27:6237-42.
- Yan TD, Welch L, Black D, Sugarbaker PH.
A systematic review on the efficacy of cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for diffuse malignancy peritoneal mesothelioma.
Ann Oncol 2007; 18:827-34
- Yang XJ, Huang CQ, Suo T, Mei LJ et al.
Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase III randomized clinical trial.
Ann Surg Oncol 2011; 18:1575-81.
- Yonemura Y, de Aretxabala X, Fujimura T, Fushida S et al.
Intraoperative chemohyperthermic peritoneal perfusion as an adjuvant to gastric cancer: final results of a randomized controlled study.
Hepatogastroenterology 2001; 48:1776-8


