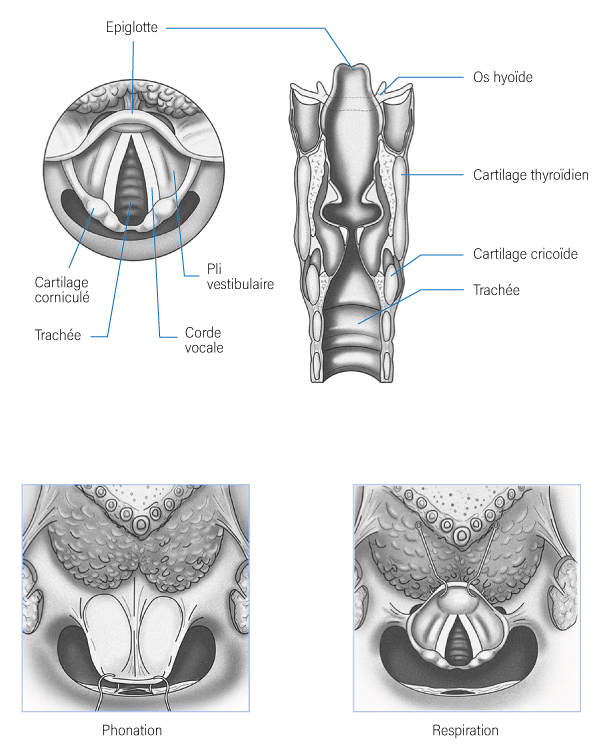
- Le larynx est un organe indispensable aux fonctions de phonation et de respiration. Il exerce un rôle indirect dans la déglutition en protégeant les voies respiratoires. Il est composé de trois étages que sont :
- Le plan glottique (plan des cordes vocales),
- Le plan sus-glottique jusqu’au bord libre de l’épiglotte en haut,
- Et le plan sous-glottique jusqu’au bord inférieur du cartilage cricoïde en bas (Bonfils, 2017).
- Tout protocole de traitement d’un cancer du larynx s’attachera donc à préserver ces fonctions sans amputer les chances de guérison.
- La prise en charge diagnostique d’un cancer du larynx nécessite une évaluation rigoureuse :
- Clinique (insistant sur l’évaluation de la mobilité laryngée et la palpation des aires ganglionnaires),
- Radiologique (en phonation et avec manœuvre de Valsalva),
- Et endoscopique (optique 0°, 30° et/ou 70°, 90°).
- La profession (professionnel de la voix) et l’environnement social du malade (isolement, entourage) seront à prendre en compte dans la discussion thérapeutique
etafin d’envisager une meilleure réhabilitation après traitement (Bergstrom, 2017) (NP4). Le bilan clinique s’intéressera à l’état général (statut OMS et nutritionnel) (De Mones, 2013) (NP4).
- Les particularités de l’évaluation clinique initiale nécessitent l’appréciation de :
- L’ouverture buccale (score de Mallampati),
- L’état dentaire du patient,
- La mobilité aryténoïdienne et cordale,
- La souplesse de la membrane crico-thyroïdienne lors de la palpation,
- Ainsi que l’envahissement ganglionnaire cervical (Référentiel SFORL, 2013) (NP4).
- L’état général, certaines comorbidités respiratoires ou cardiaques et l’âge au-delà de 70 ans peuvent être des contre-indications à une chirurgie partielle laryngée par voie externe (Référentiel SFORL, 2013 ; Decotte, 2010) (NP4).
- Le bilan radiologique scanographique appréciera l’atteinte :
- De la loge hyo-thyro-épiglottique (HTE),
- De la loge cartilagineuse thyroïdienne,
- De la loge cricoïdienne et/ou aryténoïdienne (condensation, érosion ou lyse),
- De l’espace para-glottique,
- De la sous-glotte
- Des aires ganglionnaires (notamment, aire récurrentielle).
- Au plan ganglionnaire, l’étage glottique est peu lymphophile, mais les étages sus- et sous-glottiques le sont particulièrement et ce, de façon bilatérale et pour l’étage sous-glottique, le drainage se fait dans l’aire récurrentielle (Matsuo, 2003) (NP4).
- Pour les stades T1 et T2, le scanner reste supérieure à l’IRM pour l’appréciation de l’envahissement profond. Pour les stades T3 et T4, le scanner pourra rechercher une atteinte transfixiante du cartilage thyroïde avec envahissement sous-cutané et une extension vers un lobe thyroïdien (Van Egmond, 2018) (NP4). L’endoscopie explore, outre l’envahissement local et régional, le caractère exposable du larynx (Meulemans, 2018 ; Gorphe, 2018 ; Bhattacharyya, 2018) (NP4).
| Tx | Tumeur primitive non évaluable |
| Tis | Carcinome in situ |
| T1 | Tumeur limitée à l’une des sous-localisations anatomiques de la région sus-glottique avec une mobilité normale des cordes vocales |
| T2 | Tumeur envahissant la muqueuse de plus d’une des sous-localisations anatomiques de la sus-glotte ou une des localisations au-delà de la sus-glotte, comme le plan glottique, la base de langue, les vallécules ou la paroi interne du sinus piriforme, sans fixation du larynx |
| T3 | Tumeur limitée au larynx avec fixation d’une ou des deux cordes vocales et/ou envahissant l’une des régions suivantes : rétro-cricoïdienne, loge pré-épiglottique, espace para-glottique et/ou corticale interne du cartilage thyroïde |
| T4a | Tumeur franchissant le cartilage thyroïde et/ou s’étendant au-delà du larynx, dans l’une des structures suivantes : trachée, parties molles du cou (y compris les muscles profonds/extrinsèques de la langue, génio-glosse, hyo-glosse, palato-glosse et stylo-glosse), muscles sous-hyoïdiens, glande thyroïde, œsophage |
| T4b | Tumeur envahissant le fascia prévertébral, les structures médiastinales ou englobant la carotide |
| Tx | Tumeur primitive non évaluable |
| Tis | Carcinome in situ |
| T1 | Tumeur limitée à une (aux) corde(s) vocale(s), avec mobilité conservée, pouvant envahir la commissure antérieure et/ou postérieure |
| T1a |
Tumeur limitée à une corde vocale |
| T1b | Tumeur envahissant les deux cordes vocales |
| T2 | Tumeur étendue à la région sus-glottique et/ou sous-glottique et/ou avec diminution de la mobilité de la corde vocale |
| T3 | Tumeur limitée au larynx avec fixation d’une corde vocale et/ou envahissement de l’espace para-glottique et/ou de la corticale interne du cartilage thyroïde |
| T4a | Tumeur franchissant le cartilage thyroïde et/ou s’étendant au-delà du larynx, dans l’une des structures suivantes : trachée, parties molles du cou (y compris les muscles profonds/extrinsèques de la langue, génio-glosse, hyo-glosse, palato-glosse et stylo-glosse), muscles sous-hyoïdiens, glande thyroïde, œsophage |
| T4b | Tumeur envahissant le fascia prévertébral, les structures médiastinales ou englobant la carotide |
| Tx | Tumeur primitive non évaluable |
| Tis | Carcinome in situ |
| T1 | Tumeur limitée à la région sous-glottique |
| T2 | Tumeur étendue à une (aux) corde(s) vocale(s) avec une mobilité normale ou diminuée |
| T3 | Tumeur limitée au larynx avec une fixation d'une corde vocale |
| T4a | Tumeur envahissant les cartilages thyroïde ou cricoïde et/ou s’étendant au-delà du larynx, dans l’une des structures suivantes : trachée, parties molles du cou (y compris les muscles profonds/extrinsèques de la langue, génio-glosse, hyo-glosse, palato-glosse et stylo-glosse), muscles sous-hyoïdiens, glande thyroïde, œsophage |
| T4b | Tumeur envahissant le fascia prévertébral, les structures médiastinales ou englobant la carotide |
| N1 | Adénopathie cervicale unique métastatique homolatérale, ≤ 3cm sans rupture capsulaire |
| N2 | |
| N2a | Adénopathie cervicale unique métastatique homolatérale, > 3cm et ≤ 6cm sans rupture capsulaire |
| N2b | Multiples adénopathies métastatiques homolatérales, ≤ 6cm sans rupture capsulaire |
| N2c | Adénopathies métastatiques bilatérales ou controlatérales, ≤ 6cm sans rupture capsulaire |
| N3 | |
| N3a | Adénopathie métastatique > 6cm sans rupture capsulaire |
| N3b | Adénopathie(s) métastatique(s) unique ou multiples avec rupture capsulaire (taille indifférente) |
- La dimension fonctionnelle doit particulièrement être envisagée et prise en compte dans le choix du traitement des cancers de stade précoce (American Society Of Clinical Oncology, 2006) (NP1). Une stratégie de traitement unimodale doit être privilégiée afin d’éviter de cumuler les séquelles à long terme des différentes modalités de traitements (Forastière, 2018) (NP1).
- La laryngectomie partielle n’est possible que pour les tumeurs de stade précoce et uniquement à condition de pouvoir conserver au moins :
- Une unité crico-aryténoïdienne (le cartilage cricoïde et un aryténoïde mobile),
- Un nerf hypoglosse (XII)
- Et un nerf laryngé supérieur.
- Etant donné que la radiothérapie externe permet également un bon contrôle tumoral dans ces indications, et que l’on souhaite réaliser un traitement unimodal, le chirurgien doit être en mesure de proposer une chirurgie carcinologique aboutissant à une résection complète avec marge de sécurité par rapport à la tumeur, dite chirurgie R0.
Pour envisager une chirurgie partielle laryngée :- Les limites tumorales doivent être facilement appréciables à l’œil nu (elles ne doivent pas être bordées de lésions précancéreuses à contours flous).
- La commissure postérieure doit être respectée (car il faut pouvoir conserver au moins un aryténoïde en passant macroscopiquement au large de la tumeur).
- Une tumeur de la commissure antérieure avec envahissement cartilagineux strictement limité à cette zone peut bénéficier d'une chirurgie partielle (Tucker ou CHEP) si le larynx reste mobile bilatéralement.
- Il ne doit pas y avoir d’envahissement massif de la loge Hyo-Thyro-Epiglottique (dite loge HTE).
- Il ne doit pas y avoir de lyse du cartilage cricoïde, ni de lyse transfixiante du cartilage thyroïde. En effet pour certaines tumeurs à point de départ glottique, avec lyse limitée à la corticale interne du cartilage thyroïde et sans atteinte de la mobilité, une chirurgie subtotale avec CHP ou CHEP peut être proposée.
- Concernant l’atteinte de la sous-glotte, l'envahissement antérieur peut être de plus de 5 mm, tandis que l’envahissement sous-glottique postérieur doit être de 5 mm maximum.
- Outre ces considérations portant exclusivement sur les extensions tumorales, l’état général du patient doit lui permettre de supporter la chirurgie ainsi que les complications et les fausses routes fréquentes en post-opératoire (Ganly, 2009) (NP4). Ainsi, les patients âgés (notamment au-delà de 70 ans) où l’indication sera à pondérer en fonction de l’état général et respiratoire du patient, ou les malades présentant des comorbidités importantes, ne sont pas de bons candidats (Laccourreye, 1990) (NP4).
- Par ailleurs, les patients présentant une tumeur limitée T1 ou T2 mais accompagnée d’adénopathies volumineuses, et qui vont donc devoir bénéficier d’une radiothérapie adjuvante sur les aires ganglionnaires, ne sont pas éligibles à cette chirurgie partielle laryngée (Obid, 2019) (NP4), malgré l’avènement des nouvelles techniques de radiothérapie permettant une meilleure protection des tissus sains.
Enfin, la compliance du patient au traitement et à sa surveillance pourra également entrer en ligne de compte dans la décision.
- En cas d’exérèse R1 (limites de la pièce opératoire microscopiquement envahies) après une chirurgie partielle laryngée par voie externe, la proposition du traitement complémentaire revient à la Réunion de Concertation Pluridisciplinaire (RCP). Les différents choix possibles sont :
- Soit poursuivre le traitement par une radiothérapie externe (qui risque d’altérer les résultats fonctionnels de la laryngectomie partielle, voire de mener à la nécessité d’une chirurgie totale « fonctionnelle »),
- Soit proposer au patient la mutilation par une chirurgie totale du larynx avec le risque important d’obtenir une pièce opératoire saine à l’examen définitif,
- Ou, plus fréquemment, opter pour une surveillance « rapprochée » du patient, qui n’est possible que si celui-ci est compliant au suivi.
- En cas d’exérèse R1 (limites de la pièce opératoire microscopiquement envahies) après une chirurgie endoscopique laryngée, la proposition du traitement complémentaire revient à la Réunion de Concertation Pluridisciplinaire (RCP) après relecture de la pièce opératoire avec l’anatomo-pathologiste et discussion avec l’opérateur. Les différents choix possibles sont :
- Opter pour une surveillance « rapprochée » du patient. Il s'agit du choix le plus probable dans ce cas surtout si l’exérèse est faite d’emblée à visée carcinologique ; il faut en effet tenir compte de la rétraction des tissus et de la difficulté d’analyse des marges après chirurgie laser,
- Si la découverte de la tumeur est faite sur une exérèse initialement non carcinologique, une discussion d’une reprise est nécessaire avec le risque d’avoir une pièce saine.
- Les tumeurs T4a du larynx relèvent d’une laryngectomie totale sauf contre-indication relevant du patient (comorbidités, refus).
- Pour les lésions T1 ou T2, la radiothérapie et la chirurgie sont des stratégies thérapeutiques aboutissant au même taux de rémission complète (Mendenhall, 2004) (NP4).
- En France, le traitement chirurgical est privilégié tant qu’il est possible, ceci permettant de garder la possibilité de réaliser une radiothérapie à dose curative en cas d’apparition d’une tumeur métachrone, fréquente chez les patients alcoolo-tabagiques. La profession et les souhaits du patient sont également pris en compte du fait des contraintes de traitement et des résultats vocaux différents entre les deux modalités thérapeutiques.
- Pour les plans glottique et sus-glottique, cette chirurgie endoscopique est réalisée selon la classification de l’European Laryngological Society de I à VI selon le type de résection et son étendue avec des marges de sécurité carcinologiques qui ne peuvent excéder 1 à 2 mm et avec de faibles complications (Remacle, 2007 ; Remacle, 2009) (avis d’experts). Dans certains cas de patients non exposables, la chirurgie fronto-latérale, notamment pour des tumeurs T1b et T1a du plan glottique, peut être envisagée avec plus de 90 % de contrôle local (Brumund, 2005).
- En effet, dans le travail de Chiesa et al., sur 131 procédures endoscopiques dont 98 en primaire (77 pT1 et pT2), était rapporté un taux de 2 % de complications en peropératoires (luxation dentaire et brûlure), 6,1 % de complications post-opératoires immédiates (hémorragie et dyspnée) et 13 % de complications retardées (abcès, sténose et chondrite thyroïdienne) (Chiesa Estomba, 2016) (NP4).
- Seules les tumeurs T1N0 strictement limitées au plan glottique, correspondant à une localisation anatomique sans drainage lymphatique, ne font pas l’objet d’un traitement ganglionnaire prophylactique. Toutes les autres tumeurs du larynx sont traitées pour les aires II III et IV (Ferlito, 2000) (NP4), y compris en cas de tumeur cN0, le larynx supra-glottique étant particulièrement à risque de survenue de métastases ganglionnaires occultes (Forastière, 2018 ; Spector, 2001) (NP4).
L’aire VI est également à traiter pour le cas des tumeurs à extension sous-glottique ou envahissant l’espace para-glottique, une lobectomie thyroïdienne pouvant être associée dans le cas d’un traitement chirurgical (Ferlito, 2000) (NP4).
- Seules les tumeurs bien latéralisées de la margelle laryngée, sans atteinte du sinus piriforme, semblent pouvoir être traitées sur les aires ganglionnaires homolatérales (Laccourreye, 1983) (NP4). Pour les autres, le traitement des aires ganglionnaires doit être bilatéral en raison des fréquentes métastases occultes controlatérales (Gallo, 2000) (NP4).
Les aires I et V ne sont qu’exceptionnellement envahies et ne justifient donc pas un traitement systématique (Ferlito, 2000) (NP4).
- Ce traitement peut être réalisé par chirurgie ou par radiothérapie, le choix étant dirigé principalement par celui du traitement de la tumeur. En cas de traitement chirurgical, un évidement sélectif des zones II, III et IV pour les patients N0 sera réalisé, et pour les autres un évidement radical modifié en adaptant les structures à sacrifier aux contraintes anatomiques imposées par les adénopathies.
- En cas d’exérèse R1 (limites de la pièce opératoire microscopiquement envahies) après une chirurgie partielle laryngée par voie externe ou par voie endoscopique, la proposition du traitement complémentaire revient à la Réunion de Concertation Pluridisciplinaire (RCP) après relecture de l’anatomo-pathologie. Les différents choix possibles sont :
- Soit poursuivre le traitement par une radiothérapie externe (qui risque d’amputer les résultats fonctionnels de la laryngectomie partielle, voire de mener à la nécessité d’une chirurgie totale « fonctionnelle »),
- Soit proposer au patient la mutilation par une chirurgie totale du larynx avec le risque important d’obtenir une pièce opératoire saine à l’examen définitif,
- Ou enfin opter pour une surveillance « rapprochée » du patient, qui n’est possible que si celui-ci est compliant au suivi.
- En cas d’exérèse R0 mais avec un envahissement ganglionnaire important (adénopathie en rupture capsulaire ou au moins 3 ganglions envahis), une radiothérapie post-opératoire sera réalisée en minimisant autant que possible la dose reçue par le larynx restant.
- La radiothérapie peut ne pas être réalisée en post-opératoire après une laryngectomie totale en cas de résultat histologique plus favorable qu’attendu, notamment en l’absence d’atteinte cartilagineuse faisant reclasser la tumeur pT3 pN0, et en l'absence de facteur de risque de rechute (pas d'embole vasculaire ni d'engainement périnerveux).
- Pour les tumeurs T1N0 du plan glottique, une irradiation exclusive limitée au plan glottique est une alternative à la chirurgie permettant d'obtenir un contrôle local identique (Baird, 2018). Classiquement, la dose recommandée est de 66 Gy en 33 fractions pour les tumeurs T1a et 70 Gy en 35 fractions pour les tumeurs T1b et T2N0. Cependant, les traitements hypofractionnés sont de plus en plus utilisés du fait de leur tolérance. Le NCCN recommande une dose de 63 Gy en 28 fractions, voir 50 à 52 Gy en 16 fractions (Gowda, 2003).
- Dans les autres cas, l’ensemble du larynx est irradié ainsi que les aires II, III, IV bilatérales à une dose de 50 Gy en 25 séances avec un complément de dose sur la tumeur et les adénopathies (GTV) jusqu’à une dose de 70 Gy. Autour du GTV seront ajoutés plusieurs marges géométriques (CTV à haut risque et bas risque, PTV) selon les recommandations internationales validant l'approche dite géométrique (Grégoire, 2018). Le choix des aires ganglionnaires à irradier dépend des aires ganglionnaires atteintes (Biau, 2019). La technique d'irradiation recommandée par l'HAS est la radiothérapie conformationnelle avec modulation d'intensité (RCMI ou IMRT) (Haute Autorité de Santé, Procédures de radiothérapie externe. Saint-Denis La Plaine: HAS; 2008).
- La préservation laryngée s’adresse aux patients présentant un carcinome épidermoïde du larynx pour lequel le traitement chirurgical serait une laryngectomie totale. Actuellement, aucune étude de préservation laryngée n’a montré de gain en survie globale par rapport à une laryngectomie totale suivie de radiothérapie post-opératoire.
- L’objectif des traitements, radiothérapie et chimiothérapie, est d’éviter ce geste chirurgical, avec le même contrôle loco-régional et la même survie, ainsi qu’une fonction laryngo-oesophagienne optimale pour les patients qui présentent une tumeur T3 du larynx relevant d’une laryngectomie totale. En effet, il est important de prendre en considération la notion de survie sans laryngectomie avec un larynx fonctionnel, sans sonde d’alimentation et sans trachéotomie.
- Les premiers essais de préservation laryngée (Wolf, 1991 ; Richard, 1998) (NP1) étaient des études d’équivalence et randomisaient les patients présentant un cancer du larynx, soit dans un bras chirurgie suivie de radiothérapie, soit dans un bras chimiothérapie d’induction (Cisplatine, 5-Fluoro-uracile (5-FU)) suivie de radiothérapie en cas de bonne réponse.
- L’étude de l’EORTC (Lefebvre, 1996) (NP1) concernait des tumeurs de l’hypopharynx. Une méta-analyse a été effectuée sur ces 3 études concernant 602 patients. Les taux de survie n’étaient pas statistiquement différents, mais 58 % des patients en vie avaient un larynx en place (Lefebvre,1998) (NP2).
- Secondairement, l’étude du RTOG 91-11 (Forastière, 2013) (NP1) randomisait les patients présentant une tumeur du larynx, en trois bras :
- chimiothérapie d’induction par cisplatine et 5-FU suivie de radiothérapie,
- versus chimiothérapie concomitante à la radiothérapie avec cisplatine,
- versus radiothérapie exclusive.
Après un suivi médian de 10 ans, le taux de préservation laryngée (PL) était significativement supérieur dans le bras concomitant : 81,7 % versus 67,5 % pour le bras chimiothérapie d’induction et 63,8 % pour le bras radiothérapie seule. La survie globale et la survie sans laryngectomie n’étaient pas différentes entre les bras chimiothérapie d’induction et radiochimiothérapie concomitante. Cependant, les courbes de survie se séparaient après 4,5 ans de suivi, en faveur du bras induction. Un nombre plus important de décès « non liés au cancer » a été retrouvé dans le bras concomitant.
- Deux études de phase III ont montré la supériorité du protocole Docétaxel, Cisplatine, 5-FU (TPF) par rapport à l’association Cisplatine + 5-FU (PF) (Vermorken, 2007 ; Posner, 2007) (NP1) :
- En premier lieu, l’étude GORTEC 2001-01 avec des taux de réponse élevés (80 %) après chimiothérapie d'induction par TPF et des taux de PL à 5 ans (74 % vs 58 %), chez des patients présentant des carcinomes du larynx et de l’hypopharynx stades III et IV sans différence en termes de survie globale et de survie sans progression (Janoray, 2015) (NP1).
- Sur la base de l’étude du RTOG, des sociétés savantes anglo-saxonnes recommandent une préservation laryngée par une association de radiothérapie et chimiothérapie concomitante (cisplatine 100 mg/m2 à J1, J22, J43 de la radiothérapie) (Forastière, 2018 ; Jones, 2016) (NP4).
Ce protocole entraîne plus d’effets secondaires immédiats (mucites) et de séquelles tardives pouvant compromettre la fonction laryngo-oesophagienne, mais améliore le taux de préservation laryngée (PL) par rapport à une chimiothérapie d’induction par platine et 5-FU.
- En France, l’attitude d’une chimiothérapie par 2 à 3 cycles de TPF suivie de radiothérapie en cas de bonne réponse est privilégiée, sur la base des résultats des études européennes. Cette chimiothérapie permet de sélectionner les patients répondeurs après les 3 cycles de chimiothérapie néoadjuvante. Elle permet d’opérer les patients en réponse insuffisante et de réaliser une radiothérapie post-opératoire adaptée.
- Une étude de phase III du GORTEC 2014-03 (Trial of Laryngeal Preservation Comparing Induced CT Followed by RT vs CT Concomitant to RT (SALTORL ou NCT03340896) est actuellement en cours comparant :
- une chimiothérapie d’induction par TPF suivie de radiothérapie en cas de bonne réponse,
- à un traitement par chimioradiothérapie concomitante (cisplatine).
L’objectif principal est d’évaluer la survie à 2 ans avec préservation de la fonction laryngée et œsophagienne. Les cycles de chimiothérapie sont réalisés toutes les 3 semaines. L’évaluation de la réponse après les 2 à 3 cycles de chimiothérapie comprend un examen clinique avec nasofibroscopie et un scanner cervico-facial. Si l’évaluation montre une régression d’au moins 50 % du volume tumoral et la récupération au moins partielle de la mobilité laryngée, le traitement est poursuivi par la radiothérapie.
- Après chimiothérapie d'induction par TPF, une chimioradiothérapie avec cisplatine concomitant et une radiothérapie sensibilisée par cetuximab ont été comparées chez les patients répondeurs dans l'essai de phase II TREMPLIN (Lefebvre, 2013). L'objectif principal était le taux de préservation laryngée (PL) à 3 mois. Il était similaire entre les deux bras ainsi que le taux de survie globale à 18 mois (92% et 89%). Cependant, il y avait plus de rechutes locales dans le bras cetuximab. En cas d’échec, avec une réponse inférieure à 50 % du volume tumoral ou la non-remobilisation du larynx, le geste chirurgical sera réalisé suivie de radiothérapie. Les tumeurs T4bNxM0, dont les extensions ne permettent pas de réaliser une laryngectomie totale avec résection R0 sont traitées par radiothérapie potentialisée par le cisplatine, délivrant 70 Gy en 35 séances sur le lit tumoral.
- La préservation laryngée est la seule indication de chimiothérapie néoadjuvante dans les cancers du larynx opérables non métastatiques (avis d’experts).
- Il y a deux modalités de préservation laryngée :
- la radiochimiothérapie concomitante
- la chimiothérapie première avec décision en fonction de la réponse à la chimiothérapie chez les patients acceptant le principe d'une laryngectomie totale (avis d'experts).
- Des études en cours comparent ces deux modalités de prise en charge.
- Dans cette localisation le pronostic est moins bon (Laccourreye, 1990 ; Sessions, 2005 ; Rudert, 1999 ; Zeitels, 1995 ; Remacle, 2009 ; Doazan, 2018 ; Mendelsohn, 2013 ; Sykes, 2000 ; Hinerman, 2002 ; Nakfoor, 1998 ; Lee, 1990 ; De Santo, 1990) (NP3). La radiothérapie permet d’obtenir un bon contrôle local et, si la chirurgie par voie externe donne, dans certaines études rétrospectives, de meilleurs résultats dans cette indication (Hinerman, 2002) (NP4), elle n’est pas toujours réalisable. Encore une fois, la stratégie française est en principe de proposer le traitement chirurgical quand celui-ci est possible.
- Les petites lésions T1 du bord libre de l’épiglotte, du repli ary-épiglottique ou du ventricule peuvent être traitées par une laryngectomie endoscopique sus-glottique de type 1 (Remacle, 2009) (NP4) de la classification de l’ELS (Remacle, 2009). Les lésions de l’épiglotte peuvent être traitées par une épiglottectomie de type IIa. Les autres types de laryngectomies endoscopiques sus-glottiques décrites par l’ELS (Lawson, 2011) doivent être réservées à des patients sélectionnés et pratiquées par des équipes entraînées. L’alternative est de proposer une chirurgie partielle par voie externe.
et évidement ganglionnaire
- Une chirurgie endoscopique au laser ou à l’aide du robot peut donner des résultats carcinologiques équivalents réalisées par des chirurgiens expérimentés (Ambrosch, 2018) (NP4). Le choix dépend donc des habitudes des praticiens et de l’équipement disponible.
- La chirurgie endoscopique a des résultats équivalents à ceux de la chirurgie partielle laryngée par voie externe (Cabanillas, 2008 ; Karatzanis, 2010 ; Csanady, 2011) (NP3). Des lésions plus volumineuses peuvent être traitées par chirurgie endoscopique mais la nécessité d’un traitement complémentaire compromet les résultats fonctionnels dans ce cas. Les tumeurs T4a restent une indication de traitement chirurgical par voie externe (laryngectomie totale puis irradiation post-opératoire).
- Dans l’étude de Zhan et al. sur une large cohorte de 3826 patients traités soit par chirurgie (1913), soit par radiothérapie (1913), 627 patients présentaient une lésion sus-glottique stade 1 ou 2 et les deux modalités thérapeutiques présentaient des survies sans différence significative (Zhan, 2018) (NP2).
- La prise en charge ganglionnaire dans les lésions sus-glottiques est bilatérale ; seules les lésions strictement latéralisées peuvent bénéficier d’une prise en charge unilatérale (Ferlito, 2008 ; Djordjevic, 2016 ; Goudakos, 2009) (NP2).
- Il s'agit de la localisation laryngée de meilleur pronostic dans la large cohorte de Brandstorp Boesen (Brandstorp-Boesen, 2017) (NP3).
- Les lésions T in situ peuvent être contrôlées avec une cordectomie de type I. La récidive est fréquente (Remijn, 2002) (NP4) et les interventions itératives dégradent progressivement les résultats vocaux au-fur-et-à-mesure que la corde devient cicatricielle (Roh, 2007) (NP4). Dans tous les cas, l’accent doit être mis sur l’intérêt de l’arrêt complet du tabac.
- Pour les tumeurs T1a, limitées à une corde vocale, les possibilités thérapeutiques sont fonction de :
- L’exposition du larynx,
- L’état général du patient,
- Sa profession,
- Et son souhait.
- Deux possibilités thérapeutiques permettent le même taux de contrôle local :
- La cordectomie endoscopique laser : elle est recommandée si l’exposition du patient a été évaluée comme satisfaisante lors de l’endoscopie préalable, pour les tumeurs du plan glottique sans atteinte de la commissure antérieure. Ces cordectomies sont classifiées de type I à IV (Remacle, 2007).
- La radiothérapie limitée au plan glottique : elle donne les mêmes résultats oncologiques (Cabanillas, 2008) (NP3) ; (Bertino, 2015) (NP4) ; (De Santis, 2016) (NP2).
- La radiothérapie et la chirurgie semblent donner un résultat vocal similaire (Greulich, 2015) (NP2). Le traitement chirurgical par voie externe doit rester exceptionnellement proposé dans cette indication lorsqu'on opte pour un traitement chirurgical plutôt que pour une radiothérapie et que l’exposition n’est pas possible (Ahmed, 2017) (NP3).
- La radiothérapie hypofractionnée améliore le contrôle local pour les lésions T1 (Yamazaki, 2017) (NP4) et n’est, en tous cas, pas inférieure à la radiothérapie standard (Kodaira, 2018) (NP1).
- Pour les tumeurs T2 du plan glottique, en France, le traitement chirurgical est proposé en première intention quand il est possible. Ces tumeurs sont en principe accessibles à une chirurgie partielle par voie cervicale, définie en fonction de la localisation et des extensions tumorales (Laccourreye, 1987) (NP4).
- Si l’exposition du patient a été évaluée comme satisfaisante lors de l’endoscopie préalable, les chirurgies transorales au laser sont envisageables, mais leurs résultats carcinologiques varient d’une équipe à l’autre (Rudert, 1995 ; Motta, 1997 ; Pradhan, 2003) (NP4). Elles sont réservées aux chirurgiens rompus à la technique et à l'utilisation du matériel.
- Ce traitement chirurgical est proposé en priorité du fait du risque de seconde tumeur chez ces patients qui pourraient, dans ce cadre, être traités par radiothérapie (avis d’experts).
- Le traitement recommandé pour les tumeurs T3 relevant d’une laryngectomie totale est la préservation laryngée (Cf. moyens thérapeutiques).
- En cas de contre-indication à la préservation laryngée, la radiothérapie ou la chirurgie par laryngectomie totale est envisagée.
- La trachéotomie en urgence pré-thérapeutique entraîne souvent une indication de laryngectomie totale mais n’est pas une contre-indication absolue à un protocole de préservation laryngée. Il peut parfois être nécessaire de réaliser une trachéotomie avant traitement par radiothérapie (sous-glotte, lésion dyspnéïsante) (avis d’experts).
- Les lésions T4a traitées par chirurgie de type laryngectomie totale (LT) présentent une meilleure survie globale (SG) et survie spécifique (SS) à 5 ans que le groupe non chirurgical (radiochimiothérapie concomitante), mais pas un meilleur taux de contrôle local, dans la méta-analyse de Fu et al. sur 8308 patients (Fu, 2016) (NP2).
- Il n'y a pas de différence significative de survie globale ou spécifique pour des tumeurs T3. Cette large méta-analyse incluait néanmoins de nombreuses études rétrospectives (Fu, 2016) (NP2). Ces données de supériorité de la LT sur la radiochimiothérapie concomitante dans les T4a, ont été confirmées en 2015, sur une cohorte de 969 patients avec une SG de 61 mois versus 39 mois respectivement (p <0,001). Il y avait cependant plus de patients N2-N3 dans le groupe radiochimiothérapie dans cette étude (Grover, 2015) (NP2).
- Le traitement complémentaire par radiothérapie, après chirurgie, dans les lésions pT4a montre un bénéfice (HR : 0,57 ; 95 % CI, 0,45-0,71) qui n’est pas retrouvé dans les pT3, dans une analyse de cohorte de 1460 patients.
- Dans cette même analyse, seulement 80 % des patients avaient eu une LT et 50 % des patients pT4a ont eu une radiothérapie avec des doses hétérogènes (Graboyes, 2017) (NP2). L’étude de Stokes et al. confirme ses données sur 3542 patients, comparant chirurgie puis radiothérapie, radiochimiothérapie ou chimiothérapie d'induction pour les lésions T4N0M0. La survie globale est meilleure dans le groupe chirurgie plus radiothérapie (SG de 60,5 mois) versus radiochimiothérapie (SG de 32,5 mois) ou chimiothérapie d’induction (SG de 43,3 mois) (Stokes, 2017) (NP2).
- Pour les tumeurs T1b étendues aux deux cordes vocales, l’atteinte profonde de la commissure antérieure contre-indique classiquement l’emploi du laser. En effet, les rapports étroits de la tumeur avec le cartilage dans cette localisation, l’exposition malaisée de la zone, et la cicatrisation aboutissent en principe à une palmure antérieure responsable de résultats vocaux médiocres.
- La chirurgie endoscopique (cordectomie de type Va, traitement chirurgical en deux temps) peut parfois être proposée à la condition d’un envahissement très superficiel avec une muqueuse restant mobilisable par rapport au cartilage à l’endoscopie (avis d’experts). En cas d’envahissement plus profond de la commissure antérieure, l’alternative est de proposer une laryngectomie partielle par voie externe. En effet, dans l’étude d’Alkan et al. chez 54 patients présentant une tumeur T1 glottique avec atteinte de la commissure antérieure (38 T1a + T1b traités par radiothérapie et 16 T1a + T1b traités par endoscopie), les auteurs ont montré un contrôle local à 5 ans de 75 % pour la chirurgie versus 97 % par radiothérapie, une survie globale (SG) de respectivement 87,5 % et 78,9 %. Les différences de survie observées n’étaient pas significatives même si le taux de récidive était significativement plus élevé dans le groupe chirurgie (37,5 % versus 13,2 %) (Alkan, 2017) (NP4).
- La radiothérapie externe semble donner de meilleurs résultats carcinologiques an cas d'atteinte de la commissure antérieure (Alkan, 2017) (NP4) et est donc le traitement recommandé en première intention.
-
Cette localisation est rarement isolée, rapportée de 1 à 7,7 % des cas selon les séries (Brandstorp-Boesen, 2017) (NP3) ; (Mac Neil, 2018) (NP4) ; (Smee, 2013) (NP4). Elle est plus souvent associée à la localisation glottique. Elle est diagnostiquée à un stade avancé (III et IV) dans 50 à 64 % des cas. La lymphophilie est également variable et concerne également les aires prélaryngées et récurrentielles (4 % à 21,2 %) (Mac Neil, 2018 ; Smee, 2013) (NP4).
-
La supériorité d’une modalité combinée dans les stades avancés (laryngectomie totale suivie de radiothérapie ou radiochimiothérapie dans les formes limitées ou superficielles) par rapport à une modalité unique de traitement, privilégiée dans les stades précoces (radiothérapie ou radiochimiothérapie), semble validée par une récente revue de la littérature (Coskun, 2019) (NP4).
- Tous les patients avec un T1 ou un T2 doivent être traités en première intention par une modalité thérapeutique conservatrice du larynx. Pour les tumeurs de stade précoce, la chirurgie par voie transorale ou la radiothérapie sont privilégiées par rapport aux laryngectomies par voie externe (grade B).
- Pour ces tumeurs T1 T2, toutes les études ont montré un taux de survie, une qualité vocale et une déglutition similaire pour une approche chirurgicale endoscopique ou une radiothérapie. Le choix entre une radiothérapie externe ou une chirurgie endoscopique est décidé en fonction de la tumeur et du patient (choix et comorbidités) (grade B).
- Tous les efforts doivent être mis en œuvre pour éviter de combiner une chirurgie partielle et une radiothérapie (grade C).
- Si une prise en charge chirurgicale est réalisée, en cas de marges histologiques non saines, une reprise chirurgicale possible est préférable à une radiothérapie adjuvante pour ne pas compromettre les résultats fonctionnels, la surveillance rapprochée peut également se discuter (avis d’experts).
- Le principal objectif de la préservation d’organe dans le cadre des cancers laryngés est de maximiser les chances de survie tout en préservant la voix et la déglutition (grade A).
- Prise en charge ganglionnaire :
- L’envahissement ganglionnaire pour les T1-T2 glottiques est rare. Les tumeurs T1 N0 glottique, ne nécessitent pas une prise en charge ganglionnaire cervicale (grade A).
- Les tumeurs sus et sous glottiques nécessitent une prise en charge cervicale ganglionnaire suivant les mêmes modalités que pour la tumeur (grade A).
- Place de la chirurgie partielle par voie externe par Laryngectomie Partielle Supra-Cricoïdienne (LPSC) : La LPSC garde des indications dans certains T2 inaccessibles à une chirurgie transorale et de mauvais pronostic et pour des T3 très sélectionnés (grade B). Cela est notamment vrai pour des tumeurs infiltrantes de la commissure antérieure.
- Les indications à un protocole de préservation laryngée sont les cancers épidermoïdes du larynx, non métastatique, dont le traitement chirurgical nécessiterait une laryngectomie totale à la condition qu’elle soit réalisable : T2 non accessible à une chirurgie partielle, T3 sans infiltration massive de l’endolarynx pour une lésion trans-glottique. La nécessité d’une trachéotomie d’emblée avant traitement est une contre-indication relative à une tentative de préservation laryngée et est adaptée au cas par cas (avis d’experts).
- A trois mois après la fin du traitement par préservation laryngée :
- En cas de résidu au niveau de la tumeur primitive, il y a une indication de chirurgie laryngée de rattrapage (grade A).
- En cas de reliquat ganglionnaire isolé avec un contrôle de la tumeur primitive, un geste ganglionnaire est indiqué (grade A).
- Le traitement des tumeurs T4a est la laryngectomie totale avec évidement cervical bilatéral (grade A).
- La littérature différencie les récidives après traitement conservateur (radiothérapie ou radiochimiothérapie) et celles après chirurgie (endoscopique ou par voie externe). Il apparaît que celles-ci peuvent être prises en charge par les trois modalités chirurgicales différentes suivantes : chirurgie transorale endoscopique, chirurgie partielle ou chirurgie radicale (LT) par voie externe mais également par radiothérapie en cas de prise en charge première par chirurgie.
- Après échec d’une préservation laryngée par radiochimiothérapie, le traitement de rattrapage est la laryngectomie totale si elle est réalisable et en dehors de la présence de métastases (De Virgilio, 2016) (NP4).
- Pour les récidives post-chirurgie partielle, la stratégie en rattrapage dépend de la modalité de la chirurgie première. Une voie externe aura modifié les barrières anatomiques et le rattrapage sera préférentiellement une LT.
- Dans les récidives localisées rT1 ou rT2, dans le cas de patients exposables et dont le bilan identifie une lésion bien limitée, la chirurgie endoscopique par voie transorale de rattrapage est une alternative possible si elle peut garantir une exérèse complète (Abouyared, 2014 ; Del Bon, 2012) (NP4).
- Pour les récidives importantes rT3 rT4, le traitement de rattrapage est une laryngectomie totale. Dans une méta-analyse publiée par Hasan et al. incluant un total de 3292 patients ayant bénéficié d’une laryngectomie totale de rattrapage, il a été rapporté un taux de complications post-opératoires de près de 70 %, celles-ci étant dominées par les fistules salivaires (près de 30 % des cas) (Hasan, 2017) (NP1). Ces complications étaient associées non-significativement à la réalisation d’un curage cervical, mais une majorité des études de la méta-analyse ne rapportait pas les modalités de réalisation du curage (uni- ou bilatéral, fonctionnel ou radical). Une précédente méta-analyse concernant le taux de fistule salivaire dans les laryngectomies avait, quant à elle, rapporté une association significative de celles-ci avec la réalisation d’un curage, résultat également rapporté par plusieurs études rétrospectives de moindre niveau de preuve (Paydarfar, 2006 ; Van Der Putten, 2011 ; Basheeth, 2014) (NP4).
- Les études rapportant les résultats de la préservation laryngée chirurgicale dans ces situations de rattrapage, en particulier de la Laryngectomie Partielle Supra-Cricoïdienne (LPSC) montrent des résultats oncologiques et fonctionnels très variables et les effectifs de ces travaux sont faibles. Les études sont rétrospectives avec un faible niveau de preuve (Deganello, 2008 ; Pellini, 2008 ; De Vincentiis, 2015) (NP4).
- Ces chirurgies partielles par voie externe, dans ce contexte de rattrapage, doivent donc être réservées à des patients très sélectionnés, en récidive classée rT1 ou rT2, sans comorbidité cardio-pulmonaire et avec des équipes entraînées (Philippe, 2014) (NP4). La laryngectomie totale de rattrapage reste, dans la littérature, la principale chirurgie réalisée dans ce contexte de récidive avec des taux de Survie Spécifique (SS) qui sont acceptables, de 58 % à 5 ans, dans le cadre d’un rattrapage après traitement par radiochimiothérapie selon Van Der Putten et al. (Van Der Putten, 2011) (NP4).
- Chez De Virgilio, le taux de SG à 5 ans varie de 38 % à 52 % dans le cas d’un rattrapage après chirurgie partielle laryngée par voie externe et chirurgie transorale endoscopique respectivement (Van Der Putten, 2011 ; De Virgilio, 2016) (NP4). Les récidives péri-trachéostomiales après laryngectomie totale sont de pronostic sombre, avec une survie globale (SG) à 2 ans de 10 % et une survie médiane à 7 mois (Ampil, 2009) (NP4).
Ces atteintes semblent plus fréquentes dans les lésions sous-glottiques, avec envahissement ganglionnaire médiastinal (45 patients) versus l’absence d’envahissement (23 patients) dans le travail de Dogan et al. (Dogan, 2014) (NP4), dans les atteintes transglottiques et les trachéotomies préopératoires, le taux de mortalité est élevé, de 80 % à 2 ans. Dans cette indication, l’intérêt de deux modalités de curiethérapie (à dose pulsée ou à haute dose) a été analysé avec un taux de réponse à 6 mois partielle ou complète de 20 % et un taux de survie à 2 ans de 22 % (Bartochowska, 2013) (NP4).
- La prise en charge ganglionnaire en rattrapage reste controversée. L’envahissement ganglionnaire occulte dans les cous cN0 est estimé, après chirurgie de rattrapage par laryngectomie partielle ou totale, entre 0 et 30,5% (Birkeland, 2016 ; Freiser, 2016 ; Sandulache, 2016 ; Li, 2013) (NP4). Les lésions rT4 et de localisations sus-glottiques sont prédictives d’un envahissement ganglionnaire occulte et préférentiellement dans les zones II et III (localisations sus-glottiques) et en paratrachéal (localisations glottiques) (Birkeland, 2016) (NP4).
- Deganello et al. ne retrouvent aucune métastase occulte dans leur série de 110 patients traités par chirurgie de rattrapage après échec d’une radiothérapie sur des lésions T1 ou T2 du larynx. Dans ce travail, la réalisation d’un évidement cervical uni- ou bilatéral semblait significativement augmenter le risque de fistule (57,2% versus 13,4 % ; p = 0,01) mais seulement 7 patients rcN0 avaient eu un évidement et 97 patients étaient surveillés.
Les auteurs conseillaient de ne pas réaliser d’évidement cervical quel que soit le T pour une récidive glottique (Deganello, 2014) (NP4). De plus, aucun gain significatif sur la survie globale (SG) ou la survie sans récidive (SSR) n’était observé lorsqu’un évidement était réalisé en contexte de rattrapage et nécessite donc de prendre la décision au cas par cas (Freiser, 2016 ; Deganello, 2008) (NP4).
- Au total, il apparaît, qu’à partir de la littérature sur la chirurgie de rattrapage, certains éléments peuvent être rappelés. Le traitement de lésions de stades précoces (rT1 et rT2) pour des patients exposables avec des lésions bien limitées peuvent être traitées par chirurgie endoscopique ou dans des cas sélectionnés (âge jeune <70 ans, pas de comorbidité) par chirurgie partielle par voie externe. Les lésions de stades avancées (rT3 et rT4) doivent être traitées par LT avec couverture par lambeau pédiculé (Guimaraes, 2016) (NP4).
- Pour les patients en récidive d’une tumeur laryngée, dans le cas où une chirurgie endoscopique a été réalisée en première intention, une radiothérapie peut être proposée (grade C).
- Il est recommandé de proposer une prise en charge chirurgicale, si possible, par chirurgie endoscopique dans les récidives classées rT1. La chirugie partielle laryngée post-radique par voie externe doit faire l’objet de discussion en RCP et d’information du patient du fait d’un risque élevé de complications et de séquelles fonctionnelles (grade C). Chez les patients ayant été irradiés si une laryngectomie partielle est impossible, il est recommandé de proposer une laryngectomie totale de rattrapage (grade C).
- Pour les patients en récidive d’une tumeur laryngée, il n’y a pas d’indication à la réalisation d’un évidement cervical pour les récidives classées rT1, rT2 N0 s'il n’y a pas d’atteinte ganglionnaire sur l’imagerie (grade C). S'il y a une atteinte ganglionnaire en imagerie au niveau cervical, il est recommandé de réaliser un évidement ganglionnaire (grade C). Pour les récidives classées rT3, rT4 et N0, l’indication d’un évidement doit être discutée au cas par cas (avis d’experts).
- Abouyared M, Ojo R, Fundakowski C, Lo K et al.
Transoral laser microsurgery in previously irradiated patients with laryngeal cancer.
Am J Otolaryngol. 2014 ; 35 : 279-85.
- Ahmed J, Ibrahim ASG, M Freedman L, Rosow DE.
Oncologic outcomes of KTP laser surgery versus radiation for T1 glottic carcinoma.
- Alkan U, et al.
T1 squamous cell carcinoma of the glottis with anterior commissure involvement : Radiotherapy versus transoral laser microsurgery.
Head Neck, 2017. 39 : p.1101-1105.
- Ambrosch P, et al.
Transoral Laser Microsurgery for Supraglottic Cancer.
Front Oncol, 2018 ; 8 : p.158.
- American Society of Clinical Oncology et al.
American Society of Clinical Oncology clinical practice guideline for the use of larynx-preservation strategies in the treatment of laryngeal cancer.
J Clin Oncol, 2006 ; 24 : p. 3693-704.
- Ampil F, Ghali G, Caldito G, Baluna R.
Post-laryngectomy stomal cancer recurrences, re-treatment decisions and outcomes: case series.
J Craniomaxillofac Surg. 2009 ; 37 : 349-51.
- Baird BJ, Sung CK, Beadle BM, Divi V.
Treatment of early-stage laryngeal cancer: A comparison of treatment options.
-
Bartochowska A, Skowronek J, Wierzbicka M, Leszczyńska M et al.
The role of high-dose-rate and pulsed-dose-rate brachytherapy in the management of recurrent or residual stomal tumor after total laryngectomy.
Laryngoscope. 2013 ; 123 : 657-61.
-
Basheeth N, O’Leary G, Sheahan P.
Pharyngocutaneous fistula after salvage laryngectomy: impact of interval between radiotherapy and surgery, and performance of bilateral neck dissection.
Head Neck. 2014 ; 36 : 580–4.
- Bergström L, Ward EC, Finizia C.
Voice rehabilitation after laryngeal cancer: Associated effects on psychological well-being.
Support Care Cancer 2017 ; 25 : 2683–2690.
- Bertino G, Degiorgi G, Tinelli C, Cacciola S.
CO₂ laser cordectomy for T1-T2 glottic cancer: oncological and functional long-term results.
Eur Arch Otorhinolaryngol. 2015 ; 272 : 2389-95.
- Bhattacharyya T, Kainickal CT.
Current Status of Organ Preservation in Carcinoma Larynx.
World J Oncol. 2018 ; 9 : 39-45.
- Biau, Julian et al.
Selection of lymph node target volumes for definitive head and neck radiation therapy: a 2019 Update.
-
Birkeland AC, Rosko AJ, Issa MR, Shuman AG et al.
Occult Nodal Disease Prevalence and Distribution in Recurrent Laryngeal Cancer Requiring Salvage Laryngectomy.
Otolaryngol Head Neck Surg. 2016 ; 154 : 473-9.
- Bonfils P., Chevallier J.M.
Anatomie tome 3 ORL.
Editeur Lavoisier MSP, 4ème édition 10/2017.
-
Brandstorp-Boesen J, Sørum Falk R, Boysen M, Brøndbo K.Impact of stage, management and recurrence on survival rates in laryngeal cancer.
-
Brumund, Kevin T et al.Frontolateral vertical partial laryngectomy without tracheotomy for invasive squamous cell carcinoma of the true vocal cord: a 25-year experience.
-
Cabanillas R, Rodrigo JP, Llorente JL, Suárez C.Oncologic outcomes of transoral laser surgery of supraglottic carcinoma compared with a transcervical approach.
-
Chiesa Estomba CM, Betances Reinoso FA, Velasquez AO, Rodriguez Fernandez JL.
Complications in CO2 Laser Transoral Microsurgery for Larynx Carcinomas.
Int Arch Otorhinolaryngol. 2016 ; 20 : 151–155.
-
Coskun H, Mendenhall WM, Rinaldo A, Rodrigo JP et al.
Prognosis of subglottic carcinoma: Is it really worse?
Head Neck. 2019 ; 41 : 511-521.
-
Csanady M, Czigner J, Vass G.
Transoral CO2 laser management for selected supraglottic tumors and neck dissection.
Eur Arch Otorhinolaryngol. 2011 ; 268 : 1181–1186.
-
De Monès E, Vergez S, Barry B, Righini C et al; French Society of Otorhinolaryngology.
Initial staging for squamous cell carcinoma of the mouth, larynx and pharynx (except nasopharynx). Part 3: general assessment. 2012 SFORL recommendations.
Eur Ann Otorhinolaryngol Head Neck Dis. 2013 ; 130 : 165-72.
-
De Santis RJ, Poon I, Lee J, Karam I.
Comparison of survival between radiation therapy and trans-oral laser microsurgery for early glottic cancer patients; a retrospective cohort study.
J Otolaryngol Head Neck Surg. 2016 ; 45 : 42.
- De Santo LW.
Early supraglottic cancer.
Ann Otol Rhinol Laryngol, 1990. 99 : p.593-7.
- De Vincentiis M, De Virgilio A, Bussu F, Gallus R et al.
Oncologic results of the surgical salvage of recurrent laryngeal squamous cell carcinoma in a multicentric retrospective series: emerging role of supracricoid partial laryngectomy.
Head Neck. 2015 ; 37 : 84-91.
- De Virgilio A, Greco A, Bussu F, Gallo A.
Salvage total laryngectomy after conservation laryngeal surgery for recurrent laryngeal squamous cell carcinoma.
Acta Otorhinolaryngol Ital. 2016 ; 36 : 373-380.
- Decotte A, Woisard V, Percodani J, Pessey JJ et al.
Respiratory complications after supracricoid partial laryngectomy.
Eur Arch Otorhinolaryngol. 2010 ; 267 : 1415-21.
- Deganello A, Gallo O, De Cesare JM, Ninu MB et al.
Supracricoid partial laryngectomy as salvage surgery for radiation therapy failure.
Head Neck. 2008 ; 30 : 1064-71.
- Deganello A, Meccariello G, Bini B, Paiar F et al.
Is elective neck dissection necessary in cases of laryngeal recurrence after previous radiotherapy for early glottic cancer?
J Laryngol Otol. 2014 ; 128 : 1089-94.
-
Del Bon F, Piazza C, Mangili S, Redaelli De Zinis LO et al.
Transoral laser surgery for recurrent glottic cancer after radiotherapy: oncologic and functional outcomes.
Acta Otorhinolaryngol Ital. 2012 ; 32 : 229-37.
-
Djordjevic V, Bukurov B, Arsovic N, Dimitrijevic M et al.
Prospective case–control study of efficacy of bilateral selective neck dissection in primary surgical treatment of supraglottic laryngeal cancers with clinically negative cervical findings (N0).
Clin. Otolaryngol. 2016, 41, 634–639.
-
Doazan M et al
Oncologic outcomes with transoral robotic surgery for supraglottic squamous cell carcinoma: Results of the French Robotic Surgery Group of GETTEC.
Head Neck, 2018. 40 : p.2050-2059.
-
Dogan E, Yuksel Aslier NG, Cetinayak HO, Erdag TK et al.
Elective superior mediastinal dissection for laryngeal carcinoma involving subglottis.
Acta Otolaryngol. 2014 ; 134 : 1275-80.
-
Ferlito A, Silver CE, Rinaldo A.Selective neck dissection (IIA, III): a rational replacement for complete functional neck dissection in patients with N0 supraglottic and glottic squamous carcinoma.
-
Ferlito A. et al.
Surgical treatment of the neck in cancer of the larynx.
ORL J Otorhinolaryngol Relat Spec. 2000 ; 62 : p. 217-25.
- Forastiere AA, Zhang Q, Weber RS, Maor MH et al
Long term results of RTOG 91-11: a comparison of three nonsurgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer.
J Clin Oncol. 2013 ; 31 : 845-52.
- Forastiere AA, et al.
Use of Larynx-Preservation Strategies in the Treatment of Laryngeal Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update.
J Clin Oncol. 2018 ; 36 : p.1143-1169.
-
Freiser ME, Ojo RB, Lo K, Saint-Victor S et al.
Complications and oncologic outcomes following elective neck dissection with salvage laryngectomy for the N0 neck.
- Fu X, Zhou Q, Zhang X.
Efficacy Comparison Between Total Laryngectomy and Nonsurgical Organ-Preservation Modalities in Treatment of Advanced Stage Laryngeal Cancer: A Meta-Analysis.
-
Gallo O, Fini-Storchi I, et Napolitano L.
Treatment of the contralateral negative neck in supraglottic cancer patients with unilateral node metastases (N1-3).
Head Neck, 2000. 22 : p.386-92.
- Ganly I et al.
Analysis of postoperative complications of open partial laryngectomy.
Head Neck, 2009. 31 : p.338-45.
-
Gorphe P.
A Contemporary Review of Evidence for Transoral Robotic Surgery in Laryngeal Cancer.
Front Oncol. 2018 ; 8 : 121.
-
Goudakos JK, Markou K, Nikolaou A, Themelis C, Vital V.
Management of the clinically negative neck (N0) of supraglottic laryngeal carcinoma : a systematic review.
Eur J Surg Oncol. 2009 ; 35 (3) : 223-229.
-
Gowda RV, Henk JM, Mais KL, Sykes AJ, Swindell R, Slevin NJ.Three weeks radiotherapy for T1 glottic cancer: the Christie and Royal Marsden Hospital Experience.
- Graboyes E.M., Zhan K.Y., Garrett-Mayer E., Lentsch E.J et al.
Effect of Postoperative Radiotherapy on Survival for Surgically Managed pT3N0 and pT4aN0 Laryngeal Cancer: Analysis of the National Cancer Data Base.
Cancer. 2017 ; 15 : 2248-2257.
- Grégoire V, Evans M, Le QT, et al.
Delineation of the primary tumour Clinical Target Volumes (CTV-P) in laryngeal, hypopharyngeal, oropharyngeal and oral cavity squamous cell carcinoma: AIRO, CACA, DAHANCA, EORTC, GEORCC, GORTEC, HKNPCSG, HNCIG, IAG-KHT, LPRHHT, NCIC CTG, NCRI, NRG Oncology, PHNS, SBRT, SOMERA, SRO, SSHNO, TROG consensus guidelines.
- Greulich MT, Parker NP, Lee P, Merati AL, Misono S.
Voice outcomes following radiation versus laser microsurgery for T1 glottic carcinoma : systematic review and meta-analysis.
-
Grover S, Swisher-McClure S, Mitra N, et al.
Total Laryngectomy Versus Larynx Preservation for T4a Larynx Cancer : Patterns of Care and Survival Outcomes.
Int J Radiat Oncol Biol Phys. 2015 ; 92 (3) : 594-601.
- Guimarães AV, Aires FT, Dedivitis RA, et al.
Efficacy of pectoralis major muscle flap for pharyngocutaneous fistula prevention in salvage total laryngectomy : A systematic review.
-
Hasan Z, Dwivedi RC, Gunaratne DA, Virk SA et al.
Systematic review and meta-analysis of the complications of salvage total laryngectomy.
Eur J Surg Oncol. 2017 ; 43 : 42–51.
- Haute Autorité de Santé.
Procédures de radiothérapie externe.
-
Hinerman RW, et al.Carcinoma of the supraglottic larynx: treatment results with radiotherapy alone or with planned neck dissection.
Head Neck. 2002 ; 24 : p.456-67.
- Janoray G, Pointreau Y, Garaud P, et al.
Long-term Results of a Multicenter Randomized Phase III Trial of Induction Chemotherapy With Cisplatin, 5-fluorouracil, ± Docetaxel for Larynx Preservation.
- Jones TM, De M, Foran B, Harrington K et al.
Laryngeal cancer : United Kingdom National Multidisciplinary Guidelines.
J Laryngol Otol. 2016 ; 130 : S75-S82.
-
Karatzanis AD, Psychogios G, Zenk J, et al.Evaluation of available surgical management options for early supraglottic cancer.
-
Kodaira T, Kagami Y, Shibata T, et al.Results of a multi-institutional, randomized, non-inferiority, phase III trial of accelerated fractionation versus standard fractionation in radiation therapy for T1-2N0M0 glottic cancer: Japan Clinical Oncology Group Study (JCOG0701).
-
Laccourreye H, Brasnu DF, et Beutter P.
Carcinoma of the laryngeal margin.
Head Neck Surg. 1983 ; 5 : p.500-7.
- Laccourreye H, et al.
Partial supracricoid laryngectomy : Technics, indications and results.
Ann Otolaryngol Chir Cervicofac. 1987 ; 104 : p.163-73.
-
Laccourreye H, et al.
Supracricoid laryngectomy with cricohyoidopexy: a partial laryngeal procedure for selected supraglottic and transglottic carcinomas.
Laryngoscope. 1990 ; 100 : p.735-41.
- Lawson G, et al.
Transoral robotic surgery for the management of head and neck tumors: learning curve.
Eur Arch Otorhinolaryngol. 2011 ; 268 : p.1795-801.
- Lee NK, Goepfert H, et Wendt CD.
Supraglottic laryngectomy for intermediate-stage cancer: U.T. M.D. Anderson Cancer Center experience with combined therapy.
Laryngoscope. 1990 ; 100 : p.831-6.
-
Lefebvre et al.
Meta-analysis of chemotherapy in head and neck cancer : Larynx preservation using neoadjuvant chemotherapy in laryngeal and hypopharyngeal carcinomas.
Proc Am soc clin oncol 17, 1473, 1998.
-
Lefebvre JL, Chevalier D, Luboinski B, Kirkpatrick A et al.
Larynx preservation in piriform sinus cancer: preliminary results of a European Organization for Research and Treatment of Cancer phase III trial.EORTC Head and Neck Cancer Cooperative Group.
J Natl Cancer Inst. 1996 ; 88 : 890-9.
-
Lefebvre JL, Pointreau Y, Rolland F, et al.Induction chemotherapy followed by either chemoradiotherapy or bioradiotherapy for larynx preservation: the TREMPLIN randomized phase II study
-
Li M, Lorenz RR, Khan MJ, Burkey BB et al.
Salvage laryngectomy in patients with recurrent laryngeal cancer in the setting of nonoperative treatment failure.
-
Mac Neil SD, Patel K, Liu K, Shariff S et al.
Survival of patients with subglottic squamous cell carcinoma.
Current Oncology. 2018 ; Vol. 25, No. 6.
-
Matsuo JM, Patel SG, Singh B, Wong RJ et al.
Clinical nodal stage is an independently significant predictor of distant failure in patients with squamous cell carcinoma of the larynx.
Ann Surg. 2003 ; 238 : 412-21.
-
Mendelsohn AH et al.
Outcomes following transoral robotic surgery: supraglottic laryngectomy.
Laryngoscope. 2013 ; 123 : p.208-14.
-
Mendenhall W.M.et al.
Management of T1-T2 glottic carcinomas.
Cancer. 2004 ; 100 : p.1786-92.
-
Meulemans J, Bijnens J, Delaere P, Vander Poorten V.
Up-Front and Salvage Transoral Laser Microsurgery for Early Glottic Squamous Cell Carcinoma: A Single Centre Retrospective Case Series.
Front Oncol. 2018 ; 8 : 186.
-
Motta G, et al.
T1-T2-T3 glottic tumors: fifteen year’s experience with CO2 laser.
Acta Otolaryngol Suppl,.1997 ; 527 : p.155-9.
-
Nakfoor BM, et al.
Results of accelerated radiotherapy for supraglottic carcinoma: a Massachusetts General Hospital and Massachusetts Eye and Ear Infirmary experience.
Head Neck. 1998 ; 20 : p.379-84.
-
Obid R, Redlich M, Tomeh C.
The Treatment of Laryngeal Cancer.
Oral Maxillofac Surg Clin North Am. 2019 ; 31 : p.1-11.
-
Paydarfar JA, Birkmeyer NJ.
Complications in head and neck surgery: a meta-analysis of postlaryngectomy pharyngocutaneous fistula.
Arch Otolaryngol Head Neck Surg. 2006 ; 132 : 67–72.
-
Pellini R, Pichi B, Ruscito P, Ceroni AR et al.
Supracricoid partial laryngectomies after radiation failure: a multi-institutional series.
Head Neck. 2008 ; 30 : 372-9.
-
Philippe Y, Espitalier F, Durand N, Ferron C et al.
Partial laryngectomy as salvage surgery after radiotherapy: oncological and functional outcomes and impact on quality of life. A retrospective study of 20 cases.
Eur Ann Otorhinolaryngol Head Neck Dis. 2014 ; 131 : 15-9.
-
Posner MR, Hershock DM, Blajman CR, Mickiewicz E et al, TAX 324 Study Group.
Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer.
N Engl J Med. 2007 ; 357 : 1705-15.
-
Pradhan SA et al.
Transoral laser surgery for early glottic cancers.
Arch Otolaryngol Head Neck Surg. 2003 ; 129 : p.623-5.
-
Remacle M, Van Haverbeke C, Eckel H, Bradley P et al.
Proposal for revision of the European Laryngological Society classification of endoscopic cordectomies.
Eur Arch Otorhinolaryngol. 2007 ; 264 : 499-504.
-
Remacle M. et al.
Endoscopic supraglottic laryngectomy : a proposal for a classification by the working committee on nomenclature, European Laryngological Society.
Eur Arch Otorhinolaryngol. 2009 ; 266 : p.993-8.
-
Remacle M et al.
Endoscopic partial supraglottic laryngectomies : techniques and results.
Otolaryngol Head Neck Surg, 2009. 141 : p.374-81.
-
Remijn EE, Marres HA, et van den Hoogen FJ.
Endoscopic laser treatment in pre-malignant and malignant vocal fold epithelial lesions.
J Laryngol Otol, 2002. 116 : p.1019-24.
-
Richard JM, Sancho-Garnier H, Pessey JJ, Luboinski B et al.
Randomized trial of induction chemotherapy in larynx carcinoma.
Oral oncol 1998 ; 34 : 224-8.
-
Roh JL, et al.
Quality of life and voice in patients after laser cordectomy for Tis and T1 glottic carcinomas.
Head Neck. 2007 ; 29 : p.1010-6.
-
Rudert HH, Werner JA.Endoscopic resections of glottic and supraglottic carcinomas with the CO2 laser.
-
Rudert HH, Werner JA and Hoft S.
Transoral carbon dioxide laser resection of supraglottic carcinoma.
Ann Otol Rhinol Laryngol, 1999. 108 : p.819-27.
-
Sandulache VC, Vandelaar LJ, Skinner HD, Cata J et al.
Salvage total laryngectomy after external-beam radiotherapy: A 20-year experience.
Head Neck. 2016 ; 38 Suppl 1 : E1962-8.
-
Sessions DG, Lenox J and Spector GJ.
Supraglottic laryngeal cancer: analysis of treatment results.
Laryngoscope, 2005. 115 : p.1402-10.
-
Smee RI, Williams JR, Broadley K, Bridger GP.Early glottic carcinoma treated by radiotherapy : defining a population for surgical salvage.
-
Spector JG, Sessions DG, Haughey BH, et al.Delayed regional metastases, distant metastases, and second primary malignancies in squamous cell carcinomas of the larynx and hypopharynx.
-
Stokes WA, Jones BL, Bhatia S, et al.A comparison of overall survival for patients with T4 larynx cancer treated with surgical versus organ-preservation approaches : A National Cancer Data Base analysis.
-
Sykes AJ, Slevin NJ, Gupta NK, Brewster AE.331 cases of clinically node-negative supraglottic carcinoma of the larynx: a study of a modest size fixed field radiotherapy approach.
-
Van der Putten L, de Bree R, Kuik DJ, Rietveld DH et al.
Salvage laryngectomy: oncological and functional outcome.
Oral Oncol. 2011 ; 47 : 296-301.
-
Van Egmond SL, Stegeman I, Pameijer FA, Bluemink JJ, et al.Systematic review of the diagnostic value of magnetic resonance imaging for early glottic carcinoma.
-
Vermorken JB, Remenar E, van Herpen C, Gorlia Tet al.
Cisplatin, fluorouracil, and docetaxel in unresectable head and neck cancer.
N Engl J Med. 2007 ; 357 : 1695-704.
-
Wolf GT, Fisher SG, Hong WK, Hillman R et al. Department of Veterans Affairs Laryngeal Cancer Study Group.
Induction chemotherapy plus radiation compared with surgery plus radiation in patients with advanced laryngeal cancer.
N Engl J Med. 1991 ; 324 : 1685-90.
-
Yamazaki H, Suzuki G, Nakamura S, Yoshida K, Konishi K, Teshima T, Ogawa K.Radiotherapy for laryngeal cancer-technical aspects and alternate fractionation.
-
Zeitels SM, Davis RK.Endoscopic laser management of supraglottic cancer.
-
Zhan C, Yang X, Song X, Yan L.Radiotherapy vs surgery for T1-2N0M0 laryngeal squamous cell carcinoma : A population-based and propensity score matching study.


