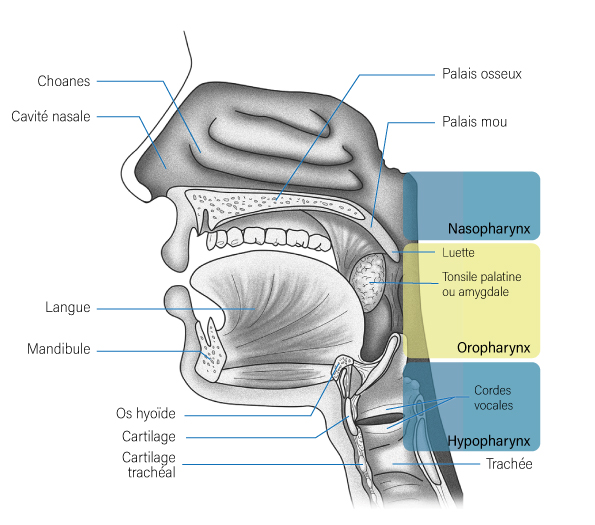
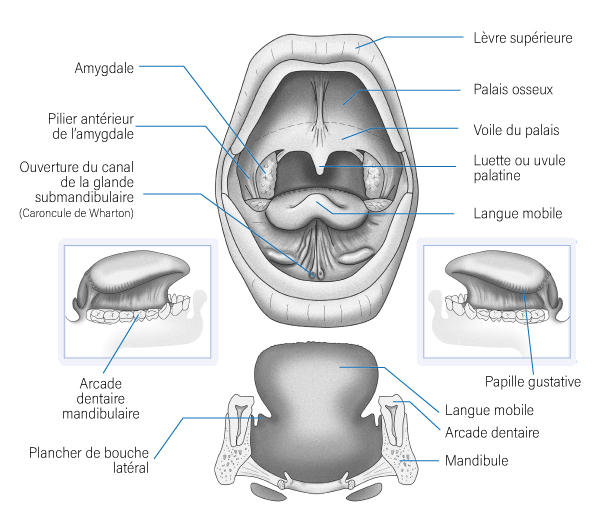
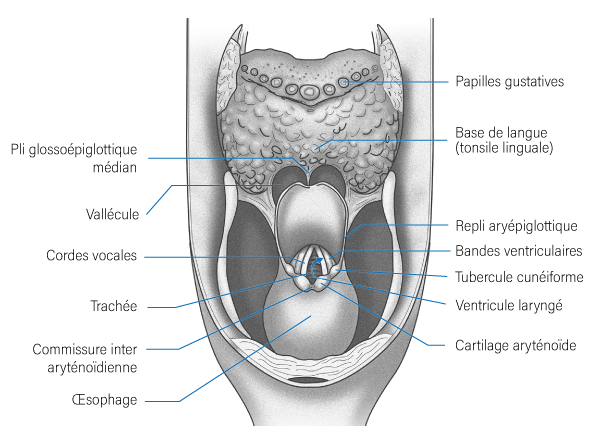
- Les loges tonsillaires,
- Les piliers antérieurs et postérieurs des tonsilles palatines,
- Le voile du palais,
- La base de la langue,
- Le sillon amygdaloglosse,
- La région sous-amygdalienne,
- Les vallécules,
- L’épiglotte sus-hyoïdienne,
- Et la paroi oropharyngée postérieure, qui débute à la projection du bord du voile du palais et qui se termine en bas en projection de l’os hyoïde.
- Les papillomavirus oncogènes (HPV-O) sont à l’origine d’un nombre croissant de cancers oropharyngés. Ainsi 60 à 80 % de ceux-ci sont viro-induits en Amérique du Nord et dans plusieurs pays européens notamment scandinaves (Chaturvedi, 2011) (NP2) ; (Garnaes, 2015) (NP2). En France, près d’un tiers de ces cancers sont causés par les HPV-O (Mirghani, 2019) (NP2). L’HPV 16 est le génotype dominant, près de 90 % des cancers oropharyngés HPV-induits lui étant lié (Gillison, 2001).
- Les cancers oropharyngés HPV-induits représentent une pathologie distincte de leurs homologues causées par l’intoxication alcoolo-tabagique en termes épidémiologique, clinico-pathologique et biologique. D’autre part, leur pronostic est significativement meilleur que celui de celui des autres cancers des VADS.
- Les cancers oropharyngés HPV-positifs affectent davantage les hommes que les femmes. Il s’agit classiquement d’individus âgés de plus de 50 ans, en bon état général et dont la consommation de tabac est nulle ou faible (D’Souza, 2007) (NP3). Ces cancers se développent préférentiellement au niveau des amygdales linguales et palatines.
- Lors du diagnostic, les tumeurs primitives sont volontiers de petite taille (T1/T2) contrastant avec l’atteinte ganglionnaire cervicale qui est généralement importante. Les localisations tumorales synchrones et métachrones sont exceptionnelles contrairement aux cancers liés à l’intoxication alcoolo-tabagique.
- Les patients atteints d’un cancer oropharyngé HPV-induit ont un meilleur contrôle locorégional de leur maladie ainsi que d’une amélioration significative de leur survie spécifique et globale (près de 80 % de survie à 5 ans) (Ang, 2010) (NP1). Ces résultats sont observés indépendamment du traitement effectué tant que les standards sont respectés.
- En raison de ses spécificités, le statut HPV a été pris en compte dans l'actualisation de la classification TNM des tumeurs oropharyngées. Notons enfin que le tabagisme (notamment au-delà de 10 à 20 PA) et une masse tumorale importante (T4, N2, N3) ont un impact négatif sur le pronostic des patients HPV-positifs (Mirghani, 2018) (NP4) ; (O'Sullivan, 2016) (NP4).
- L’évaluation du statut HPV dans les cancers de l’oropharynx est donc très fortement recommandée lors du bilan diagnostique.
Cette information a plusieurs intérêts :- Définir le stade tumoral en recourant à la classification TNM adaptée,
- Informer le patient de l’origine de sa pathologie et de son pronostic,
- Proposer au patient une inclusion dans un essai clinique adapté à sa pathologie
- Le test le plus répandu, en pratique clinique, consiste à mesurer l’expression intra-tumorale de la protéine p16 en immuno-histochimie (IHC). Il s’agit d’une méthode très sensible, peu onéreuse et accessible en routine dans tous les laboratoires d’anatomopathologie. Le test est considéré comme étant positif en cas de surexpression diffuse (nucléaire et cytoplasmique) dans plus de 70 % des cellules tumorales. Néanmoins, cette technique a une limite notable dans la mesure où il existe des mécanismes alternatifs pouvant induire une surexpression de p16 indépendamment de toute infection à HPV (Mirghani, 2014) (avis d’experts).
- Autrement dit, d’authentiques cancers oropharyngés, non liés aux HPV-O, peuvent surexprimer p16. Cet écueil est observé dans 10 % des cas (Mehanna, 2023) (NP1). Afin d’y remédier, certains recommandent de rechercher systématiquement l’ADN des HPV-O par PCR ou hybridation in situ dans tous les échantillons p16-positifs (Prigge, 2017) (NP2). Pour d’autres, la surexpression de p16 est suffisante pour affirmer que le cancer est HPV-induit à condition qu’il s’agisse bien d’un carcinome épidermoïde non kératinisant (Fakhry, 2018).
- En cas de discordance ou de doute, la recherche d’ADN viral s’impose. La définition précise du statut HPV est importante notamment quand les patients sont inclus dans des essais évaluant de nouvelles options thérapeutiques. Plusieurs travaux ont démontré que le pronostic des cancers oropharyngés p16+/HPV+ est sensiblement meilleur que celui des cancers oropharyngés p16+/HPV- (Nauta, 2018) (NP3). Leur profil moléculaire est également différent (Rietbergen, 2013) (NP3).
- La recherche du statut HPV par l’immunohistochimie p16 est recommandée pour tous les cancers de l'oropharynx.
- Des analyses plus spécifiques (recherche ADN d'HPV) peuvent être demandées au cas par cas à la discrétion du praticien (avis d’expert).
- A ce jour, le statut HPV ne constitue pas un élément déterminant, à lui seul, le choix du protocole thérapeutique (avis d’expert). De nombreux essais cliniques, dont l’objectif est de personnaliser les traitements en fonction du statut HPV, sont en cours.
| Stades T communs à cTNM et pTNM pour les COP p16+ | |
| T1 | Tumeur ≤ 2 cm dans son plus grand axe |
| T2 | Tumeur entre 2 et 4 cm dans son plus grand axe |
| T3 | Tumeur >4 cm ou extension à la face linguale de l’épiglotte |
| T4 | Invasion du larynx, des muscles extrinsèques de la langue (génioglosse, hyoglosse, palatoglosse et styloglosse), du palais dur, de la mandibule, des muscles ptérygoïdiens, du nasopharynx, de la base du crane ou de la carotide |
| Stades N cliniques pour les COP p16+ | |
| Nx | Ne peut pas être déterminé |
| N1 | Une ou plusieurs adénopathies ipsilatérales < 6 cm |
| N2 | Adénopathie controlatérale ou bilatérales < 6 cm |
| N3 | Adénopathies >6 cm |
| Stades N anatomopathologiques pour les COP p16+ | |
| Nx | Ne peut pas être déterminé |
| pN0 | Pas d’adénopathie métastatique |
| pN1 | ≤ 4 adénopathies métastatiques |
| pN2 | >4 adénopathies métastatiques |
| Stades globaux cliniques | ||||
| N0 | N1 | N2 | N3 | |
| T0 | N / A | I | II | III |
| T1 | I | I | II | III |
| T2 | I | I | II | III |
| T3 | II | II | II | III |
| T4 | III | III | III | III |
| Stades globaux anatomo-pathologiques | |||
| T0 | N0 | N1 | N2 |
| T1 | N / A | I | II |
| T2 | I | I | II |
| T3 | I | I | II |
| T4 | II | II | III |
| Stades T pour les COP p16- | |
| T1 | Tumeur ≤ 2 cm dans son plus grand axe |
| T2 | Tumeur entre 2 et 4 cm dans son plus grand axe |
| T3 | Tumeur > 4 cm ou extension à la face linguale de l’épiglotte |
| T4a | Invasion du larynx, des muscles extrinsèques de la langue, du palais dur, de la mandibule ou du muscle ptérygoïdien médial |
| T4b | Invasion du ptérygoïdien latéral, des apophyses ptérygoïdes, du nasopharynx, de la base du crâne ou de la carotide |
| Stades N pour les COP p16- | |
| Nx | Ne peut pas être déterminé |
| N0 | Pas d’adénopathie |
| N1 | Adénopathie unique ipsilatérale < 3 cm sans suspicion de rupture capsulaire |
| N2a | Adénopathie unique ipsilatérale mesurant 3- 6 cm sans suspicion de rupture capsulaire |
| N2b | Adénopathies multiples ipsilatérale <6 cm sans suspicion de rupture capsulaire |
| N2c | Adénopathie(s) controlatérales ou bilatérales <6 cm sans suspicion de rupture capsulaire |
| N3a | Adénopathies > 6 cm sans suspicion de rupture capsulaire |
| N3b | Adénopathie(s) unique ou multiple avec suspicion de rupture capsulaire |
| Stades globaux clinique et pathologique | ||||
| N0 | N1 | N2a, b, c | N3a, b | |
| T1 | I | III | IVa | IVb |
| T2 | II | III | IVa | IVb |
| T3 | III | III | IVa | IVb |
| T4a | IVa | IVa | IVa | IVb |
| T4b | IVb | IVb | IVb | IVb |
- Le scanner, injecté et non injecté à l’iode avec acquisition à un temps tissulaire, est la référence et permet d’évaluer les atteintes de l’os cortical. L’IRM est recommandée pour évaluer l’extension tissulaire en profondeur des cancers de l’oropharynx et les atteintes osseuses en visualisant la médullaire, à l’exception des tumeurs superficielles (Recommandations de la SFORL Bilan préthérapeutique des carcinomes épidermoïdes des VADS, 2012 ; Ren, 2018) (NP2).
- La panendoscopie fait partie du bilan initial indispensable de tous les cancers des VADS. La spécificité de cet examen, pour les cancers de l’oropharynx, est la nécessité d’apprécier l’exposition opératoire pour pouvoir poser l’indication d’une chirurgie transorale (Recommandations de la SFORL Bilan préthérapeutique des carcinomes épidermoïdes des VADS, 2012) (avis d’expert).
- L’exérèse tumorale est guidée par les limites macroscopiques visibles de la lésion, par les données de l’imagerie et surtout, en profondeur, par la palpation peropératoire de la tumeur (Hammoudi, 2015) (NP3) ; (Gangwani, 2019) (NP3).
-
Dans le choix thérapeutique, en première intention des tumeurs de l’oropharynx, préserver la fonction est un élément majeur de la décision. Toute intervention chirurgicale qui risque de dégrader de façon importante et définitive les fonctions de déglutition et de phonation doit faire discuter d’une alternative non chirurgicale.
-
Une des principales difficultés de la chirurgie des tumeurs de l’oropharynx est d’apprécier la meilleure voie d’abord. En effet, celle-ci doit permettre une exposition suffisante, essentielle à la fois lors de la phase d’exérèse tumorale et lors de la reconstruction.
- Les limites de la chirurgie par voie transorale exclusive sont aujourd’hui repoussées par l’utilisation des techniques endoscopiques, du laser et surtout du robot chirurgical (Genden, 2009) (NP3) ; (Ford, 2014) (NP3).
- Les indications actuellement validées et consensuelles pour la chirurgie endoscopique sont les tumeurs T1-T2 de l’oropharynx. Les tumeurs très infiltrantes en profondeur sont des contre-indications.
- Pour la chirurgie ouverte par voie cervicale, différentes voies d’abord son décrites : la double voie d’abord cervicale et cervico-transorale, la voie trans-mandibulaire (non interruptrice et interruptrice) et cervicale associée, et la voie d’abord pharyngée médiane ou latérale. Ces voies d’abord sont recommandées pour des tumeurs volumineuses ou d’accès difficile T3 ou T4a (Evrard, 2006) (NP3) ; (Portmann, 1987) (NP3).
- La voie d’abord « idéale » permet l’exérèse de la tumeur en sécurité carcinologique avec le moins de séquelles esthétiques et fonctionnelles.
-
La chirurgie ganglionnaire dans les cancers de l’oropharynx n’est, dans ses modalités, pas différente de celle réalisée dans les autres localisations des VADS :
-
En unilatéral en cas de tumeur latéralisée
-
En bilatéral en cas de lésion médiane ou infiltrant la musculature intrinsèque de la base de langue, le voile et la paroi pharyngée postérieure.
-
- Pour les tumeurs T1-2 N0, la place du ganglion sentinelle est limitée par les difficultés techniques liées à l’injection intra-tumorale en dehors du voile du palais et du pilier antérieur de l’amygdale (Garrel, 2020) (NP1). La procédure n’est donc pas réalisée en pratique courante (Schilling, 2019) (NP1).
- C’est une technique validée pour la cavité orale mais pas encore pour l’oropharynx du fait d’un nombre très restreint de patients inclus dans les séries comparatives.
- Même en considérant la meilleure réponse à la radiothérapie des cancers liés au HPV, y compris dans leur présentation ganglionnaire multiple et/ou kystique, une désescalade thérapeutique relève à ce jour exclusivement d’essais thérapeutiques (plusieurs phases III en cours) (Huang, 2013) (NP3) ; (Huang, 2020) (NP3).
- Du fait de la complexité anatomique de la sphère cervico-faciale, la reconstruction implique une compétence spécifique. En carcinologie, la progression des techniques de reconstruction permet d’envisager des exérèses plus étendues et un meilleur contrôle local de ces tumeurs, avec, de façon légitime, une augmentation des exigences sur la réhabilitation esthétique, fonctionnelle et sur la qualité de vie. Depuis les années 90, la reconstruction par lambeaux libres est devenue pratique courante et a transformé le pronostic fonctionnel et esthétique des patients.
- La reconstruction du défect muqueux, musculaire et/ou osseux est la règle et est conditionnée par l’exérèse carcinologique. Elle a pour but la conservation des fonctions (respiration > déglutition > phonation) et nécessite une réflexion pré-opératoire. Il faut préférer les reconstructions primaires.
- Il est recommandé de privilégier les techniques mini-invasives sous réserve d’un contrôle tumoral satisfaisant (grade C).
- Il est recommandé de proposer les diverses techniques de reconstruction pour répondre aux impératifs liés au défect chirurgical et aux particularités du patient (avis d’experts).
- Une curiethérapie pour une tumeur limitée, par exemple du voile (mais en prenant en compte dans la stratégie thérapeutique globale et la lymphophilie de ces tumeurs), peut se discuter en première intention ou en cas de ré-irradiation.
- Une curiethérapie interstitielle de complément, aussi dite "de barrage", peut être proposée au-delà de 50 Gy équivalent sur le volume tumoral primitif palatin. Elle a surtout un intérêt si les aires ganglionnaires ne nécessitent pas d’être irradiées au-delà de 50 Gy équivalent, et que le volume devant recevoir 70 Gy équivalent est limité au voile. Elle est moins pratiquée depuis l’avènement de la RCMI et compte tenu de l’augmentation des taux de réponse à la radiochimiothérapie. Les contre-indications sont celles usuelles de la curiethérapie (Cf. Chapitre "Généralités") (Haddad, 2014) (NP3) ; (Lapeyre, 2013) (NP3).
- Une chimiothérapie d’induction peut exceptionnellement être proposée en cas de tumeur rapidement évolutive (avis d’experts).
- En cas de tumeurs locorégionalement avancées (stade III-IV), une radiochimiothérapie concomitante ou une radiothérapie-cetuximab concomitant peuvent être proposées.
-
Compte tenu du pronostic plus favorable des cancers oropharyngés induits par HPV, la désescalade des traitements fait l'objet de recherches.
-
Deux essais randomisés ont comparé, pour des tumeurs oropharyngées localement avancées induites par HPV, une radiothérapie-cetuximab versus une radiothérapie-cisplatine (Gillison, 2019) (NP1) ; (Mehanna, 2019) (NP2).
-
Pour l’essai britannique, l’objectif principal concernait la survenue d’une toxicité sévère parmi les 334 patients randomisés (Mehanna, 2019) (NP2). Il n’existait pas de différence entre les 2 bras. En objectif secondaire, étaient posées les questions de survie sans récidive et de survie globale.
-
Dans les 2 cas, il existait une différence significative en faveur du bras radiothérapie-cisplatine (survie globale à 2 ans de 97,5 % versus 89,4 %, HR 5,0 [1,7-14,7] p = 0,0012). Pour l’essai américain, il s’agissait d’un essai de non-infériorité qui a inclus 849 patients, là encore comparant radiothérapie-cetuximab à radiothérapie-cisplatine (Gillison, 2019) (NP1). Non seulement le bras radiothérapie-cetuximab n’était pas non-inférieur, mais il était également associé à un risque plus élevé de rechute loco-régionale et de décès (survie globale à 5 ans de 84,6 % versus 77,9 %, HR 1,72 [1,29-2,29], p = 0,0002). Il n’y avait pas de moindre toxicité observée non plus pour le bras radiothérapie-cetuximab.
-
Au total, ces deux essais concordent et incitent à ne proposer du cetuximab à la place du cisplatine qu’en cas de contre-indication. De plus, malgré un pronostic global meilleur, les tumeurs HPV+ ne doivent pas être traitées différemment que les tumeurs HPV-, sauf dans le cadre d’essais cliniques.
- Pour les patients HPV+, le standard en radiochimiothérapie concomitante reste le cisplatine 100 mg/m2 à J1-J22-J43 (grade A) (Cf. Chapitre Généralités).
- Le traitement curatif des cancers oropharyngés repose principalement sur la chirurgie et la radiothérapie. Théoriquement, lorsque deux traitements sont envisageables, il est préférable de privilégier le plus efficace, et en cas d’efficacité comparable, de favoriser le moins toxique.
- Plusieurs essais cliniques, dont l’objectif est de répondre à ces questions cruciales sont en cours. En attendant la publication de preuves, basées sur des études prospectives randomisées, des orientations thérapeutiques peuvent néanmoins être formulées sur la base des connaissances actuelles.
- De nombreuses équipes basent habituellement leur raisonnement sur les paramètres suivants :
- point de départ anatomique,
- extension(s) et aspect macroscopique de la tumeur,
- atteinte(s) ganglionnaire(s),
- stade tumoral,
- comorbidité(s).
| En faveur de la RT | En faveur de la chirurgie +/- RT (-CT) | |
| Localisation initiale |
|
|
| Aspect macroscopique |
|
|
| Extension |
|
|
| Statut ganglionnaire |
|
|
- a : La morbidité associée à la chirurgie du voile conduit de nombreuses équipes à privilégier la radiothérapie.
- b : La rupture capsulaire étant une indication de RT-CT post-opératoire, certains préfèrent réaliser une RT-CT d’emblée en cas de suspicion radiologique de rupture capsulaire.
- c : Orientation s’appuyant sur une des études les plus larges à ce jour (Schernberg, 2019) (NP1).
- d : Les lésions T1-2 N0-1 peuvent être traitées par chirurgie seule si l’analyse histologique définitive est favorable (Une RT exclusive est également une très bonne indication en cas de T1-2N0).
- e : Pour certains, les adénopathies N3 résécables sont des indications chirurgicales notamment chez les HPV-négatifs. Pour ces volumineuses adénopathies, la littérature est très limitée (les N3 représentent moins de 5 % de la population dans plusieurs essais cliniques récents (Mehanna, 2019) (NP1) ; (Gillison, 2019) (NP2).
- A ce jour, il n’existe malheureusement aucune preuve robuste permettant de départager ces deux approches. En conséquent, les choix thérapeutiques sont davantage liés à des expertises ou à des convictions institutionnelles et personnelles. Cette absence de consensus se traduit par une grande variabilité dans les pratiques. Ainsi, le recours à la chirurgie, en France, varie de 9 à 74 % en fonction des équipes.
- En l’absence de recommandations stringentes, ces paramètres sont fréquemment mis en avant pour orienter les choix thérapeutiques. Cependant, aucun de ces facteurs n’a de valeur absolue et c’est souvent leur combinaison qui guide vers la radiothérapie ou la chirurgie première.
- Le statut HPV ne doit pas, à l’heure actuelle, entrer en ligne de compte dans les choix thérapeutiques bien qu’en pratique certains arbitrages s’y réfèrent. Notamment, il ne doit pas, en l’état actuel des connaissances, influencer l’intensité du traitement, et donc ne doit pas permettre de désescalade thérapeutique en dehors d’essais cliniques.
A l’inverse, pour les tumeurs HPV-, le contrôle locorégional après radiochimiothérapie pour les stades localement avancés reste le plus souvent inférieur à 50 %. On peut ici espérer un gain significatif en débutant par une exérèse chirurgicale même si elle doit être responsable de séquelles fonctionnelles tant qu’elles restent acceptables. En effet, si le statut HPV est associé à un meilleur pronostic global, il n’est pas prédictif de la réponse à un traitement par rapport à un autre. D’une manière générale, les indications sont fortement dépendantes du stade tumoral.
- Les cancers débutants peuvent être traités par résection chirurgicale de première intention suivie ou non d’un traitement complémentaire en fonction de l’analyse histologique de la pièce opératoire. Lorsque cette approche est retenue, les critères de sélection des patients doivent être suffisamment stricts pour réduire au maximum le recours à un traitement adjuvant, l’idée étant de rester en monothérapie pour optimiser les résultats fonctionnels (Garden, 2016) (NP4).
- L’alternative, tout aussi efficace, est une radiothérapie exclusive chez les patients T1-2 N0, une radiochimiothérapie en cas d'atteinte ganglionnaire. Une abstention de chimiothérapie peut être discutée pour les stades ganglionnaires précoces, surtout pour les formes p16+ (Nichols, 2019) (NP4).
2- critères histologiques défavorables : marge(s) positive(s), rupture(s) capsulaire(s) ganglionnaire(s), pN>2, engaînement(s) périnerveux, embole(s) vasculaire(s).
3- RT-CT si marge(s) positive(s) ou rupture(s) capsulaire(s) ganglionnaire(s), RT dans les autres cas.
- En terme de survie, le traitement optimal repose sur une association de chirugie suivie d’une radiochimiothérapie (Vermorken, 2017) (NP1). Cette attitude n’est envisageable que si les suites fonctionnelles sont acceptables et que l’état général du patient est satisfaisant.
- L’alternative est une radiochimiothérapie concomitante afin d’éviter une intervention chirurgicale et peut se discuter notamment pour les patients HPV+ non fumeurs (Culié, 2018) (NP3). La radiochimiothérapie (avec du cisplatine) pour les stades avancés HPV+ résecables est potentiellement à privilégier par rapport à une chirurgie à pronostic fonctionnel incertain + traitements post-opératoires car l’efficacité est comparable et les toxicités sont moins sévères (avis d’experts).
- Pour certains, une chimiothérapie d’induction suivie d’une RT/RT-CT est une option possible notamment en cas d’atteinte ganglionnaire classée N3, surtout si celle-ci est rapidement évolutive, mais les essais randomisés et méta-analyses n’ont pas pu montrer le bénéfice de la chimiothérapie d’induction dans ce cadre (Haddad, 2013) (NP2) ; (Cohen, 2014) (NP1). Les cancers avancés non résécables (engaînement carotidien > 180°, atteinte de la base du crâne etc.) et ceux pour lesquels la chirurgie entrainerait des séquelles fonctionnelles majeures (lésion basi-linguale ou vélaire dépassant la ligne médiane) sont traités par RT-CT.
-
Pour les tumeurs T1-T2 N0 résécables, sans risque d'insuffisance vélaire, l’exérèse chirurgicale par voie endobuccale et un curage cervical bilatéral des territoires II, III, IV +/-V sont recommandés. Le traitement par radiothérapie +/- chimiothérapie est une alternative, notamment chez les patients qui ont des adénopathies cervicales et/ou rétro-pharyngées.
-
Une curiethérapie en alternative à une radiothérapie externe peut parfois être proposée (Peiffert, 2018) (NP3) ; (Haddad, 2014) (NP3).
-
Pour les tumeurs T2 non résécables, T3, T4 du voile, la radiothérapie première ou la radiochimiothérapie est le traitement de choix.
-
Compte tenu de la lymphophilie, le traitement des aires ganglionnaires par radiothérapie doit être bilatéral (aires II, III, IV et rétropharyngées) (Lapeyre, 2013) (NP4).
- Une chirurgie transorale laser ou robotisée est recommandée si la tumeur est exposable. La radiothérapie post-opératoire est aussi indiquée selon les critères histologiques habituels (Cf. Chapitre Généralités).
- La radiothérapie exclusive ou associée à la chimiothérapie peut aussi être proposée.
- Concernant les aires ganglionnaires pour les localisations amygdaliennes, le traitement chirurgical est unilatéral. Pour la radiothérapie, le traitement est unilatéral pour les N0, N1 et bilatéral dans les autres cas. Les ganglions rétropharyngés seront également irradiés.
- Pour les cancers de la base de langue, le traitement des aires ganglionnaires est bilatéral et n'inclut pas les aires rétropharyngées.
- Chirurgie transorale (T1-T2) ou par voie externe (T3-T4) suivi d'un traitement complémentaire adapté à l'histologie ou radiochimiothérapie d'emblée.
- L'irradiation ganglionnaire sera bilatérale et rétropharyngée en cas de primitif amygdalien.
- On peut proposer une chirurgie transorale laser ou robotisée si la tumeur est exposable et peu infiltrante ou une sub-glosso-laryngectomie supraglottique par voie externe si elle n’est pas exposable.
- La radiothérapie post-opératoire est indiquée selon les critères habituels (Cf. Chapitre Généralités) et doit être bilatérale sur les aires ganglionnaires.
- La radiothérapie exclusive ou associée à la chimiothérapie peut être proposée d'emblée.
- Une stratégie de préservation d’organe par radiochimiothérapie doit être proposée en première intention si l’état général le permet.
- En cas de contre-indication à la chimioradiothérapie ou de refus du patient, l’envahissement de la base de langue ou de la loge HTE contre-indique une chirurgie endoscopique. La subglossolaryngectomie totale est recommandée.
- Malgré les progrès thérapeutiques locaux et systémiques, les taux de récidives restent élevés, entre 20 et 50 % selon les séries et, pour la plupart, ces récidives se situent généralement dans la zone préalablement irradiée (Carvalho, 2003) (NP4). Les cancers oropharyngés HPV induits ont des taux de contrôle locorégional supérieurs (Contrera, 2020) (NP2).
- Lorsque la récidive est opérable, la chirurgie de rattrapage est le traitement de référence qui offre les meilleurs résultats mais elle concerne moins de 40% des patients (De Crevoisier, 1998) (NP2).
- En cas de récidive après chirurgie seule, une chimioradiothérapie doit être proposée si le patient n’est pas réopérable.
- En cas de récidive en territoire irradié, la radiothérapie (ré-irradiation) peut être envisagée pour les patients inopérables (De Crevoisier, 1998) (NP2).
- En règle générale, le volume cible anatomo-clinique comprend la récidive tumorale (volume tumoral macroscopique) avec une marge de 1 cm (voire 2 cm) sans irradiation prophylactique ni irradiation ganglionnaire associée.
- En cas de chirurgie de rattrapage possible, celle-ci doit être privilégiée.
Une ré-irradiation post-opératoire peut être proposée en cas de facteurs de risque péjoratifs (Janot, 2008) (NP2).
- A l’instar des stades localisés, les patients en situation de récidive ou métastatique et porteurs d’une tumeur liée à une infection à HPV ont un pronostic meilleur que les patients avec une tumeur HPV négative. La différence est cependant ténue. Il n’existe par ailleurs aucune prise en charge particulière à proposer dans cette situation, puisque le statut HPV n’est pas prédictif de la réponse à la chimiothérapie ou au cetuximab. Le cetuximab en post-opératoire n'a pas d'indication.
- Concernant l’immunothérapie, les données sont pour l’instant parcellaires et s’il semble exister un bénéfice plus important en cas de tumeur liée à HPV, il n’existe pas de niveau de preuve suffisant pour orienter la thérapeutique en fonction du statut HPV de la tumeur. En effet, dans les études de sous-groupes des grands essais cliniques, les résultats concernant les tumeurs HPV et HPV- semblent contradictoires (Botticelli, 2021) (Patel, 2020).
- En cas de chirurgie de rattrapage et de réirradiation impossible, une thérapeutique médicale systémique palliative (chimiothérapie, thérapie ciblée, immunothérapie) peut être proposée si l’état général le permet (Cf. Chapitre "Généralités").
- Les soins de support sont aussi proposés pour l’accompagnement des patients.
- Ang KK, Harris J, Wheeler R, et al.
Human papillomavirus and survival of patients with oropharyngeal cancer.
- Botticelli A, Cirillo A, Strigari L, Valentini F, Cerbelli B, Scagnoli S, Cerbelli E, Zizzari IG, Rocca CD, D'Amati G, Polimeni A, Nuti M, Merlano MC, Mezi S, Marchetti P.
Anti-PD-1 and Anti-PD-L1 in Head and Neck Cancer: A Network Meta-Analysis.
- Carvalho AL, Magrin J, Kowalski LP.
Sites of recurrence in oral and oropharyngeal cancers according to the treatment approach.
-
Chaturvedi AK, Engels EA, Pfeiffer RM, Hernandez BY et al.
Human papillomavirus andrising oropharyngeal cancer incidence in the United States.
J Clin Oncol. 2011 ; 29 (32) : 4294-301.
-
Cohen EE, Karrison TG, Kocherginsky M, Mueller J et al.
Phase III randomized trial of induction chemotherapy in patients with N2 or N3 locally advanced head and neck cancer.
J Clin Oncol. 2014 ; 32 : 2735-43.
-
Contrera KJ, Smile TD, Mahomva C, et al.Locoregional and distant recurrence for HPV-associated oropharyngeal cancer using AJCC 8 staging.
-
Culié D, Garrel R, Viotti J, Schiappa R et al.
Impact of HPV-associated p16-expression and other clinical factors on therapeutic decision-making in patients with oropharyngeal cancer: A GETTEC multicentric study.
Eur J Surg Oncol. 2018 ; 44 : 1908-1913.
- D'Souza G, Kreimer AR, Viscidi R, Pawlita M, et al.
Case-control study of human papillomavirus and oropharyngeal cancer.
-
De Crevoisier R., J. Bourhis, C. Domenge, P. Wibault et al.
Full-dose reirradiation for unresectable head and neck carcinoma: experience at the Gustave-Roussy Institute in a series of 169 patients
J Clin Oncol, 1998 ; 16 : 3556-62.
-
Evrard S, Guillemin F, Dauplat J
Chirurgie oncologique, Concepts et techniques,.
John Libbey Eurotext, Paris, 2006
-
Fakhry C, Lacchetti C, Rooper LM, Jordan RC et al.
Human Papillomavirus Testing in Head and Neck Carcinomas: ASCO Clinical Practice Guideline Endorsement of the College of American Pathologists Guideline.
J Clin Oncol. 2018 ; 36 : 3152–61.
- Ford SE, Brandwein-Gensler M, Carroll WR, Rosenthal EL, Magnuson JS.
Transoral robotic versus open surgical approaches to oropharyngeal squamous cell carcinoma by human papillomavirus status.
-
Garden AS, Fuller CD, Rosenthal DI et al.
Radiation therapy (with or without neck surgery) for phenotypic human papillomavirus-associated oropharyngeal cancer.
Cancer. 2016 ; 122 : 1702–1707.
-
Gangwani K, Shetty L, Seshagiri R, Kulkarni D.
Comparison of TORS with Conventional Surgery for Oropharyngeal Carcinomas in T1-T4 Lesions.
AnnMaxillofac Surg. 2019 ; 9 : 387-392
-
Garnaes E, Kiss K, Andersen L, Therkildsen MH et al.
Ahigh and increasing HPV prevalence in tonsillar cancers in Eastern Denmark,2000-2010: the largest registry-based study to date.
Int J Cancer. 2015 ; 136 : 2196-203.
-
Garrel R, Poissonnet G, Moyà Plana A, Fakhry Net al.
Equivalence Randomized Trial to Compare Treatment on the Basis of Sentinel NodeBiopsy Versus Neck Node Dissection in Operable T1-T2N0 Oral and Oropharyngeal Cancer.
J Clin Oncol. 2020 ; 38 : 4010-4018.
-
Genden EM, Desai S, Sung CK.
Transoral robotic surgery for the management of head and neck cancer: a preliminary experience.
Head Neck. 2009 ; 31 : 283
-
Gillison ML, Shah KV.Human papillomavirus-associated head and neck squamous cell carcinoma : mounting evidence for an etiologic role for human papillomavirus in a subset of head and neck cancers.
-
Gillison ML, Trotti AM, Harris J, Eisbruch A et al.
Radiotherapy plus cetuximab or cisplatin in human papillomavirus-positive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non-inferiority trial.
Lancet. 2019 ; 393 : 40-50.
-
Haddad R, O'Neill A, Rabinowits G, Tishler R et al
Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial.
Lancet Oncol. 2013 ;14 : 257-64.
-
Haddad A, Peiffert D, Lapeyre M, Harter V.
A case-control study of patients with squamous cell carcinoma of the oral cavity and oropharynx treated with pulsed-dose-rate brachytherapy.
Brachytherapy. 2014 ; 13 : 597-602.
-
Hammoudi K, Pinlong E, Kim S, Bakhos D et al.
Transoral roboticsurgery versus conventional surgery in treatment for squamous cell carcinoma of the upper aerodigestive tract.
Head Neck. 2015 ; 37 (9) : 1304-9.
-
Huang SH, O'Sullivan B, Xu W, Zhao H, et al.
Temporal nodal regression and regional control after primary radiation therapy for N2-N3 head-and-neck cancer stratified by HPV status.
Int J Radiat Oncol Biol Phys. 2013 ; 87 : 1078-85.
-
Huang SH, O' Sullivan B.Overview of the 8th Edition TNM Classification for Head and Neck Cancer.
-
Huang SH, O'Sullivan B, Su J, Bartlett E et al.
Prognostic importance of radiologic extranodal extension in HPV-positive oropharyngeal carcinoma and its potential role in refining TNM-8 cN-classification. 2019
Radiother Oncol. 2020 ;144 : 13-22
-
Janot F, De Raucourt D, Benhamou E, et al.Randomized trial of postoperative reirradiation combined with chemotherapy after salvage surgery compared with salvage surgery alone in head and neck carcinoma.
-
Lapeyre M, Loos G, Biau J.
Delineation for oral cavity and oropharyngeal cancers.
Cancer Radiother. 2013 ; 17 : 493-7.
-
Mehanna H, Robinson M, Hartley A, Kong A et al;
De-ESCALaTE HPV Trial Group. Radiotherapy plus cisplatin or cetuximab in low-risk human papillomavirus-positive oropharyngeal cancer (De-ESCALaTE HPV): an open-label randomised controlled phase 3 trial.
Lancet. 2019 ; 393 : 51-60.
-
Mehanna, H., Taberna, M., von Buchwald, C., et al.HNCIG-EPIC group (2023).Prognostic implications of p16 and HPV discordance in oropharyngeal cancer (HNCIG-EPIC-OPC) : a multicentre, multinational, individual patient data analysis.
-
Mirghani H, Amen F, Moreau F et al.
Human papilloma virus testing in oropharyngeal squamous cell carcinoma: what the clinician should know.
Oral Oncol. 2014 ; 50 : 1-9
-
Mirghani H, Leroy C, Chekourry Y, Casiraghi O et al.
Smoking impact on HPV driven head and neck cancer's oncological outcomes?
Oral Oncol. 2018 ; 82 :131-137.
-
Mirghani H, Bellera C, Delaye J, Dolivet G et al.
Prevalence and characteristics of HPV-driven oropharyngeal cancer in France.
Cancer Epidemiol. 2019 ; 61 : 89-94.
-
Nauta IH, Rietbergen MM, van Bokhoven AAJD, Bloemena E, et al.Evaluation of the eighth TNM classification on p16-positive oropharyngeal squamous cell carcinomas in the Netherlands and the importance of additional HPV DNA testing.
-
Nichols AC, Theurer J, Prisman E, Read N et al.
Radiotherapy versus transoral robotic surgery and neck dissection for oropharyngeal squamous cell carcinoma (ORATOR): an open-label, phase 2, randomised trial.
Lancet Oncol. 2019 ; 20 : 1349-1359.
-
O'Sullivan B, Huang SH, Su J, Garden AS et al.
Development and validation of a staging system for HPV-related oropharyngeal cancer by the International Collaboration on Oropharyngeal cancer Network for Staging (ICON-S): a multicentre cohort study.
Lancet Oncol. 2016 ; 17 : 440-451.
-
Patel, Jaimin J et al.Impact of PD-L1 expression and human papillomavirus status in anti-PD1/PDL1 immunotherapy for head and neck squamous cell carcinoma-Systematic review and meta-analysis.
-
Peiffert D, Coche-Dequéant B, Lapeyre M, Renard S.
Brachytherapy for head and neck cancers.
Cancer Radiother. 2018 ; 22 : 359-366.
-
Portmann Y, Guerrier Y.
Traité de technique chirurgicale ORL et cervico-faciale, Pharynx et larynx, tome 3
Masson, Paris 1987
-
Prigge ES, Arbyn M, von Knebel Doeberitz M, Reuschenbach M.Diagnostic accuracy of p16INK4a immunohistochemistry in oropharyngeal squamous cell carcinomas: A systematic review and meta-analysis.
-
Bilan préthérapeutique des carcinomes épidermoides des VADS Texte long
référentiel de la SFORL, mai 2013.
-
Bilan préthérapeutique des carcinomes épidermoides des VADS Texte Court
-
Ren J, Tian J, Yuan Y, Dong D et al.
Magnetic resonance imaging based radiomics signature for the preoperative discrimination of stage I-II and III-IV head and neck squamous cell carcinoma.
Eur J Radiol. 2018 ; 106 : 1-6.
-
Rietbergen MM, Snijders PJ, Beekzada D, Braakhuis BJ, et al.Molecular characterization of p16-immunopositive but HPV DNA-negative oropharyngeal carcinomas.
-
Schernberg, Antoine et al.Prognostic factors in patients with soft palate squamous cell carcinoma.
-
Schilling C, Stoeckli SJ, Vigili MG, de Bree R et al.
Surgical consensus guidelines on sentinel node biopsy (SNB) in patients with oral cancer.
Head Neck. 2019 ; 41 : 2655-2664.
-
Shamseddine, Achraf A et al.Tumor Immunity and Immunotherapy for HPV-Related Cancers.
-
Vermorken JB.Human Papillomavirus (HPV) : A Criterion for Therapeutic Decision in Squamous Cell Carcinoma of the Head and Neck ? Recent Results.


