Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 27 décembre 2021.
- Cette référence présente les principes de prise en charge des adénocarcinomes gastriques et de la jonction œsogastrique Siewert III.
- Pour les GIST, consulter la référence correspondante.
- Les adénocarcinomes de la jonction œsogastrique Siewert I et II sont traités dans la référence Adénocarcinome de l'œsophage et de la jonction œsogastrique.
- Après une phase diagnostique et de bilan d'extension, la stratégie thérapeutique est définie. La chirurgie occupe une place centrale dans la prise en charge des traitements complémentaires pouvant être proposés.
- Rappel de la classification des tumeurs de la jonction œsogastrique en fonction de leurs localisations endoscopiques :
- Siewert I : lésion du cardia étendue au bas œsophage et traitée comme un cancer du tiers inférieur de l'œsophage (Cf. référence Adénocarcinome de l’œsophage et de la jonction œsogastrique).
- Siewert II : lésion n'intéressant que le cardia (Cf. référence Adénocarcinome de l’œsophage et de la jonction œsogastrique).
- Siewert III : lésion du cardia étendue à l'estomac.
- Réalisé dans le cadre du bilan initial, il repose sur l'interrogatoire, l'examen clinique du patient et la fibroscopie œsogastrique avec 5 à 8 biopsies.
- En cas de tumeur superficielle, faire des biopsies multiples du fundus et de l’antre à la recherche d’une métaplasie, atrophie, dysplasie et Helicobacter pylori.
- description anatomique précise
- du niveau supérieur de la lésion
- du pourcentage de circonférence atteinte
- de la localisation précise orientée par rapport à la ligne Z, l'angulus et au pylore
- si la lésion est franchissable, description de la limite inférieure de la lésion
- biopsies multiples *
- échoendoscopie
la sous-muqueuse en cas de suspicion de linite
avec biopsies muqueuses négatives
- Standard :
- Interrogatoire et examen clinique
- Scanner thoraco-abdomino-pelvien (la dilatation gastrique à l'eau sensibilise l'examen pour localiser la tumeur et apprécier l'infiltration pariétale).
- Options en cas de cancer invasif :
- IRM hépatique et/ou échographie abdominale ± produit de contraste si doute au scanner
- Echoendoscopie :
- détermination du stade uT et uN ± biopsies (sauf pour tumeur T3 et T4 au scanner) si cancer non sténosant et non métastatique si cela modifie la stratégie thérapeutique pour évaluer les tumeurs superficielles
- pour déterminer les indications de mucosectomie ou dissection sous-muqueuse
- en cas de suspicion de linite pour évaluer l’extension vers l’œsophage, le pylore et duodénum, ou si biopsies négatives à plusieurs reprises
- si cancer non sténosant et non métastatique
- laparoscopie avec lavage péritonéal et biopsies (surtout T3, T4 et linites) ± jéjunostomie d'alimentation ± pose d'une chambre implantable
- dosage des marqueurs ACE et CA 19.9 avant tout traitement
- Le TEP-TDM au 18F-FDG n'est pas systématique : indiqué en cas de doute sur une lésion métastatique et après discussion ou chez un patient potentiellement opérable mais avec un risque élevé de morbi-mortalité afin de rechercher une contre-indication chirurgicale.
- Sur signes d'appels :
- scintigraphie osseuse
- IRM cérébrale
- Immunohistochimie :
- Statuts MSS/MSI et HER2 systématiques au diagnostic pour toutes les tumeurs recherche de mutations sur les gènes de réparation de l'ADN (mismatch repair : MMR) (cf. référence Côlon)
- PMS2
- MLH1
- MSH2
- MSH6
- HER2
- Statuts MSS/MSI et HER2 systématiques au diagnostic pour toutes les tumeurs recherche de mutations sur les gènes de réparation de l'ADN (mismatch repair : MMR) (cf. référence Côlon)
- Dans la famille d’un patient atteint de cancer gastrique, la recherche de l’infection à Helicobacter pylori des apparentés au 1er degré (enfants, frères/sœurs, parents) du patient est recommandée car :
- 80 % des cancers de l’estomac sont dus à la bactérie Helicobacter pylori (la plupart des 20 % restants sont des cancers du cardia associés au reflux gastro-œsophagien)
- l’infection à Helicobacter pylori s’acquiert dans l’enfance et persiste toute la vie
- les apparentés au 1er degré (enfants, frères/soeurs, parents) des personnes ayant un cancer de l’estomac, ont un risque de cancer de l’estomac doublé voire triplé par rapport au risque de la population générale
- la recherche puis l’éradication de la bactérie Helicobacter pylori constituent une méthode de prévention efficace contre le cancer gastrique, surtout lorsqu’elles sont mises en œuvre tôt, c’est-à-dire avant l’apparition d’une lésion gastrique pré-cancéreuse.
- En pratique, les méthodes de recherche de l’infection à Helicobacter pylori seront choisies en fonction de l’âge des apparentés :
- Âge <45 ans : test respiratoire à l’urée marquée C13* ou sérologie Helicobacter pylori
- Âge >45 ans : endoscopie + biopsies.
- L'éradication d'Helicobacter pylori, pour être voisine de 90 % nécessite l'utilisation de quadrithérapies (compte tenu du fort taux de résistance à la clarithromycine en France). Deux schémas thérapeutiques sont possibles en première intention :
- Quadrithérapie bismuthée : 10 jours
- PYLERA® (citrate de bismuth 140 mg + métronidazole 125 mg + tétracycline 125 mg) 3 gélules 4 fois par jour
- oméprazole 20 mg matin et soir.
- Traitement concomitant : 14 jours
- amoxicilline 1 g matin et soir
- métronidazole 500 mg matin et soir
- clarithromycine 500 mg matin et soir
- inhibiteur de la pompe à protons (esoméprazole 40 mg ou rabéprazole 20 mg) matin et soir.
- De nouvelles possibilités de traitement sont diffusées par la Société Nationale Française de Gastro-Entérologie (SNFGE) et le Groupe d’Etudes Français des Helicobacters (GEFH).
- Quadrithérapie bismuthée : 10 jours
- La vérification de l’éradication de la bactérie Helicobacter pylori est réalisée par un test respiratoire à l’urée marquée C13* (4 semaines après l’arrêt de l’antibiothérapie et 2 semaines après l’arrêt du traitement IPP).
► Informations du Groupe d'Etudes Francais des Helicobacter (GEFH)
► Communiqué de presse HAS juin 2017
- Données démographiques (date de naissance, lieu d'habitation)
- Médecin correspondant, date et lieu du diagnostic
- Index OMS, poids habituel, poids actuel, taille
- Bilan nutritionnel (albumine, préalbumine, CRP et phosphore)
- Antécédents familiaux de cancer
- Comorbidités du patient (cardiaque, rénal, neurologique en particulier)
- Compte-rendu d'endoscopie et résultats écrits des biopsies avec statuts HER2
- Compte-rendu opératoire et anatomo-pathologique (si malade déjà opéré en urgence) avec recherche du statut HER2
- Bilan d'extension tel qu'il est prévu dans la référence
- Tout dossier de cancer de l'estomac doit être discuté avant traitement
- Statut HER2 systématique si maladie métastatique ou récidive et en vue d'inclusion dans un essai néo-adjuvant (INNOVATION)
- Statut MSI en vue d'inclusion dans un essai néo-adjuvant (NEONIPIGA).
| T | |
| Tx | Renseignements insuffisants pour classer la tumeur |
| T0 | Pas de tumeur primitive |
| Tis | Carcinome in situ : tumeur intra-épithéliale sans invasion de la lamina propria (dysplasie de haut grade) |
| T1 | Tumeur envahissant la lamina propria, la muscularis mucosae ou la sous-muqueuse |
| T1a | La tumeur envahit la lamina propria ou la muscularis mucosae |
| T1b | La tumeur envahit la sous-muqueuse |
| T2 | Tumeur envahissant la muscularis propria |
| T3 | Tumeur envahissant la sous-séreuse, le tissu conjonctif sans envahissement des structures adjacentes ou du péritoine viscéral[1][2][3] |
| T4 | Tumeur perforant la séreuse (péritoine viscéral) ou les structures adjacentes[1][2][3] |
| T4a | La tumeur perfore la séreuse (péritoine viscéral) |
| T4b | La tumeur envahit les structures adjacentes |
- ↑ La tumeur pénètre la muscularis propria avec extension aux ligaments gastro-colique ou gastro-hépatique ou au grand ou au petit épiploon sans perforation du péritoine viscéral couvrant ces structures. Dans ce cas, la tumeur est classée T3. S'il y a perforation du péritoine viscéral couvrant les ligaments gastriques ou l'épiploon, la tumeur est classée T4.
- ↑ 2,0 et 2,1 Les structures adjacentes de l'estomac sont la rate, le côlon transverse, le foie, le diaphragme, le pancréas, la paroi abdominale, la surrénale, les reins, le grêle et le rétropéritoine.
- ↑ 3,0 et 3,1 L'extension dans la paroi du duodénum ou de l'œsophage est classée selon la profondeur du plus grand envahissement dans n'importe lequel de ces sites, y compris l'estomac.
- Les ganglions lymphatiques régionaux sont les ganglions périgastriques le long de la petite et de la grande courbure et les ganglions situés le long de l'artère gastrique gauche (coronaire stomachique), de l'artère hépatique commune, de l'artère splénique et du tronc cœliaque. Les ganglions régionaux de la jonction gastro-œsophagienne sont les ganglions paracardiaux, gastriques gauches, cœliaques, diaphragmatiques et para-œsophagiens médiastinaux inférieurs (voir schéma).
| N | |
| Nx | Renseignements insuffisants pour classer les ganglions lymphatiques régionaux |
| N0 | Pas de signe d'atteinte des ganglions lymphatiques régionaux[1] |
| N1 | Envahissement de 1 à 2 ganglions lymphatiques régionaux |
| N2 | Envahissement de 3 à 6 ganglions lymphatiques régionaux |
| N3 | Envahissement de 7 ou plus ganglions lymphatiques régionaux |
| N3a | Envahissement de 7 à 15 ganglions lymphatiques régionaux |
| N3b | Envahissement de 16 ou plus ganglions lymphatiques régionaux |
- L'envahissement des autres ganglions lymphatiques intra-abdominaux tels que rétro-pancréatiques, mésentériques et para-aortiques, est classé comme métastases à distance.
- ↑ L'examen histologique d'une pièce opératoire de lymphadénectomie incluera habituellement 16 ganglions lymphatiques ou plus. Si les ganglions ne sont pas atteints, classer pN0 même si le nombre habituel de ganglions n'est pas atteint.
- Les métastases incluent le lavage péritonéal positif, les métastases péritonéales et les tumeurs du grand épiploon qui ne sont pas en continuité avec la tumeur primitive.
| M | |
| Mx | Renseignements insuffisants pour classer la (les) métastase(s) à distance |
| M0 | Pas de métastase à distance |
| M1 | Présence de métastase(s) à distance |
| Stade | T | N | M |
| Stade 0 | Tis | N0 | M0 |
| Stade IA | T1 | N0 | M0 |
| Stade IB | T1 | N1 | M0 |
| T2 | N0 | ||
| Stade IIA | T1 | N2 | M0 |
| T2 | N1 | ||
| T3 | N0 | ||
| Stade IIB | T1 | N3a | M0 |
| T2 | N2 | ||
| T3 | N1 | ||
| T4a | N0 | ||
| Stade IIIA | T2 | N3a | M0 |
| T3 | N2 | ||
| T4a | N1, N2 | ||
| T4b | N0 | ||
| Stade IIIB | T1, T2 | N3b | M0 |
| T3, T4a | N3a | ||
| T4b | N1, N2 | ||
| Stade IIIC | T3, T4a | N3b | M0 |
| T4b | N3a, N3b | ||
| Stade IV | Tous T | Tous N | M1 |
- La lésion doit être décrite selon la classification de Paris.
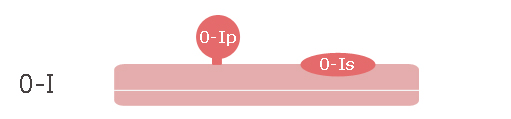
- 0.Ip : lésion en relief, pédiculée
- 0.Is : lésion en relief, sessile


- 0.IIa : lésion plane légèrement surélevée, la hauteur étant inférieure à la hauteur des cuillers d’une pince à biopsie fermée (2,5 mm)
- 0.IIb : lésion plane non surélevée, repérable par son caractère dyschromique

- 0.IIc : lésion plane légèrement déprimée

- 0.III : lésion creusante
- u (ou us) T1 : tumeur limitée à la muqueuse (3ème et 5ème couche hyperéchogène intacte)
- uT2 : tumeur atteignant la musculeuse sans la dépasser (5ème couche hyperéchogène intacte)
- uT3 : tumeur dépassant la séreuse (5ème couche hyperéchogène franchie)
- uT4 : envahissement d'un organe de voisinage
- uN0 : pas d'adénopathie d'allure néoplasique
- uN+ : adénopathie d'allure néoplasique (ronde, hypoéchogène, contours nets).
- Symbole p : le pTNM correspond à la classification histologique postopératoire, complétée ou modifiée par les observations supplémentaires recueillies au cours de l'acte chirurgical et de l'examen histopathologique.
- pN : (sur N ganglions explorés) l'examen histologique d'une lymphadénectomie régionale doit inclure au moins 15 ganglions lymphatiques. Classer pN0 si les ganglions ne sont pas envahis, même si le nombre de 15 ganglions lymphatiques pour un curage D1 et 25 ganglions lymphatiques pour un curage D2 n'est pas atteint.
- Symbole y : dans tous les cas où la classification est effectuée durant ou après traitement néo-adjuvant, le cTNM ou le pTNM est précédé du préfixe y.
- Symbole c : le signe TNM ou cTNM correspond à la classification clinique pré-thérapeutique, résultat de l'imagerie, de l'endoscopie, des biopsies, de l'exploration chirurgicale et des autres examens complémentaires.
| OMS | |
| 0 | Capable d'une activité identique à celle précédant la maladie, sans aucune restriction. |
| 1 | Activité physique diminuée mais ambulatoire et capable de mener un travail. |
| 2 | Ambulatoire et capable de prendre soin de soi, incapable de travailler. Alité <50 % de son temps. |
| 3 | Capable de seulement quelques soins personnels. Alité ou chaise >50 % du temps. |
| 4 | Incapable de prendre soin de lui-même, alité ou chaise en permanence. |
- Le diagnostic est évoqué sur l'aspect radiologique (en tuyau de plomb au TOGD, paroi épaissie et homogène dans sa globalité au scanner), endoscopique (paroi rigide), échoendoscopique (épaississement pariétal) ou macroscopique à la cœlioscopie (paroi rigide blanchâtre, épaissie et ayant l'aspect du lin) avec à l'examen anatomo-pathologique un adénocarcinome peu différencié infiltrant, constitué le plus souvent de cellules indépendantes en bague à chaton, envahissant les différentes couches de la paroi sans les détruire et un stroma fibreux. Les biopsies doivent être profondes, en puits, étagées et souvent répétées pour confirmer le diagnostic car la muqueuse est souvent saine. L'envahissement est intramural avec une diffusion ganglionnaire et péritonéale fréquente. Une gastrectomie totale est recommandée.
- Il existe des adénocarcinomes à cellules indépendantes en bague à chaton non linitiques dont le pronostic et le traitement rejoignent celui des adénocarcinomes gastriques habituels (dans l’essai PRODIGE 19, aucune différence de SG entre les bras chirurgie d’emblée et chimio péri-opératoire).
- Il faut veiller à faire parvenir les pièces fraîches le plus rapidement possible au service d'anatomo-pathologie pour que soit réalisé un prélèvement destiné à la tumorothèque. Voir les documents de bonnes pratiques des prélèvements tissulaires sur le site de la SFP.
(Préciser si pièces fraîches ou fixées)
- Pièce de gastrectomie totale
mesurant ... cm sur la petite courbure, ... cm sur la grande courbure,
comportant une collerette duodénale de ... cm
comportant une collerette œsophagienne de ... cm.
Tumeur à ... cm du pylore, à ... cm de la petite courbure, à ... cm de la section œsophagienne développée au niveau de la face antérieure - postérieure.
Il existe une tumeur ulcérée / ulcéro - infiltrante / infiltrante / végétante
mesurant ... cm (axe vertical) X ... cm (axe horizontal) X ... cm (épaisseur).
- Pièce de gastrectomie polaire inférieure (des 4/5èmes)
mesurant ... cm sur la petite courbure, ... cm sur la grande courbure,
comportant une collerette duodénale de ... cm.
Tumeur à ... cm du pylore, à ... cm de la petite courbure, à ... cm de la section supérieure la plus proche
développée au niveau de la face antérieure - postérieure.
Il existe une tumeur ulcérée / ulcéro - infiltrante / infiltrante / végétante
mesurant ... cm (axe vertical) X ... cm (axe horizontal) X ... cm (épaisseur).
- Cancers T1 muqueux
- m1 (Tis) : intra-épithélial (= in situ)
- m2 (pT1a) : atteinte de la lamina propria
- m3 (pT1a) : atteinte de la musculaire muqueuse
- Cancers T1 sous-muqueux
- sm1 (pT1b) : atteinte du premier tiers de la sous-muqueuse, évalué à 500 µm
- sm2 (pT1b) : atteinte du 2ème tiers de la sous-muqueuse
- sm3 (pT1b) : atteinte du 3ème tiers de la sous-muqueuse
- Cette tumeur répond à un adénocarcinome : préciser la proportion des différentes composantes :
- papillaire
- tubulaire
- mucineux (composante mucineuse supérieure ou égale à 50 % des territoires tumoraux)
- à cellules isolées (supérieure ou égale à 50 % des territoires tumoraux examinés)
- indifférencié.
- Intestinal
- Diffus (incluant les carcinomes à cellules isolées)
- Mixte (approximativement 50 % de chaque type)
- Adénocarcinome : préciser la proportion des différentes composantes
- Adénocarcinome tubuleux
- Adénocarcinome papillaire
- Adénocarcinome mucineux (composante mucineuse supérieure ou égale à 50 % des territoires tumoraux)
- Adénocarcinome à cellules indépendantes (>50 % de cellules en bague à chaton ou isolées)
- Carcinome adéno-squameux
- Carcinome avec stroma lymphoïde (médullaire)
- Carcinome hépatoïde
- Carcinome épidermoïde
- Carcinome indifférencié
- Carcinome neuroendocrine
- Bien (G1), moyennement (G2), peu (G3), indifférencié (G4), non évaluable (Gx).
(plus de 15) : intérêt d'une analyse par région anatomique plus précise à discuter
- Petite courbure : N ganglion(s) dont X métastasé(s) avec ou sans effraction capsulaire
- Grande courbure qui pourra être subdivisée en 2 parties haute et basse : N ganglion(s) dont X métastasé(s) avec ou sans effraction capsulaire
- Autres : N ganglion(s) dont X métastasé(s) avec ou sans effraction capsulaire.
- Extensions vasculaires ou périnerveuses.
- Stroma réaction lymphoïde.
- Pathologies associées (métaplasie, gastrite, polype, dysplasie, endobrachy-œsophage...).
- Taux de nécrose tumorale sur la pièce de gastrectomie.
- Régression post-thérapeutique après traitement néo-adjuvant le cas échéant.
- Statut MSI, HER2, Helicobacter pylori.
- Marges haute, inférieure
- Résection R0 (complète) ou R1 (incomplète au plan microscopique) ; une résection R2 (incomplète au plan macroscopique) étant définie macroscopiquement peropératoire par le chirurgien.
- Le traitement endoscopique est le traitement de référence en cas de carcinome in situ (Tis de la classification TNM ou T1m1) ou microinvasif (T1m2 ou T1m3). Il doit permettre l'exérèse de toutes les lésions visibles.
- Le traitement endoscopique pour être efficace et éviter les récidives locales, doit être effectué de préférence de manière complète en monobloc. Pour les lésions de plus de 10 mm, la technique de dissection sous-muqueuse (ESD) sera à privilégier dans un centre expert.
- La pièce de résection doit être étalée et orientée avant fixation.
- Les meilleurs indications sont les cancers intramuqueux (T1a) et à morphologie favorable (0-I et 0-II) dans la classification de Paris.
- Les critères de succès de la résection sont définis par des marges de résection profondes saines, la limitation de la lésion au niveau de la muqueuse (pT1a). Si l'examen de la pièce révèle une atteinte au-delà de la sous-muqueuse, (pT1b) de moins de 500 µm (sm1) avec une exérèse curative (complète, monobloc avec des marges latérales et profondes saines et sans embole veineux et lymphatique), le traitement endoscopique peut être suffisant dans certaines situations.
| Lésion | Non ulcérée | Ulcérée | ||||
| ≤ 2 cm | >2 cm | ≤ 3 cm | >3 cm | |||
| pT1a (m) | Différencié | Exérèse curative * | Exérèse curative * | Exérèse curative avec réserve * | Exérèse non curative | |
| Peu différencié | Exérèse curative avec réserve * | Exérèse non curative | Exérèse non curative | Exérèse non curative | ||
| pT1b (sm1) | Différencié | Exérèse curative avec réserve * | Exérèse curative avec réserve * | Exérèse curative avec réserve * | Exérèse non curative | |
| Peu différencié | Exérèse non curative | Exérèse non curative | Exérèse non curative | Exérèse non curative | ||
* si exérèse complète monobloc avec des marges latérales et profondes saines et sans embole veineux et lymphatique.
- Surveillance après traitement endoscopique d'un cancer superficiel :
- Cette référence a été élaborée en intégrant la recommandation produite par la Société Française de Chirurgie Digestive (SFCD) et l'Association de Chirurgie Hépatobiliaire et de Transplantation Hépatique (ACHBT) intitulée "Cancérologie digestive : pratiques chirurgicales". Elle a reçu le label INCa-HAS en février 2009. Le texte argumenté des recommandations (version longue) est disponible sur le site de l'INCa ainsi qu'une version synthétique.
- Gastrectomie carcinologique :
- totale en cas de tumeur proximale du cardia Siewert III ou de linite (analyse extemporanée des tranches de section œsophagienne et duodénale)
- des 4/5èmes en cas de tumeurs distales
- ± jéjunostomie d’alimentation
- Les marges requises sont de 5 cm pour avoir une exérèse carcinologique en cas d'adénocarcinome bien différencié et de 8 à 10 cm en cas de tumeur à cellules isolées et de 1 cm au niveau du duodénal sur pièce fraîche, ce qui permet une gastrectomie totale par voie abdominale avec ablation de l'œsophage abdominal et anastomose œso-jéjunale transhiatale.
- Un examen extemporané doit être demandé selon la localisation tumorale et au moindre doute.
- On recommande un curage D2 sans splénectomie à la localisation de la tumeur et l'état général du patient.
- Le curage D2 comporte au moins 25 ganglions et correspond à l'exérèse des 2 premiers relais ganglionnaires (D1 et ganglions le long des axes vasculaires : hépatique commune, coronaire stomachique ou gastrique gauche et splénique ainsi que le tronc cœliaque). La splénectomie et la pancréatectomie caudale augmentent la morbidité et ne doivent être réalisées que si nécessaire.
- Curage au minimum de type D1 : réservé aux gastrectomies prophylactiques ou aux patients à risque périopératoire élevé.
Il emporte des ganglions périgastriques (petite courbure, grande courbure, supra-pylorique, paracardial droit et infra-pylorique ou gastro-épiploïque droit et gastrique gauche) en cas de gastrectomie des 4/5èmes. Il convient de rajouter les ganglions paracardiaux gauches en cas de gastrectomie totale.
Il est souhaitable de réaliser une dissection au-delà des groupes macroscopiquement envahis. - La résection d'une carcinose péritonéale associée à une chimiothérapie intra-péritonéale (CHIP) peut être discutée en cas d'adénocarcinome de type intestinal avec un index péritonéal limité après validation en RCP (cf. référence Carcinose péritonéale d'origine digestive et rapport HAS juin 2021).
- Le type de curage en fonction de la localisation tumorale est visualisé dans les schémas à télécharger.
- Prise en charge diététique
- Évaluation de la dénutrition clinique (BMI, perte de poids) et biologique (albumine, préalbumine, CRP)
- Renutrition par des compléments per os, par sonde naso-jéjunale, par sonde de jéjunostomie
- Information sur l’alimentation du gastrectomisé
- Immuno-nutrition préopératoire : en préopératoire, chez tous ces patients quel que soit leur état nutritionnel, 1 briquette (Oral Impact®) 3x/jour pendant 7 jours. Un apport moyen de 1 000 kcal/jour est recommandé en plus de l'alimentation orale.
Référence
- HAS : Programmes de réhabilitation rapide en chirurgie : état des lieux et perspectives. Rapport d’orientation.
Saint-Denis. 2014.
- Temps accompagnant soignant.
- Évaluation cardiologique et pulmonaire en fonction du terrain.
- Si une splénectomie est envisagée ou réalisée, voir les recommandations vaccinales.
- Si une gastrectomie totale est envisagée : supplémentation vitaminique nécessaire.
- Gastrectomie des 4/5ème avec anastomose gastro-jéjunale
- Curage ganglionnaire
- Elargissement éventuel aux organes envahis par contiguité, si nécessaire
- Option : examen extemporané des tranches de section pour élargissement
- Gastrectomie totale
- Curage ganglionnaire
- Elargissement éventuel aux organes envahis par contiguité,
si nécessaire et si le contexte clinique le permet - Examen extemporané des tranches de section oesophagienne et duodénale en cas de linite
- chimiothérapie
- traitement endoscopique
- traitement symptomatique
- radiothérapie
- radiochimiothérapie
- Radiochimiothérapie
- Chimiothérapie
- Radiochimiothérapie
- Radiothérapie
- Chimiothérapie palliative
- Abstention
postopératoire
- Chimiothérapie palliative
- Radiothérapie
- Radiochimiothérapie
- Abstention
- Etat général satisfaisant : OMS 0-2
- Pas de contre-indication à la chimiothérapie : recherche d'un déficit en enzyme DPD par la mesure de l'uracilémie pour les chimiothérapies à base de fluoropyrimidines
- Bilan d'extension réalisé
- Avis chirurgical préalable
- Poursuivre en postopératoire à concurrence de 8 cycles au total
- Pour la chimiothérapie néo-adjuvante, évaluation de la réponse avant décision de chirurgie
-
Si une chimiothérapie néo-adjuvante est retenue, le traitement, en fonction de l’état général, de l’âge et des comorbidités, est :
- En première intention / Standard :
- FLOT : 4 cycles préopératoires et 4 cycles postopératoires toutes les 2 semaines (Al-Batran, 2008, 2016, 2017)
- En seconde intention :
- DCF
- Ou, à défaut : 5-FU cisplatine ou FOLFOX (qui n’a jamais été validé dans cette indication précise)
- En première intention / Standard :
- Recommandation : inclusion dans un protocole de recherche
Les thérapies ciblées ne sont pas indiquées en cas de forme localisée. Des études sont actuellement en cours pour évaluer la place du trastuzumab dans les formes localisées de cancer gastrique.
Sur la base de ces constatations, des essais prospectifs sont actuellement en cours pour évaluer la place de l’immunothérapie dans les formes localisées de cancer gastrique (étude NEONIPIGA, NCT04006262). Discussion en RCP si tumeur MSI et/ou HER2 avant tout traitement.
(Bang, 2010 ; Cunningham, 2008 ; Wilke, 2014 ; Al-Batran, 2017)
- Si tumeur HER2 + :
- Etat général satisfaisant : OMS 0-2
- Pas de contre-indication à la chimiothérapie
- 1ère ligne : 5-FU + cisplatine + trastuzumab (ou possibilité de 5-FU + oxaliplatine + trastuzumab)
- Discuter 5-FU + oxaliplatine + trastuzumab + pembrolizumab (étude KEYNOTE-811)
- Si tumeur HER2 - :
- 1ère ligne : chimiothérapie de type FOLFOX, m DCF toujours penser à l’inclusion dans une étude clinique
- 2ème ligne : FOLFIRI, irinotécan en monothérapie, paclitaxel
- Objectif curatif en adjuvant, le plus souvent associée à la chimiothérapie.
- Objectif palliatif : essentiellement antalgique, hémostatique, en complément éventuel d'une chimiothérapie.
- Simulateur - scanner
- Calculateur 3D
- Accélérateur linéaire : photons X ≥ 10 MeV
- Imagerie portale (éventuellement cône beam ou équivalent)
- Dispositifs de repositionnement - contention.
- Imagerie et compte-rendu endoscopique préopératoire
- Compte-rendu opératoire détaillé (avec en particulier description de l'étendue du curage ganglionnaire)
- Compte-rendu anatomo-pathologique détaillé (en particulier sur la topographie et l'extension de la lésion primitive et des extensions ganglionnaires)
- Imagerie postopératoire si patient opéré.
(Tepper, 2002 ; Smalley, 2002)
- Positionnement du patient : décubitus dorsal, mains au-dessus de la tête ou à la rigueur sur le thorax et dispositif permettant un repositionnement précis.
- Volume cible (CTV) :
- il ne s'agit plus de traiter tous les cancers de l'estomac avec le même volume anatomique "classique" (traitant systématiquement l'ensemble des zones à risque et procédant de l'analyse topographique des séries anciennes de récidives post-chirurgicales)
- il faut personnaliser le CTV et l'adapter à la topographie de la tumeur dans l'estomac, à sa taille, à son extension locale, à son extension ganglionnaire, à l'importance du curage réalisé, à d'éventuelles extensions extrahépatiques et à la topographie de(s) anastomose(s).
- Une éventuelle réduction (boost) du volume irradié pourra être réalisée après 45 Gy pour apporter un complément de dose sur la région plus particulièrement à risque (l'analyse des documents iconographiques préopératoires est à ce sujet très importante).
- Balistique : les champs antéro-postérieurs parallèles opposés ont l'avantage de la simplicité mais ils ne permettent pas de dépasser une dose de 45 Gy à cause de la tolérance de la moelle épinière. L'adjonction de champs latéraux parallèles opposés ou d'autres agencements plus complexes avec des pondérations adaptées peuvent être préférables et seront déterminés "sur mesure" au cas par cas.
- La topographie immédiatement sous-diaphragmatique de l'estomac rend compte de la mobilité d'une partie significative du CTV dont on tiendra compte classiquement par l'adaptation des marges du PTV (ou par une technique de type gating en cours d'évaluation, IMRT est bien entendu également en cours d'évaluation).
- Dose, fractionnement, étalement
- Pour les indications curatives, la dose variera généralement de 45 à 55 Gy en fonction de l'indication pré- ou postopératoire et de l'association ou non à une chimiothérapie concomitante. La dose par fraction variera dans les mêmes conditions de 1,8 à 2 Gy.
- On traitera tous les champs tous les jours et on veillera à faire 5 séances par semaine sur un étalement de 5 à 7 semaines.
- Pour les indications palliatives : la dose sera généralement limitée à 30-40 Gy.
- Organes critiques
- Reins
Il n'est pratiquement jamais possible d'éviter l'irradiation des reins en particulier le rein gauche.
On veillera donc à ce qu'au moins un rein (généralement le droit) ne reçoive pas, sur plus d'un quart de son volume, une dose >20 Gy. Le reste étant protégé. - Cœur
Les cancers du tiers supérieur de l'estomac peuvent conduire à irradier un certain volume du myocarde dont il faudra systématiquement maximiser la protection par un blocage adéquat ou un arrangement spécifique des faisceaux. - Foie
Il n'y a en principe pas de risque puisque un tiers et une moitié du foie peuvent recevoir 40 Gy sans aucune complication et que l'ensemble de l'organe supporte jusqu'à 30 Gy.
Une étude systématique des histogrammes dose/volume sera réalisée pour le foie, les reins et le fourreau médullaire. - Moelle épinière
Ne jamais dépasser 45 Gy en 25 fractions et cinq semaines.
- Reins
- La radiothérapie de la région épigastrique est émétigène (intérêt de prescription systématique d'un sétron), anorexigène (intérêt de suivre régulièrement la courbe pondérale et de veiller à une nutrition correcte dès le début du traitement qu'il faudra s'attacher à maintenir pendant celui-ci, fût-ce au prix d'une alimentation entérale par sonde).
- On pourra être conduit à mettre en place une alimentation parentérale.
- De façon générale, la tolérance digestive à la radiothérapie est inversement proportionnelle à l'étendue de la gastrectomie.
(Macdonald, 2001 ; Dahan, 2005)
- A discuter en Réunion de Concertation Pluridisciplinaire (RCP), en particulier lorsque le curage est insuffisant (<D1).
- 45 Gy (1,8 Gy par fraction) avec 5-Fluorouracile et acide folinique (le tout de J1 à J4 et les 3 derniers jours de radiothérapie).
- LV5FU2 (9 cures) ou capécitabine.
- Elle consiste en un examen clinique avec contrôle du poids et évaluation des séquelles.
- Examen clinique :
- tous les 3 mois pendant les 2 premières années
- puis tous les 6 mois pendant 3 ans.
- Scanner de référence post-thérapeutique (option)
- dans les 3 mois suivant la fin du traitement
- puis tous les 6 mois pendant 3 ans
- puis tous les ans pendant 2 ans.
- Si gastrectomie totale, une fois par an : NFS, TP/TCA, iono, urée, créat, CKD, CRP, bilan hépatique, CST/ferritine, vitamines B12 et D, folates érythrocytaires, calcium, phosphore, magnésium
- Bilan biologique (si gastrectomie totale) : une fois par an
- Examens orientés en fonction de la symptomatologie clinique
- ACE, CA 19.9 si élevé initialement (option).
- N'est pas recommandée en cas de gastrectomie totale.
- Après traitement endoscopique d'un cancer superficiel, la première endoscopie de surveillance doit être programmée 3 à 6 mois après la résection, puis l'endoscopie est renouvelée annuellement en raison du risque de cancer métachrone.
- A réaliser en chromoendoscopie avec coloration à l'indigo ou en chromoendoscopie virtuelle avec ou sans zoom.
- Chez les patients guéris après gastrectomie partielle, une surveillance endoscopique après 10 ans est nécessaire afin de détecter une réévolution sur le moignon gastrique : à réaliser tous les 2 ans avec biopsies systématiques.
- Chez un patient traité pour un cancer de l’estomac par gastrectomie partielle, il est essentiel de rechercher et de traiter une infection à Helicobacter pylori pour empêcher le développement d’un cancer de l’estomac sur le moignon restant (Cf. chapitre sur prévention du cancer de l'estomac). Le diagnostic de l’infection doit être fait à l’occasion de l’endoscopie.
- Après gastrectomie totale, surveillance des récidives péri-anastomotiques par échoendoscopie chez des malades sélectionnés à haut risque de récidive (marge envahie et traitée par radiothérapie).
- Un traitement vitaminique B12 est instauré ± folates.
- Une supplémentation systématique est indispensable après gastrectomie totale car la prévalence des carences est très élevée.
- Après gastrectomie totale, la supplémentation orale est efficace et suffisante.
- Les modalités de la supplémentation peuvent être discutées selon l'observance et la facilité pour le patient :
- soit une dose quotidienne de 350 μg
- soit un apport hebdomadaire de 1 000 μg
- soit un apport parentéral de 1 000 μg tous les 1 à 3 mois serait nécessaire pour maintenir le niveau plasmatique.
- Les doses présentes dans les suppléments vitaminiques sont insuffisantes pour éviter les carences après gastrectomie totale.
- En cas de carence préopératoire de vitamine B12 ou si chute importante en postopératoire : passer à la forme intra-musculaire.
- Si le dosage de vitamine B12 en préopératoire et postopératoire immédiat est normal, l'administration per os de vitamine B12 est possible.
- Il faut contrôler tous les 6 mois le taux de vitamine B12, si le dosage chute, repasser à la forme parentérale (1 000 μg/IM/mois ± folates).
- Il faut réaliser une prévention des infections responsables du syndrome post-splénectomie à germes encapsulés : Streptococcus pneumoniae, Haemophilus influenzae, Neisseria meningitidis.
- Lorsqu'une splénectomie est prévue dès la consultation préopératoire, il est souhaitable de réaliser les vaccinations au moins 15 jours avant la chirurgie et idéalement entre 2 à 6 semaines avant la chirurgie. Si les vaccinations n'ont pu être réalisées avant la splénectomie, les faire dans les 10 à 30 jours qui suivent.
- Vaccinations :
- Vaccin antiméningococcique (A+C+Y+W-135) : MENVEO® ou NIMENRIX®
- 2 doses à 6 mois d'intervalle puis une dose tous les 5 ans.
- Vaccin antiméningococcique B : BEXSERO®
- 2 doses à 1 mois d'intervalle puis une dose tous les 5 ans.
- Vaccin antipneumococcique
- 1 dose de PREVENAR 13® puis 2 mois après, 1 dose de PNEUMO VAX®.
- 1 seul rappel de PNEUMO VAX® à 5 ans de la primovaccination.
- Vaccin anti-Haemophilus influenzae de type b
- 1 dose ACT-HIB® (ou vaccin pentavalent combinant anti-diphtérie, tétanos, poliomyélite, coqueluche et Haemophilus type b, si non à jour).
- Rappel tous les 10 ans.
- Vaccin antigrippal saisonnier
- 1 dose tous les ans.
- 1 dose tous les ans.
- Vaccin antiméningococcique (A+C+Y+W-135) : MENVEO® ou NIMENRIX®
- Pénicilline V
- ORACILLINE® 1 cp à 1 MUI 2 fois/j en 2 prises pendant au moins 2 ans après la splénectomie
- En cas d'allergie aux pénicillines (pas d'antibioprophylaxie recommandée) : érythromycine : 500 mg/j en 1 prise.
- Antiagrégant plaquettaire si taux de plaquettes reste >106/mm3
- Conseils classiques en cas de splénectomie (antibioprophylaxie avant soins dentaires), carte de splénectomisé
- Consultation rapide en cas de fièvre.
Références
- Avis relatif aux recommandations vaccinales spécifiques des personnes immunodéprimées ou aspléniques. HCSP 16 février 2012.
- Calendrier des vaccinations et recommandations vaccinales
- Nécessité d'informer le patient des risques infectieux encourus et des situations à risques (voyages et vaccinations spécifiques, plaies, morsures).
- Un arrêt du tabac doit être recommandé.
(Olschwang, 2004 ; Van Der Post, 2015)
- S'il existe un ou plusieurs cas de carcinome gastrique dans la famille : gastroscopie avec biopsies à la recherche d’Helicobacter pylori chez les apparentés au 1er degré et éradication d’Helicobacter pylori si la recherche est positive.
- Interrogatoire à la recherche d'antécédents familiaux d'adénocarcinome ou de linite.
- L'adénocarcinome gastrique peut appartenir à l'ensemble des cancers relevant du syndrome de Lynch (référence Côlon) mais fait aussi partie du phénotype de la polypose adénomateuse rectocolique familiale, du syndrome de Peutz-Jeghers et de la polypose juvénile.
- Les cancers gastriques de type diffus, associant faible différenciation cellulaire et présence de cellules en « bague à chaton », peuvent être sporadiques ou héréditaires. Les formes héréditaires sont caractérisées par un mode de transmission autosomique dominant et une pénétrance élevée, probablement de l'ordre de 70 % à 60 ans.
- Le diagnostic de cancer gastrique de type diffus héréditaire est généralement plus précoce que dans les formes sporadiques et des cas ont été rapportés à des âges particulièrement jeunes, inférieurs à 18 ans. Le pronostic est redoutable, comparable à celui des formes sporadiques (survie de 10 % à 5 ans).
- Un variant pathogène constitutionnel délétère du gène CDH1, qui code pour la protéine d'adhésion inter-cellulaire E-cadhérine, est identifiée dans 50 % des cas environ. Cette altération serait également associée à une augmentation du risque d'autres types tumoraux : carcinomes mammaires de type lobulaire infiltrant et adénocarcinomes colorectaux principalement.
- Une mutation du gène CDH1 doit être recherchée chez un individu atteint dans les situations cliniques suivantes :
- au moins deux cas de cancers gastriques de type diffus avérés chez des apparentés au premier ou second degré dont un cas diagnostiqué avant l'âge de 50 ans
- au moins trois cas de cancers gastriques de type diffus avérés chez des apparentés au premier ou deuxième degré quels que soient les âges au diagnostic, et par extension
- cancer gastrique de type diffus diagnostiqué à un âge inférieur à 40 ou 45 ans
- association d'un cancer gastrique de type diffus et d'un carcinome mammaire de type lobulaire infiltrant ou d'un carcinome colorectal à cellules indépendantes chez un même individu ou chez deux apparentés au premier ou au second degré.
- Si aucun variant pathogène constitutionnel n'a été identifié dans le gène CDH1, il convient de discuter de la recherche d'un variant pathogène constitutionnel dans les gènes CTNNA1.
- Compte tenu des difficultés et de l'absence d'efficacité démontrée de la surveillance endoscopique, de l'absence de traitement médical préventif permettant de diminuer le risque de cancer et de la gravité des risques carcinologiques, une gastrectomie totale prophylactique doit être systématiquement envisagée chez les individus porteurs d'une mutation du gène CDH1.
- 4 cycles préopératoires et 4 cycles postopératoires toutes les 2 semaines
|
Docétaxel : 50 mg/m² IV dans 250 mL NaCl 0,9 % en 1 heure à J1 (précédé et suivi d'une prémédication[1]) Acide folinique 200 mg/m2 IV dans 250 mL NaCl 0,9 % en 30 min à J1 Reprise à J15
|
↑ Prémédication : par exemple prednisolone orodispersible 20 mg : 50 mg matin et soir pendant 3 jours à débuter la veille du traitement (J0), et à J1 et J2.
- Les facteurs de croissance ont été recommandés en prophylaxie secondaire chez les patients présentant une neutropénie fébrile ou des interruptions de traitement en raison de la neutropénie ou de la leucopénie (risque de 5 % sur 128 patients inclus dans la phase II randomisée).
- Adaptation de doses :
- Neutropénie fébrile ou thrombopénie avec saignements : réduire de 25 % les doses de docétaxel et d'oxaliplatine après prescription de G-CSF. Réduire les doses de 50 % si récidive.
- Toxicité > grade 2 (diarrhée ou mucite en particulier) : réduire de 25 % les doses pour et de 50 % si les toxicités ont lieu après une première réduction de dose.
- Toxicité neurologique : en cas de paresthésies ou de dysesthésies persistantes entre les cycles, réduire de 25 % l'oxaliplatine. En cas de paresthésies ou de dysesthésies accompagnées de douleurs ou d'une insuffisance fonctionnelle, réduire de 50 % l'oxaliplatine (si durée entre 7 et 14 jours) ou est supprimé dans d'autres cycles jusqu'à récupération (si toxicité persistante entre les cycles).
- Al-Batran, Salah-Eddin et al.
“Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial.”
| Docétaxel : 75 mg/m² IV en 1 heure à J1 (précédé et suivi d'une prémédication[1]) Cisplatine : 75 mg/m² IV J1 en 1 à 3 heures (avec hyperhydratation) 5-Fluorouracile : 750 mg/m²/j IV en perfusion continue de J1 à J5 Reprise à J22
|
- ↑ Prémédication : par exemple SOLUPRED® orodispersible 20 mg : 50 mg matin et soir pendant 3 jours à débuter la veille du traitement (J0), et à J1 et J2.
Prophylaxie par G-CSF hautement souhaitable (risque de neutropénie fébrile >20 %).
Surveillance étroite de l'hémogramme conseillée.
Il faut 1 500 PNN/mm³ et 100 000 plaquettes/mm³ pour reprendre la cure.
Référence
- Van Cutsem E, Moiseyenko VM, Tjulandin S et al.
Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer : a report of the V325 Study Group.
J Clin Oncol. 2006; 24: 4991-7
| Irinotécan : 80 mg/m² sur 30 min suivi par acide folinique 500 mg/m² sur 2 heures puis 5-Fluorouracile : 2 000 mg/m² sur 22 heures. Schéma hebdomadaire J1=J8, 6 semaines, puis une semaine de repos |
Référence
- Dank M, Zaluski J, Barone C et al.
Randomized phase III study comparing irinotecan combined with 5-fluorouracil and folinic acid to cisplatin combined with 5-fluorouracil in chemotherapy naive patients with advanced adenocarcinoma of the stomach or esophagogastric junction.
Ann Oncol. 2008; 19: 1450-7
| Irinotécan : 180 mg/m² à J1 en 90 min Acide folinique 400 mg/m², J1 en 2h en perfusion en Y (pendant la perfusion d'irinotécan) 5-Fluorouracile : en bolus de 400 mg/m² à J1 juste après l'acide folinique, suivi de 5-Fluorouracile en continu à 2,4 mg/m² au total sur 46 heures, soit 1,2 g/m² à J1 et J2 Reprise à J15
|
Référence
- Bouché O, Raoul JL, Bonnetain F et al.
Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (LV5FU2), LV5FU2 plus cisplatin, or LV5FU2 plus irinotecan in patients with previously untreated metastatic gastric cancer : a Federation Francophone de Cancerologie Digestive Group Study--FFCD 9803.
J Clin Oncol 2004;22:4319-28
| 5-Fluorouracile : 1000 mg/m²/j IV en perfusion continue de J1 à J5 Cisplatine : 100 mg/m² en IV à J2 en 1 à 2 heures (avec hyperhydratation) Reprise à J29
|
Références
- Vanhoefer U, Rougier P, Wilke H et al.
Final results of a randomized phase III trial of sequential high-dose methotrexate, fluorouracil, and doxorubicin versus etoposide, leucovorin, and fluorouracil versus infusional fluorouracil and cisplatin in advanced gastric cancer: A trial of the European Organization for Research and Treatment of Cancer Gastrointestinal Tract Cancer Cooperative Group.
J Clin Oncol 2000;18:2648-57
- Ychou M, Pignon P, Lasser P et al.
Phase III preliminary results of preoperative fluorouracil (F) cisplatin (P) versus surgery alone in adenocarcinoma of stomach and lower esophagus (ASLE) : FNCLCC 94012-FFCD 9703 trial.
J Clin Oncol 2006;24(18S) Part I:4026
- Indications : adénocarcinomes métastatiques de l'estomac ou de la jonction œsogastrique avec surexpression de HER 2 (IHC3+ ou IHC2+ et FISH+) non prétraités (1ère ligne).
- Durée d'une cure : 5 jours ; intervalle entre 2 cures : 3 semaines (J1=J22)
| J1 Trastuzumab : 8 mg/kg (J1C1, dose de charge) puis 6 mg/kg (J1C2 et suivantes) en perfusion IV de 90 min (dose de charge), de 30 min (administrations ultérieures), contemporaine de la préhydratation Cisplatine : 80 mg/m² en en perfusion IV de 60 min, précédée et suivie d'une hyperhydratation J1 à J5 5-Fluorouracile : 800 mg/m²/j en perfusion IV continue (infuseur ou pompe) J6 à J21 inclus Pas de traitement |
- Synopsis
Références
- Bang YJ, Van Cutsem E, Feyereislova A et al.
Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial.
Lancet. 2010 ;376:687-97. Erratum in: Lancet. 2010 ;376:1302
| Oxaliplatine 85 mg/m² en 2 h à J1 Acide folinique 200 mg/m² (ou Acide L-folinique 100 mg/m²) en 2 h en perfusion en Y puis 5-Fluorouracile bolus 400 mg/m² puis 5-Fluorouracile 600 mg/m² en perfusion continue de 22 h à J1 et J2 Reprise à J15 12 cures en adjuvant |
Traitement associé
- Afin de limiter la neurotoxicité, il est recommandé d'injecter une perfusion de gluconate de calcium 1 g et de sulfate de magnésium 1 g en 15 minutes avant et après la perfusion d'oxaliplatine.
Adaptation de doses
- Selon toxicité dans l'intercure
- Toxicité neurologique
- FOLFOX 4 : échelle spécifique de neurotoxicité
Grade 1 : dysesthésies/paresthésies de courte durée avec régression complète avant le cycle suivant
Grade 2 : dysesthésies/paresthésies persistant entre 2 cycles, sans gêne fonctionnelle
Grade 3 : gêne fonctionnelle - Grade 2 : réduire oxaliplatine à 75 mg/m²
Grade 3 ou paresthésies douloureuses : arrêter l'oxaliplatine
- FOLFOX 4 : échelle spécifique de neurotoxicité
- Autres toxicités de grade 3 ou 4 (par exemple neutropénie ou thrombopénie ou diarrhée ou mucite) :
Réduire l'oxaliplatine à 75 mg/m²
Réduire le 5-Fluorouracile bolus à 300 mg/m²
Réduire le 5-Fluorouracile continu/22 h à 500 mg/m² - Toxicité cutanée de grade 3-4 : réduire seulement le 5-Fluorouracile
- Toxicité cardiaque, cérébelleuse ou allergie de grade 3-4 : arrêt de la chimiothérapie.
- Toxicité neurologique
- Le jour de la reprise du cycle J1
- Il faut 1 500 PNN/mm et 100 000 plaquettes/mm pour reprendre le cycle.
Référence
- André T, Boni C, Mounedji-Boudiaf L et al.
Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer.
N Engl J Med 2004; 350 : 2343-51.
- Une cure de chimiothérapie FUFOL Mayo Clinic
- 5-Fluorouracile : 425 mg/m²/j IV bolus de J1 à J5
- Acide folinique : 20 mg/m²/j IV bolus de J1à J5
- 1 cycle suivi d'une radiochimiothérapie de J29 à J63
- 45 Gy : 1,8 Gy/fr ; 5 fr/sem
- Acide folinique : 20 mg/m²/j IV de J29 à J32 et de J61 à J63
- 5-Fluorouracile : 400 mg/m²/j IV bolus de J29 à J32 et de J61 à J63
(chimiothérapie les 4 premiers et les 3 derniers jours de la radiothérapie)
- 1 mois de pause
- 2 cures de chimiothérapie FUFOL Mayo Clinic ensuite à 28 jours d'intervalle.
Références
- Macdonald JS, Smalley SR, Benedetti J et al.
Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastrœsophageal junction.
N Engl J Med 2001; 345:725-30. - Smalley SR, Gunderson L, Tepper J et al.
Gastric surgical adjuvant radiotherapy consensus report: rationale and treatment implementation.
Int J Radiat Oncol Biol Phys 2002; 52:283-93.
- Acide folinique : 200 mg/m² (ou acide L folinique 100 mg/m²) en 2 h dans 250 mL de glucose 5 % à J1
- puis 5-Fluorouracile en bolus de 400 mg/m² en 10 min à J1
- puis 5-Fluorouracile : 2400 mg/m² en perfusion continue de 46 h de J1 à J2
- Reprise du cycle à J15.
- 2 à 4 cures avant la radiothérapie
- 3 cures pendant la radiothérapie (semaine 1, 3, 5)
- 4 cures après la radiothérapie.
Référence
- Dahan L, Atlan D, Bouché O et al.
Postoperative chemoradiotherapy after surgical resection of gastric adenocarcinoma: can LV5FU2 reduce the toxic effects of the MacDonald regimen? A report on 23 patients.
Gastroenterol Clin Biol 2005; 29:11-5
(Hébergement des Essais Cliniques et Thérapeutiques en Oncologie Régional) :

-
ASPEN-06 : Etude de phase 2-3, évaluant l'évorpacept (ALX148), chez des patients ayant un adénocarcinome avancé gastrique ou de la jonction gastro-œsophagienne surexprimant HER2
- Statut : Ouvert (12-08-2021 - 31-08-2028)
- Promoteur : ALX Oncology Inc.
-
BEVANEC - PRODIGE 41 : Etude de phase 2 randomisée évaluant l’efficacité du bévacizumab associé à une chimiothérapie de type FOLFIRI, en 2ème ligne de traitement après échec de l’association cisplatine (ou carboplatine) et étoposide, chez des patients ayant un carcinome neuroendocrine peu différencié primitif gastro-entéro-pancréatique ou inconnu, avancé et inopérable.
- Statut : Ouvert (04-09-2017 - 04-03-2023)
- Promoteur : Hospices Civils de Lyon (HCL)
-
BP29842 : Etude de phase Ia/Ib visant à évaluer la sécurité, la pharmacocinétique et l’activité thérapeutique du RO6874281, une immunocytokine, variante de l’interleukine-2 (IL-2V) ciblant la protéine d’activation des fibroblastes-α (FAP), administré en monothérapie (partie A) ou en association avec le trastuzumab ou le cétuximab (partie B ou C).
- Statut : Ouvert (29-01-2018 - 30-06-2021)
- Promoteur : Hoffmann-La Roche
-
BGB-A317-305 : Etude de phase III visant à comparer l’efficacité et la sécurité d’emploi du Tislelizumab (BGB-A317) associé au platine et à la fluoropyrimidine en tant que traitement de 1ere ligne chez des patients atteints d’un adénocarcinome de l’estomac ou de la jonction gastro-œsophagienne métastatique ou localement avancé non résécable
- Status : Ouvert (06-01-2020 - 31-08-2022)
- Promoteur : BeiGene
-
DESTINY-Gastric04 : Etude de phase 3, randomisée, évaluant le trastuzumab déruxtécan, chez des patients ayant un adénocarcinome de l’estomac ou de la jonction gastro-oesophagienne (JGO) métastatique et/ou non résécable, HER2 positif et ayant progressé pendant ou après un schéma thérapeutique contenant du trastuzumab
- Statut : Ouvert (21-05-2021 - 15-11-2024)
- Promoteur : Daiichi Sankyo, Inc.
-
EORTC 1203 (INNOVATION) : Étude néoadjuvante utilisant le trastuzumab ou le trastuzumab avec du pertuzumab dans l'adénocarcinome à jonction gastrique ou gastro-œsophagienne - INNOVATION
- Statut : Clos aux inclusions (01-09-2015 - 18-11-2021)
- Promoteur : EORTC
-
EORTC-22114 TOP GEAR : Essai de thérapie préopératoire pour l'adénocarcinome gastrique et de la jonction œsogastrique. Un essai randomisé de phase II/III entre la chimioradiothérapie préopératoire et la chimiothérapie préopératoire pour le cancer gastrique résécable.
- Statut : Ouvert (01-09-2009 - 31-12-2026)
- Promoteur : EORTC
-
EPIC : Etude de phase III, randomisée, multicentrique, évaluant l’impact sur la survie globale d’une prise en charge palliative précoce chez des patients ayant un cancer métastatique du haut appareil digestif traité par une chimiothérapie de première ligne.
- Statut : Ouvert (10-10-2016 - 31-10-2022)
- Promoteur : Centre Oscar Lambret Centre de Lutte Contre le Cancer (CLCC) de Lille
-
EX2TRICAN : Etude évaluant la place de la stratégie d'analyse de l'exome dans l'identification de facteurs de prédisposition génétique dans les formes précoces de cancer
- Statut : Ouvert (22-10-2019 - 10-10-2024)
- Promoteur : Centre Georges François Leclerc
-
EXOMA : Etude exploratoire visant à évaluer l’impact d’une analyse du profil génétique par la technique « Next Generation sequencing » (NGS) à haut débit sur la décision thérapeutique chez des patients ayant une tumeur solide
- Statut : Ouvert (12-05-2016 - 26-06-2021)
- Promoteur : Centre Georges François Leclerc
-
FIDES-03 : Dérazantinib seul ou en association avec le paclitaxel, le ramucirumab ou l'atezolizumab dans l'adénocarcinome gastrique
- Statut : Ouvert (06-10-2020 - 31-07-2023)
- Promoteur : Basilea Pharmaceutica
-
FIGHT-207 / INCB54828-207 : Etude de phase II visant à évaluer l’efficacité et la sécurité d’emploi du pémigatinib chez des patients atteints d’une tumeur solide précédemment traitée, localement avancée/métastatique ou non résécable avec des mutations activatrices ou translocations d’un des gènes FGFR.
- Statut : Ouvert (23-01-2020 - 17-12-2021)
- Promoteur : Incyte Corporation
-
FREGAT : Constitution d'une base de données clinico-biologique nationale française des cancers oeso-gastriques
- Status : Ouvert (01-06-2014 - 01-05-2027)
- Promoteur : CHU LILLE
-
GASTFOX-PRODIGE 51 : Essai de phase III randomisé évaluant le FOLFOX avec ou sans docetaxel (TFOX) en 1ere ligne de chimiothérapie des adénoarcinomes oeso-gastriques localement avancés ou métastatiques
- Status : Ouvert (22-05-2018 - 31-08-2022)
- Promoteur : FFCD
-
HERIZON-GEA-01 : Etude de phase 3, randomisée, évaluant le zanidatamab en association avec une chimiothérapie avec ou sans tislelizumab, chez des patients ayant un adénocarcinome gastro-œsophagien localement avancé ou métastatique HER2-positif non résécable
- Statut : Ouvert (02-12-2021 - 31-07-2025)
- Promoteur : Zymeworks Inc.
-
IMHOTEP : Etude de phase 2, évaluant l’efficacité d’un traitement par immunothérapie, chez des patients ayant un carcinome non résécable non traité avec des instabilités des microsatellites et une défaillance du système de réparation de l'ADN (MSI-dMMR) ou un cancer gastrique EBV+
- Statut : Ouvert (18-10-2021 - 31-10-2026)
- Promoteur : Centre Leon Berard
-
IMMUNOGAST : Etude de phase 2, évaluant l’efficacité de combinaisons d’immunothérapies personnalisées, chez des patients ayant un adénocarcinome de l’estomac métastatique ou avancé en rechute
- Statut : Ouvert (19-03-2021 - 26-10-2023)
- Promoteur : Hospices Civils de Lyon
-
ITHER : Etude visant à évaluer l’intérêt de la réponse immune anti-télomérase des lymphocytes auxiliaires T CD4+ comme marqueur prédictif de l’efficacité des immunothérapies ciblant PD-1/PD-L1
- Status : Ouvert (01-07-2016 - 22-06-2021)
- Promoteur : Centre Hospitalier Universitaire de Besançon
-
KEYNOTE-585 : Étude de phase 3 randomisée comparant l’efficacité du pembrolizumab associé à une chimiothérapie (XP ou FP) avec celle d’un placebo associé à une chimiothérapie (XP ou FP) en traitement néoadjuvant et adjuvant chez des patients ayant un adénocarcinome de l’estomac ou un adénocarcinome de la jonction gastrooesophagienne.
- Status : Ouvert (09-10-2017 - 26-07-2023)
- Promoteur : BRISTOL MYERS SQUIBB
-
KEYNOTE-811 / MK 3475-811 : Etude de phase III randomisée comparant l’efficacité du pembrolizumab associé au trastuzumab et à une chimiothérapie par rapport au placébo associé au trastuzumab et à une chimiothérapie en première ligne de traitement chez des patients ayant un adénocarcinome de l’estomac ou de la jonction gastro-oesophagienne métastatique HER2 positif
- Status : Ouvert (05-10-2018 - 01-06-2023)
- Promoteur : Merck Sharp & Dohme
-
KEYNOTE-859 / MK3475-859 : Etude de phase III randomisée évaluant l’efficacité du pembrolizumab associé à une chimiothérapie par rapport à un placebo associé à une chimiothérapie comme traitement de première ligne chez des patients ayant un carcinome de l’estomac ou de la jonction gastro-oesophagienne métastatique HER2 négatif.
- Status : Ouvert (07-11-2018 - 28-09-2024)
- Promoteur : Merck Sharp & Dohme
-
MATTERHORN : Évaluation du durvalumab et de la chimiothérapie FLOT dans le cancer de la jonction gastrique et gastro-œsophagienne résécable
- Statut : Ouvert (17-11-2020 - 14-02-2025)
- Promoteur : AstraZeneca
-
METIMGAST : Association Capmatinib + Spartalizumab dans l'Adénocarcinome Oesogastrique Avancé
- Statut : Ouvert (22-03-2022 - 31-10-2025)
- Promoteur : Assistance Publique - Hôpitaux de Paris
-
NEONIPIGA : Etude de phase II évaluant le nivolumab et l’ipilimumab en préopératoire et nivolumab en postopératoire chez des patients ayant un adénocarcinome oesogastrique localisé avec instabilité micro satellitaire (MSI) et / ou déficience dans la réparation des mésappariements (dMMR)
- Statut : Ouvert (23-10-2019 - 30-04-2021)
- Promoteur : GERCOR
-
ObservAG : Etude de soins courants évaluant l’observance des thérapies anticancéreuses par voie orale chez les patients de plus de 75 ans versus de moins de 75 ans suivis au centre Georges François Leclerc
- Statut : Ouvert (30-11-2016 - 01-07-2021)
- Promoteur : Centre Georges François Leclerc
-
PK-MAB : Etude de l’impact relatif de différents facteurs de variabilité de l’élimination des anticorps monoclonaux : implication du FcRn (récepteur néonatal pour la partie Fc des anticorps) et de l’historique thérapeutique.
- Status : Ouvert (19-03-2015 - 30-09-2020)
- Promoteur : Centre Hospitalier Universitaire de Besançon
-
PRODIGE 55 - SOCRATE : Etude de phase II randomisée évaluant l’efficacité d’une seconde ligne de chimiothérapie par du ramucirumab en association avec du paclitaxel ou non chez des patients âgés ayant un adénocarcinome de l’estomac ou de la jonction oeso-gastrique, métastatique ou localement avancé, non résécable.
- Statut : Ouvert (15-09-2018 - 15-12-2022)
- Promoteur : Fédération Francophone de Cancérologie Digestive (FFCD)
-
PRODIGE 59 - DURIGAST : Etude de phase II comparant l’efficacité d’une chimiothérapie dite FOLFIRI associé à du durvalumab, par rapport à du FOLFIRI associé à du durvalumab et du trémélimumab, comme traitement de 2ème ligne, chez des patients ayant un adénocarcinome gastrique ou de la jonction oesogastrique avancé
- Statut : Ouvert (07-05-2022 - 15-11-2023)
- Promoteur : Federation Francophone de Cancerologie Digestive
-
PRODIGE 69 - FOLFIRINEC : Etude de phase II évaluant l’efficacité du mFOLFIRINOX vs platine - etoposide chez les patients atteints de carcinomes neuro-endocrines peu différenciés de grade 3 métastatiques gastro-entero-pancréatiques et de primitif inconnu avec l’établissement d’un profil moléculaire à la recherche de cibles thérapeutiques
- Statut : Ouvert (30-09-2020 - 01-09-2024)
- Promoteur : Fédération Francophone de Cancérologie Digestive
-
PROPERTY : Étude randomisée, en double aveugle, multicentrique, contrôlée par placebo, évaluant la neurotoxicité chez des patients atteints d’un cancer gastro-intestinal métastatique prenant du phycocare ou un placebo pendant une chimiothérapie* à base d'oxaliplatine
- Statut : Ouvert (01-04-2022 - 31-03-2025)
- Promoteur : Nantes University Hospital
-
REGIRI - PRODIGE 58 : Etude de phase II randomisée évaluant l’utilisation du REGorafenib associé à l’IRInotécan en deuxième ligne de traitement chez des patients atteints d’un adénocarcinome œsogastrique métastatique
- Status : Ouvert (05-07-2019 - 30-11-2022)
- Promoteur : UNICANCER
-
SAR408701 TED13751 : Etude de phase I/II, évaluant la tolérance, la pharmacocinétique et l'activité anti-tumorale de SAR408701, chez des patients ayant une tumeur solide avancée
- Statut : Ouvert (22-03-2018 - 31-03-2021)
- Promoteur : SANOFI
-
PRODIGE 55 - SOCRATE : Etude de phase II randomisée évaluant l’efficacité d’une seconde ligne de chimiothérapie par du ramucirumab en association avec du paclitaxel ou non chez des patients âgés ayant un adénocarcinome de l’estomac ou de la jonction oeso-gastrique, métastatique ou localement avancé, non résécable.
- Statut : Ouvert (15-09-2018 - 15-12-2022)
- Promoteur : Fédération Francophone de Cancérologie Digestive (FFCD)
- STELLAR-001 : Etude de phase I évaluant l'innocuité, la tolérance et l'activité antitumorale du IPH5401 associé à du durvalumab chez des patients adultes ayant des tumeurs solides avancées sélectionnées
-
STRONG : étude de phase 3 randomisée visant à évaluer la sécurité d’emploi, la tolérance et l’efficacité du durvalumab à dose fixe associé au trémélimumab ou au durvalumab en monothérapie chez des patients ayant des tumeurs solides avancées.
- Statut : Clos aux inclusions (17-04-2017 - 26-03-2023)
- Promoteur : AstraZeneca
-
SURGIGAST : SURGIGAST : Résection chirurgicale plus chimiothérapie versus chimiothérapie seule dans le cancer gastrique oligométastatique de stade IV
- Statut : Ouvert (25-05-2021 - 28-02-2023)
- Promoteur : CHU de Lille
-
XL 184-021 : Etude de phase 1b avec escalade de dose portant sur le CABOZANTINIB (XL184) administré seul ou en association avec l’atézolizumab chez des patients atteints de tumeurs solides localement avancées ou métastatiques.
- Statut : Ouvert (05-09-2017 - 31-12-2021)
- Promoteur : Exelixis
(Protocole n°UC-0105/1303- EudraCT N°2013-000885-13)
- Accès sécurisé au crizotinib pour les patients souffrant d’une tumeur porteuse d’une altération génomique sur une des cibles biologiques de la molécule.
- Evaluer l'efficacité du crizotinib seul sur divers type de tumeurs en se basant sur la présence d'altérations moléculaires activatrices identifiées sur des gènes cibles du crizotinib, par cohorte, par pathologie et par cible.
- En Alsace
- Hôpitaux Universitaires de Strasbourg : Nouvel Hôpital Civil, Hôpital Hautepierre
- En Lorraine
- CHRU de Nancy : Hôpital Central, Hôpitaux de Brabois, Hôpital d'Enfants
- Institut de Cancérologie de Lorraine-Alexis Vautrin.
- AcSé crizotinib : AcSé crizotinib : Étude de phase II, évaluant l’efficacité et la toxicité du crizotinib en monothérapie, chez des patients ayant une tumeur porteuse d’une altération des gènes ALK, MET ou ROS1. Guidée par des analyses biologiques, transtumorale, multicentrique, ouverte, non randomisée, multicohortes
- Intérêt de la ChimioHyperthermie Intrapéritonéale (CHIP) adjuvante à l’oxaliplatine dans le traitement curatif des cancers gastriques avancés. Etude nationale, randomisée et multicentrique de phase III.
- Evaluer l'efficacité de la CHIP sur la survie à 5 ans des patients opérés à visée curative d'un adénocarcinome de l'estomac localement avancé ( T3-T4 ou N+ ou cytologie péritonéale +).
- En Alsace
- Hôpitaux Universitaires de Strasbourg : Hôpital Hautepierre
- En Franche-Comté
- CHRU de Besançon : Hôpital Jean Minjoz
- En Lorraine
- Institut de Cancérologie de Lorraine-Alexis Vautrin
- Institut de Cancérologie de Lorraine-Alexis Vautrin
- Voir le synopsis
- Voir la présentation de l'étude (site BMC cancer)
-
GASTRICHIP : Intérêt de la ChimioHyperthermie Intrapéritonéale (CHIP) adjuvante à l’oxaliplatine dans le traitement curatif des
cancers gastriques avancés.
Etude nationale, randomisée et multicentrique de phase III.
- Status : Ouvert (24-06-2013 - 31-05-2023)
- Promoteur : Hospices Civils de Lyon (HCL)
- Abe S, Oda I, Suzuki H, Nonaka S et al.
Short- and long-term outcomes of endoscopic submucosal dissection for undifferentiated early gastric cancer.
Endoscopy. 2013 ;45:703-7
- Al-Batran SE, Hartmann JT, Hofheinz R et al.
Biweekly fluorouracil, leucovorin, oxaliplatin, and docetaxel (FLOT) for patients with metastaticadenocarcinoma of the stomach or esophagogastric junction: a phase II trial of the Arbeitsgemeinschaft Internistische Onkologie.
Ann Oncol. 2008;19:1882-7
- Al-Batran SE, Hofheinz RD, Pauligk C et al.
Histopathological regression after neoadjuvant docetaxel, oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, and fluorouracil or capecitabine in patients with resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4-AIO): results from the phase 2 part of a multicentre, open-label, randomised phase 2/3 trial.
Lancet Oncol. 2016 ;17:1697-1708
- Al-Batran SE, Homann N, Schmalenberg H et al.
Perioperative chemotherapy with docetaxel, oxaliplatin, and fluorouracil/leucovorin (FLOT) versus epirubicin, cisplatin, and fluorouracil or capecitabine (ECF/ECX) for resectable gastric or gastroesophageal junction (GEJ) adenocarcinoma (FLOT4-AIO): A multicenter, randomized phase 3 trial.
J Clin Oncol 2017 ; 35 (suppl); abstr 4004
- Al-Batran SE, Homann N, Pauligk C et al.
Effect of Neoadjuvant Chemotherapy Followed by Surgical Resection on Survival in Patients With Limited Metastatic Gastric or Gastroesophageal Junction Cancer: The AIO-FLOT3 Trial.
JAMA Oncol. 2017 Apr 27.
- Al-Batran, Salah-Eddin et al.
“Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial.”
- Bang YJ, Van Cutsem E, Feyereislova A et al. (ToGA Trial Investigators).
Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-œsophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial.
Lancet. 2010;376:687-97
- Becker K, Mueller JD, Schulmacher C, Ott K et al.
Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy.
Cancer. 2003 ;98:1521-30
- Bouché O, Raoul JL, Bonnetain F et al.
Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (LV5FU2), LV5FU2 plus cisplatin, or LV5FU2 plus irinotecan in patients with previously untreated metastatic gastric cancer : a Federation Francophone de Cancerologie Digestive Group Study--FFCD 9803.
J Clin Oncol 2004;22:4319-28.
- Butler CC, Vidal-Alaball J, Cannings-John R et al.
Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency: a systematic review of randomized controlled trials.
Fam Pract. 2006 ;23:279-85
- Cunningham D, Starling N, Rao S et al.
Upper Gastrointestinal Clinical Studies Group of the National Cancer Research Institute of the United Kingdom.
Capecitabine and oxaliplatin for advanced esophagogastric cancer.
N Engl J Med. 2008 ;358:36-46
- Dahan L, Atlan D, Bouché O et al.
Postoperative chemoradiotherapy after surgical resection of gastric adenocarcinoma: can LV5FU2 reduce the toxic effects of the MacDonald regimen? A report on 23 patients.
Gastroenterol Clin Biol 2005; 29:11-5
- Dank M, Zaluski J, Barone C et al.
Randomized phase III study comparing irinotecan combined with 5-fluorouracil and folinic acid to cisplatin combined with 5-fluorouracil in chemotherapy naive patients with advanced adenocarcinoma of the stomach or esophagogastric junction.
Ann Oncol. 2008; 19: 1450-7
- Graham DY, Schwartz JT, Cain GD, Gyorkey F.
Prospective evaluation of biopsy number in the diagnosis of esophageal and gastric carcinoma.
- De Korwin JD.
New recommendations for the diagnosis and the treatment of Helicobacter pylori infection.
Presse Med. 2013 ;42:309-17
- HAS
Programmes de réhabilitation rapide en chirurgie : état des lieux et perspectives. Rapport d’orientation.
Saint-Denis. 2014.
- Jiang L, Yang KH, Guan QL, Zhao P et al.
Survival and recurrence free benefits with different lymphadenectomy for resectable gastric cancer: a meta-analysis.
J Surg Oncol. 2013 ;107:807-14
-
Kim S, Fiteni F, Paget-Bailly S et al.The impact of taxane-based preoperative chemotherapy in gastroesophageal signet ring cell adenocarcinomas.
-
Kim S., Paget-Bailly S., Messager M. et al.
Perioperative docetaxel, cisplatin, and 5-fluorouracil compared to standard chemotherapy for resectable gastroesophageal adenocarcinoma.
European Journal of Surgical Oncology (EJSO), 2017, vol. 43, no 1, p. 218-225
- Kodera Y, Yamamura Y, Shimizu Y et al.
Adenocarcinoma of the gastrœsophageal junction in Japan : relevance of Siewert's classification applied to 177 cases resected at a single institution.
J Am Coll Surg. 1999; 189: 594-601
- Lecomte T, Godart B, Rahmi G.
Prise en charge endoscopique des cancers superficiels de l’estomac.
Acta endoscopica 2017
- Lv X, Wang C, Xie Y, Yan Z et al.
Diagnostic efficacy of magnifying endoscopy with narrow-band imaging for gastric neoplasms: a meta-analysis.
PLoS One. 2015 ;10:e0123832
- Macdonald JS, Smalley SR, Benedetti J et al.
Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastrœsophageal junction.
N Engl J Med 2001; 345:725-30
- Messager M, Lefevre JH, Pichot-Delahaye V et al.
The impact of perioperative chemotherapy on survival in patients with gastric signet ring cell adenocarcinoma: a multicenter comparative study.
Ann Surg. 2011 ;254:684-93
- Niwa H.
Comments on the classification.
- Olschwang S, Bonaiti C, Feingold J, Frebourg T et al.
Identification et prise en charge du syndrome HNPCC (hereditary non polyposis colon cancer), Prédisposition héréditaire aux cancers du côlon, du rectum et de l'utérus
Bull Cancer 2004;91:303-15
- Park SH, Lim DH, Sohn TS, Lee J et al.; ARTIST 2 investigators.
A randomized phase III trial comparing adjuvant single-agent S1, S-1 with oxaliplatin, and postoperative chemoradiation with S-1 and oxaliplatin in patients with node-positive gastric cancer after D2 resection: the ARTIST 2 trial().
Ann Oncol. 2021 Mar;32(3):368-374
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T et al.
Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline.
Endoscopy. 2015 ;47:829-54
- Shin KY, Jeon SW, Cho KB et al.
Clinical outcomes of the endoscopic submucosal dissection of early gastric cancer are comparable between absolute and new expanded criteria.
Gut Liver. 2015 ;9:181-7
- Smalley SR, Gunderson LL, Tepper JE et al.
Gastric surgical adjuvant radiotherapy consensus report : rationale and treatment implementation.
Int J Radiat Oncol Biol Phys 2002;52:283-93
- Songun I, Putter H, Kranenbarg EM et al.
Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial.
Lancet Oncol. 2010 ;11:439-49
- Tepper JE, Gunderson LL
Radiation treatment parameters in the adjuvant postoperative therapy of gastric cancer.
Semin Radiat Oncol 2002;12:187-95
- The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon : november 30 to december 1, 2002
Gastrointest Endosc 2003 ; 58 (6 Suppl) : S 3-43
- Van Cutsem E, Moiseyenko VM, Tjulandin S et al.
Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer : a report of the V325 Study Group.
J Clin Oncol. 2006; 24: 4991-7
- Van Der Post RS, Vogelaar IP, Carneiro F et al.
Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers.
J Med Genet. 2015;52:361-374
- Vanhoefer U, Rougier P, Wilke H et al.
Final results of a randomized phase III trial of sequential high-dose methotrexate, fluorouracil, and doxorubicin versus etoposide, leucovorin, and fluorouracil versus infusional fluorouracil and cisplatin in advanced gastric cancer: A trial of the European Organization for Research and Treatment of Cancer Gastrointestinal Tract Cancer Cooperative Group.
J Clin Oncol 2000;18:2648-57
- Wilke H, Muro K, Van Cutsem E et al.
Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial.
Lancet Oncol. 2014 ;15:1224-35
- Yamaguchi N, Isomoto H, Fukuda E, Ikeda K et al.
Clinical outcomes of endoscopic submucosal dissection for early gastric cancer by indication criteria.
Digestion. 2009;80:173-81
- Ychou M, Pignon P, Lasser P et al.
Phase III preliminary results of preoperative fluorouracil (F) cisplatin (P) versus surgery alone in adenocarcinoma of stomach and lower esophagus (ASLE) : FNCLCC 94012-FFCD 9703 trial.
J Clin Oncol 2006;24(18S) Part I:4026
- Ychou M, Boige V, Pignon JP, Conroy T et al.
Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial.
J Clin Oncol. 2011 ;29:1715-21
- Zaanan A, Bouche O, Benhaim L et al.
Gastric cancer: French intergroup clinical practice guidelines for diagnosis, treatments and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED,
SFRO).
Dig Liver Dis 2018;50:768-779


