Cette référence de bonnes pratiques cliniques, dont l'utilisation s'effectue sur le fondement des principes déontologiques d'exercice personnel de la médecine, a été élaborée par un groupe de travail pluridisciplinaire de professionnels de santé des réseaux régionaux de cancérologie de Bourgogne-Franche-Comté (OncoBFC) et du Grand Est (NEON), en tenant compte des recommandations et règlementations nationales, conformément aux données acquises de la science au 27 janvier 2022.
- Cette référence concerne les adénocarcinomes in situ et invasifs de l'œsophage, Siewert I et II.
- Elle contient des arbres de décision en fonction de l'extension tumorale (Cf. classifications) ainsi que les principes de prise en charge diagnostique et thérapeutique.
- Pour les adénocarcinomes situés sous le cardia (Siewert III), voir la référence Estomac.
(Shaheen, 2009 ; Spechler, 2014 ; Rugge, 2014 ; Fléjou, 2007 ; Hvid-Jensen, 2011)
- L'adénocarcinome de l'œsophage est fréquemment associé à un endobrachyœsophage (EBO) ou œsophage de Barrett qu'il faut systématiquement rechercher.
- La plupart des tumeurs malignes de la jonction œsogastrique sont représentées par les adénocarcinomes. Le type histologique est déterminé selon l'architecture (tubuleux, à prédominence papillaire, mucineux ou à cellules dissociées). Ils sont gradés selon leur degré de différenciation : bien, moyennement ou peu différencié. Les carcinomes adénosquameux et les carcinomes endocrines à petites cellules existent mais sont exceptionnels.
- Plus de 95 % des adénocarcinomes du bas œsophage sont associés à un endobrachyœsophage. Les adénocarcinomes non liés au Barrett sont très rares, survenant sur hétérotopie gastrique ou sur les glandes muqueuses œsophagiennes.
- La définition histologique d'un œsophage de Barrett est la présence d'une muqueuse métaplasique au-dessus de la ligne Z. Cette métaplasie peut être fundique, cardiale ou de type intestinale. La métaplasie intestinale (ou spécialisée) est la seule qui définisse la muqueuse de Barrett, laquelle est le précurseur de presque tous les adénocarcinomes. Le risque absolu de dégénérescence d'une muqueuse de Barrett est évalué à 0,12 % par an selon une étude en population générale.
- Les biopsies étagées réalisées sur la zone de jonction doivent préciser le caractère métaplasique, la présence ou non de dysplasie ou néoplasie intra-épithéliale (à classer selon la classification de Vienne) ou la présence de lésions infiltrantes.
- En cas de récidive locale ou de métastase à distance (adénopathie exclue), il faut rechercher une surexpression ou une amplification d'HER2.
- Classification de Vienne révisée (2002) des lésions néoplasiques épithéliales gastro-intestinales :
| Catégories diagnostiques | |
| 1 | Absence de néoplasie/dysplasie |
| 2 | Indéterminée pour la néoplasie/dysplasie |
| 3 | Néoplasie non invasive de bas grade (adénome/dysplasie de bas grade) |
| 4 |
Néoplasie non invasive de haut grade
|
| 5 | Néoplasie invasive envahissant la sous-muqueuse et au-delà. |
- Fiche standardisée INCa - Compte-rendu anatomo-pathologique : Tumeur primitive de l'œsophage
- Réalisé dans le cadre du bilan initial, il repose sur l'interrogatoire, l'examen clinique du patient et la fibroscopie œsogastrique avec biopsies multiples.
- Etat général OMS
- Poids actuel, poids habituel, indice de masse corporelle (IMC)
- % d'amaigrissement sur les 6 derniers mois
- Degré de dysphagie avec date de début
- Douleurs thoraciques
- Antécédents personnels : reflux gastro-œsophagien ? Autre ?
- Consommation d'alcool (g/j) et de tabac (paquet-année)
- Antécédents familiaux de cancer gastrique ou de syndrome de Lynch.
- Rechercher :
- des adénopathies cervicales et/ou sus-claviculaires
- des signes de cirrhose
- des signes d'artérite
- d'autres tares associées.
- Evaluer l'état dentaire.
- Biopsies
- Description précise :
- de la morphologie (classification de Paris)
- de la position de la tumeur
(par rapport aux arcades dentaires, à la bouche de Killian) - du pourcentage de circonférence d'atteinte
- Si la lésion est franchissable, description de :
- la longueur de la lésion
- la position du cardia
- l'extension gastrique si elle existe (petite courbure)
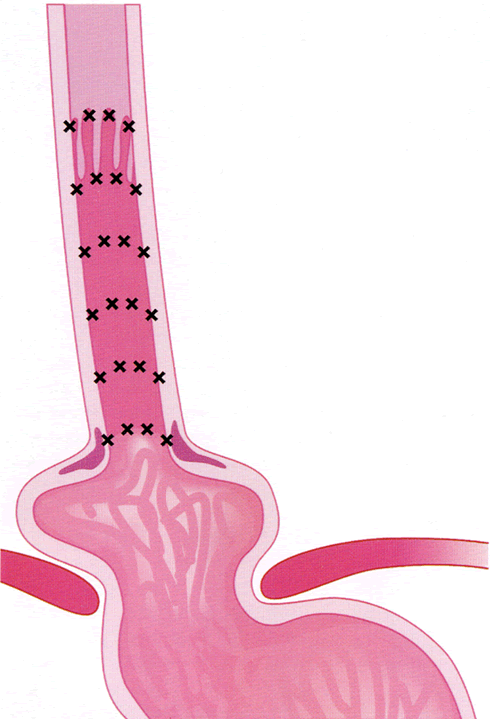
- description de l'éventuelle endobrachyœsophage :
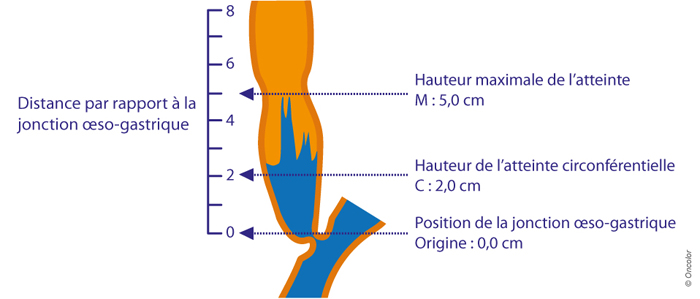
- hauteur de l'atteinte circonférentielle (C)
- hauteur maximale de l'atteinte (M) par rapport aux arcades dentaires
(classification de Prague)
- position de la tumeur par rapport à la ligne œsogastrique,
préciser si la lésion visible en vision directe et/ou rétro-vision
(classification de Siewert)
- Si muqueuse de Barett (classification de Prague) : cartographie et biopsies dans
des flacons séparés et identifiés (cf. recommandations SFED) - Si récidive locale ou métastases à distance, recherche d'une surexpression de HER2
- Exemple d'une représentation schématique de l'œsophage de Barrett endoscopique montrant une zone classée C2M5 : elle décrit la hauteur de l'atteinte circonférentielle (C) et la hauteur maximale de l'atteinte (M), ce qui permet d'en déduire la hauteur des languettes éventuelles.
(Lightdale, 2005 ; Vazquez-Sequeiros, 2003)
- Examen clinique
- Scanographie cervico-thoraco-abdominale
- Echoendoscopie œsophagienne si cancer non sténosant et non métastatique, éventuellement avec ponction pour déterminer le stade N si celui-ci modifie la stratégie thérapeutique
- TEP-TDM au 18F-FDG si traitement à visée curative possible ou si radiochimiothérapie première pour adapter le champ d’irradiation, sauf si tumeur localisée relevant d'un traitement endoscopique. Le PET-Scan n'est pas utile lorsque des métastases ont été retrouvées par d'autres examens d'imagerie.
- Evaluation nutritionnelle.
Le diagnostic de dénutrition nécessite la présence d’au moins 1 critère phénotypique et 1 critère étiologique. Ce diagnostic est un préalable obligatoire avant de juger de sa sévérité. Il repose exclusivement sur des critères non biologiques.
Les critères phénotypiques sont les suivants :
- perte de poids ≥ 5 % en 1 mois ou ≥ 10 % en 6 mois ou ≥ 10 % par rapport au poids habituel avant le début de la maladie
- IMC <18,5 kg/m2
- réduction quantifiée de la masse et/ou de la fonction musculaires.
| Méthodes de mesure | Hommes | Femmes |
| Force de préhension (dynamomètre) en kg | <26 | <16 |
| Vitesse de marche (m/s) | <0,8 | <0,8 |
| Indice de surface musculaire en L3 en cm2/m2 (scanner, IRM) | 52,4 | 38,5 |
| Indice de masse musculaire en kg/m2 (impédancemétrie) | 7,0 | 5,7 |
| Indice de masse non grasse (impédancemétrie) en kg/m2 | <17 | <15 |
| Masse musculaire appendiculaire (DEXA) en kg/m2 | 7,23 | 5,67 |
Les critères étiologiques sont les suivants :
- réduction de la prise alimentaire ≥ 50 % pendant plus d’1 semaine ou toute réduction des apports pendant plus de 2 semaines par rapport :
- à la consommation alimentaire habituelle quantifiée
- ou aux besoins protéino-énergétiques estimés.
- absorption réduite (malabsorption/maldigestion)
- situation d’agression (hypercatabolisme protéique avec ou sans syndrome inflammatoire) :
- pathologie aiguë ou
- pathologie chronique évolutive ou
- pathologie maligne évolutive.
Haute Autorité de Santé (HAS). Recommandations pour la pratique clinique, 2019, p. 11-12.
- Examen ORL si facteurs de risques (tabac et/ou alcool)
- Si adénopathie cervicale : ponction éventuellement échoguidée
- Fibroscopie trachéobronchique si doute sur un envahissement de l'arbre respiratoire à l'imagerie
- IRM hépatique si examen scanographique douteux
- La laparoscopie est une option pour détecter une carcinose péritonéale, en particulier pour les tumeurs indifférenciées et opérables. Elle permet de mettre en place si nécessaire une jéjunostomie ± une chambre implantable.
1 - L'œsophage cervical
- Il commence au bord inférieur de l'hypopharynx, au bord inférieur du cartilage cricoïde, et finit à l'entrée dans le thorax (creux sus-sternal), approximativement à 18-19 cm des incisives supérieures.
2 - L'œsophage intra-thoracique
- Tiers supérieur : de l'orifice supérieur du thorax à la bifurcation trachéale, à 24 cm des incisives supérieures.
- Tiers moyen : sous la bifurcation trachéale, de 24 à 32 cm des incisives supérieures.
- Tiers inférieur : de 32 à 40 cm approximativement des incisives supérieures (incluant l'œsophage abdominal)
3 - La jonction œsogastrique
- Les tumeurs de la jonction œsogastrique sont considérées comme des cancers de l'œsophage si leur épicentre est dans les 2 cm au-dessus du cardia (Siewert I et II). Si leur épicentre est dans l'estomac à plus de 2 cm de la jonction œsogastrique ou si l'épicentre est gastrique à moins de 5 cm de la jonction œsogastrique mais sans extension œsophagienne, ils sont considérés comme des tumeurs de l'estomac.
- Elle est classée à l'aide d'un examen clinique, de l'imagerie, de l'endoscopie (incluant une bronchoscopie) et/ou de l'exploration chirurgicale.
T T0 Pas de signe de tumeur primitive Tis Carcinome in situ ou dysplasie de haut grade T1 Tumeur envahissant la lamina propria, la muscularis mucosae ou la sous-muqueuse T1a La tumeur envahit la lamina propria ou la muscularis mucosae (-4 % de N+) T1b La tumeur envahit la sous-muqueuse (de 30 à 60 % de N+) T2 Tumeur envahissant la musculeuse T3 Tumeur envahissant l'adventice T4 Tumeur envahissant les structures adjacentes T4a La tumeur envahit la plèvre, le péricarde, la veine azygos, le diaphragme ou le péritoine T4b La tumeur envahit d'autres structures adjacentes comme l'aorte, un corps vertébral ou la trachée.
- Les ganglions régionaux sont ceux du territoire de l'œsophage incluant les ganglions de l'axe cœliaque et les ganglions para-œsophagiens du cou mais pas les ganglions sus-claviculaires.
N Nx Le statut des ganglions régionaux ne peut être évalué N0 Pas de signe d'atteinte des ganglions lymphatiques régionaux N1 Métastases dans 1 à 2 ganglions lymphatiques régionaux N2 Métastases dans 3 à 6 ganglions lymphatiques régionaux N3 Métastases dans 7 ganglions régionaux ou plus pN0 L'examen histologique d'une pièce opératoire de lymphadénectomie incluera habituellement 6 ganglions lymphatiques ou plus.
Si les ganglions ne sont pas atteints, classer pN0 même si le nombre habituel de ganglions n'est pas atteint.
- Notes :
- Les ganglions sus-claviculaires sont toujours cotés M.
- L'examen sur une pièce opératoire d'au moins 7 ganglions est souhaitable.
| M | |
| Mx | Les métastases ne peuvent être évaluées |
| M0 | Pas de métastase à distance |
| M1 | Présence de métastase(s) à distance |
- Symbole c : le signe TNM ou cTNM correspond à la classification clinique pré-thérapeutique, résultat de l'examen clinique, de l'imagerie, de l'endoscopie, des biopsies et des autres examens complémentaires.
- Symbole y : dans tous les cas où la classification est effectuée durant ou après traitement néo-adjuvant, le cTNM ou le pTNM est précédé du préfixe y.
- Symbole p : le pTNM correspond à la classification histologique postopératoire, complétée ou modifiée par les observations supplémentaires recueillies au cours de l'acte chirurgical et de l'examen histopathologique.
- Type I : adénocarcinome de l'œsophage distal dont le centre de la tumeur est situé entre 1 cm et 5 cm au-dessus de la jonction œsogastrique.
- Type II : adénocarcinome à localisation cardiale moyenne dont le centre est situé entre 1 cm au-dessus (limite supérieure) et 2 cm au-dessous (limite inférieure) de la jonction œsogastrique. Cette entité correspond aux adénocarcinomes du cardia vrai.
- Type III : lésion du cardia à localisation gastrique prédominante dont le centre tumoral est situé entre 2 cm et 5 cm au-dessous de la jonction œsogastrique : il s'agit d'un cancer gastrique sous-cardial.
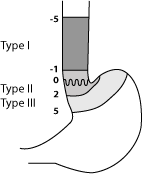
Classification des cancers du cardia selon Siewert :
- Le type est défini en fonction de la distance entre le centre de la tumeur et la ligne Z
- - 5 à - 1 cm : Siewert I (adénocarcinome sur endobrachyœsophage)
- - 1 à + 2 cm : Siewert II (vrai adénocarcinome du cardia)
- + 2 à + 5 cm : Siewert III (adénocarcinome gastrique sous-cardial).
- Les tumeurs de la jonction œsogastrique sont considérées comme des cancers de l'œsophage si leur épicentre est dans les 2 cm au-dessus du cardia (Siewert I et II). Si leur épicentre est dans l'estomac à plus de 2 cm de la jonction œsogastrique ou si l'épicentre est gastrique à moins de 5 cm de la jonction œsogastrique mais sans extension œsophagienne, ils sont considérés comme des tumeurs de l'estomac.
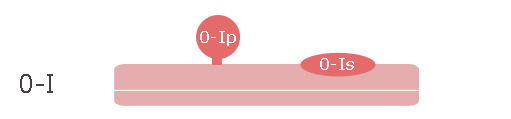
- 0.Ip : lésion en relief, pédiculée
- 0.Is : lésion en relief, sessile


- 0.IIa : lésion plane légèrement surélevée, la hauteur étant inférieure à la hauteur des cuillers d’une pince à biopsie fermée (2,5 mm)
- 0.IIb : lésion plane non surélevée, repérable par son caractère dyschromique

- 0.IIc : lésion plane légèrement déprimée

- 0.III : lésion creusante
- Cancer T1 muqueux :
- m1 (Tis) : intra-épithélial (= in situ)
- m2 (pT1a) : atteinte de la lamina propria
- m3 (pT1a) : atteinte de la musculaire muqueuse
- Cancer T1 sous-muqueux :
- sm1 (pT1b) : atteinte du premier tiers de la sous muqueuse, évalué à 500 µm pour l'adénocarcinome superficiel sur endobrachyœsophage (EBO)
- sm2 (pT1b) : atteinte du 2ème tiers de la sous muqueuse
- sm3 (pT1b) : atteinte du 3ème tiers de la sous muqueuse
- u (ou us) T1 : tumeur limitée à la muqueuse (3ème et 5ème couche hyperéchogène intacte)
- uT2 : tumeur atteignant la musculeuse sans la dépasser (5ème couche hyperéchogène intacte)
- uT3 : tumeur dépassant la séreuse (5ème couche hyperéchogène franchie)
- uT4 : envahissement d'un organe de voisinage
- uN0 : pas d'adénopathie d'allure néoplasique
- uN+ : adénopathie d'allure néoplasique (ronde, hypoéchogène, contours nets).
- Elle est établie sur pièce opératoire.
Les catégories pT, pN et pM correspondent aux catégories T, N et M. - pN0 : (sur N exploré) l'examen histologique d'une lymphadénectomie régionale doit inclure au moins 15 ganglions lymphatiques. Classer pN0 si les ganglions ne sont pas envahis, même si le nombre de 15 ganglions n'est pas atteint.
- Symbole y : dans tous les cas où la classification est effectuée durant ou après traitement néo-adjuvant, le cTNM ou le pTNM est précédé du préfixe y.
- Symbole c : le signe TNM ou cTNM correspond à la classification clinique pré-thérapeutique, résultat de l'imagerie, de l'endoscopie, des biopsies, de l'exploration chirurgicale et des autres examens complémentaires.
- Symbole p : le pTNM correspond à la classification histologique postopératoire, complétée ou modifiée par les observations supplémentaires recueillies au cours de l'acte chirurgical et de l'examen histopathologique.
| 0 | Capable d'une activité identique à celle précédant la maladie, sans aucune restriction |
| 1 | Activité physique diminuée mais ambulatoire et capable de mener un travail |
| 2 | Ambulatoire et capable de prendre soin de soi, incapable de travailler. Alité <50 % de son temps. |
| 3 | Capable de seulement quelques soins personnels. Alité ou chaise >50 % de son temps. |
| 4 | Incapable de prendre soin de lui-même, alité ou chaise en permanence |
- Cf. le compte-rendu type.
(avant toute décision thérapeutique)
- Données socio-démographiques
- État général OMS
- Poids habituel et perte de poids, état nutritionnel
- Antécédents majeurs, en particulier cardiaques et artériels
- Endoscopie œsophagienne et biopsies
- Classification de Prague (C et M)
- Classification de Paris si lésion superficielle
- Localisation précise de la tumeur (classification de Siewert)
- Scanner cervico-thoraco-abdominal avec imagerie disponible (PACS)
- Stade déterminé par une échoendoscopie si petites tumeurs et N0 M0 sur l'imagerie
- Compte-rendu anatomo-pathologique (biopsie ou pièce opératoire)
- Compte-rendu opératoire (si malade déjà opéré)
- Statut HER2 systématique si maladie métastatique ou récidive
- Statuts MSI et HER2 en vue d'inclusion dans un essai.
Trois situations de prise en charge sont disponibles :
- C'est-à-dire Tis ou T1a du TNM
- Rappel : une dysplasie de haut grade est un carcinome in situ.
- Discussion en RCP avec les résultats de l'échoendoscopie et des biopsies multiples
Patient a priori opérable
Intervention envisageable ?
Chirurgie non envisagée si :
- chirurgie R0 impossible
- métastases ganglionnaires cervicales
- ou métastases viscérales
- ou comorbidités
Bilan d'opérabilité :
Standard
Avis anesthésique
Avis chirurgical
Avis pour chimiothérapie (sauf T1N0)
(lésion <3 cm, bien différenciée)
- Bilan d'oncogériatrie
- Avis anesthésique
- Avis chirurgical
- Chimiothérapie néo-adjuvante protocole FLOT 4 cures
- Radiochimiothérapie préopératoire
- Traitement symptomatique
en cas de comorbidité majeure
- Radiothérapie exclusive
(si contre-indication à la chimiothérapie)
- Etat général satisfaisant : OMS 0-2
- Pas de contre-indication à la chimiothérapie
- Si surexpression HER2 : 5-Fluorouracile-cisplatine-trastuzumab en 1ère ligne, FOLFOX-trastuzumab également possible, à valider en RCP
- Si absence de surexpression HER2 : toujours discuter l’inclusion dans une étude clinique, sinon FOLFOX ou mDCF en 1ère ligne ; taxanes, irinotécan/FOLFIRI en 2ème ligne
- Place de l’immunothérapie à venir prochainement (Keynote-590 avec le pembrolizumab ; Checkmate 649 avec le nivolumab).
- Radiochimiothérapie si tumeur en place
- Soins de support
- Essai thérapeutique.
- Le traitement endoscopique est le traitement de référence en cas de carcinome in situ (Tis de la classification TNM ou T1m1) ou microinvasif (T1m2 ou T1m3). Il doit permettre l'exérèse de toutes les lésions visibles. En l'absence de lésion visible, un traitement d'éradication par radiofréquence devra être proposé.
- Le traitement endoscopique, pour être efficace et éviter les récidives locales, doit être effectué de préférence de manière complète en monobloc. Pour les lésions de plus de 2 cm ou bombantes, la technique de dissection sous-muqueuse (ESD) sera à privilégier dans un centre expert. Les meilleures indications sont les cancers intramuqueux (T1a) et à morphologie favorable (0-I et 0-II) dans la classification de Paris.
- Les critères de succès de la résection sont définis par des marges de résection profondes saines, la limitation de la lésion au niveau de la muqueuse (pT1a). Si l'examen de la pièce révèle une atteinte au-delà de la sous-muqueuse (pT1b) de moins de 500 µm (sm1), avec une exérèse curative (lésion bien différenciée, résection complète, monobloc avec des marges latérales et profondes saines et sans embole veineux et lymphatique), le traitement endoscopique peut être suffisant.
- En cas de résection endoscopique de la lésion tumorale, le traitement de la muqueuse de Barrett résiduelle doit être envisagé car le risque de lésion métachrone est estimé à 20 % à 2 ans. La radiofréquence est le traitement de référence dans cette situation.
- Cette référence a été élaborée en intégrant la recommandation produite par la Société Française de Chirurgie Digestive (SFCD) et l'Association de Chirurgie Hépatobiliaire et de Transplantation Hépatique (ACHBT) intitulée "Cancérologie digestive : pratiques chirurgicales". Elle a reçu le label INCa-HAS en février 2009. Le texte argumenté des recommandations (version longue) est disponible sur le site de l'INCa ainsi qu'une version synthétique.
- Seule une chirurgie à visée curative est envisageable (R0). Une chirurgie palliative n'a pas sa place sauf situation d'urgence (les résidus tumoraux seront alors clippés lors de l'intervention).
- Evaluation nutritionnelle
- Exploration fonctionnelle respiratoire
- Score ASA
- Bilan hépatique
- Morpho-TEP
- Score G8 permettant de sélectionner les patients âgés nécessitant une évaluation oncogériatrique (G8 ≤ 14).
- Contre-indications relatives :
- Perte de poids >15 %, non récupérée après renutrition
- Cirrhose non décompensée
- Insuffisance rénale chronique
- Artériopathie obstuctive des membres inférieurs stade III.
- Contre-indications absolues :
- Insuffisance respiratoire sévère (VEMS <1 L)
- Cirrhose décompensée (ascite, ictère, insuffisance hépato-cellulaire, encéphalopathie) ou avec présence de varices œsophagiennes
- Infarctus du myocarde datant de moins de 6 mois ou cardiopathie évolutive
- Etat général (OMS >2)
- Perte de poids >20 %, non récupérée après renutrition.
- Tumeur T4 envahissant les structures médiastinales suivantes : arbre trachéobronchique, récurrent, aorte sur plus de 90 % de sa circonférence, corps vertébral. Les atteintes isolées de la plèvre ou du péricarde (T4) ne sont pas des contre-indications opératoires (Mariette, 2006).
- Tumeur sus-carinaire de plus de 4 cm de diamètre (Mariette, 2004). Les tumeurs de plus de 4 cm du tiers inférieur peuvent souvent être réséquées en étendant la résection aux organes de voisinage (pT4a).
- Métastases viscérales.
- Les adénopathies à distance ne sont pas des contre-indications opératoires si elles peuvent être réséquées lors d'un curage ganglionnaire complémentaire (sauf les adénopathies sus-claviculaires et lombo-aortiques qui sont des métastases).
(Mariette, 2015 ; 2002 ; 2003 ; Barbour, 2007 ; Omloo, 2007 ; Sasako, 2006)
- Sevrage alcool/tabac.
- Kinésithérapie respiratoire préopératoire.
- Renutrition préopératoire, au mieux, par voie entérale.
- Immunonutrition recommandée.
- Préhabilitation chirurgicale.
- Œsogastrectomie polaire supérieure avec plastie gastrique et lymphadénectomie cœliaque et médiastinale par double voie abdominale et thoracique droite (intervention de Lewis-Santy) (il n'y a pas de place pour la voie de gauche (Sweet)) et comportant l'exérèse monobloc :
- du canal thoracique
- des ganglions médiastinaux moyens avec curage inter-trachéo-bronchique
- des ganglions médiastinaux inférieurs et cœliaques.
- Marge œsophagienne supérieure d'au moins 8 cm (incluant en outre la totalité de l'endobrachyœsophage) ou 5 cm si pas d’endobrachyœsophage. Marge inférieure d'au moins 5 cm. Un examen extemporané de la recoupe supérieure est une option à la recherche d'une résurgence tumorale sous-muqueuse et fortement conseillé en cas de doute.
- L'abord cœlioscopique pour la gastrolyse (suivi de la résection œsophagienne par thoracotomie) réduit la morbidité pulmonaire de moitié mais sans impact sur le nombre de décès postopératoire (étude MIRO).
- La chirurgie robot-assistée pour la voie abdominale et/ou thoracique est une option dans des équipes entrainées.
Des études ont démontré une diminution de la morbi-mortalité postopératoires et une amélioration des résultats oncologiques lorsqu’elle était réalisée en centre expert (Wouters, 2009 ; Mariette, 2016 ; Chang, 2018 ; Speicher, 2018).
Le délai entre la chirurgie et le traitement néo-adjuvant doit être de 8 semaines après radiochimiothérapie et 4 à 6 semaines après chimiothérapie.
(Stein, 2007 ; Mariette, 2007)
- dysplasie de haut grade (et si chirurgie indiquée), pTis ou pT1N0 : lambeau pédiculé de grêle ?
- adénocarcinome avec linite gastrique : œsogastrectomie totale avec anse en Y selon Roux anastomosée sous la crosse de l'azygos.
(Hulscher, 2002 ; Sauvanet, 2005)
- Œsogastrectomie totale (pour une tumeur envahissant le cardia avec extension gastrique) avec coloplastie ou anse en Y anastomosée à hauteur de la crosse de l'azygos.
- Œsophagectomie subtotale avec plastie colique.
- Œsophagectomie à thorax fermé (transhiatale) si la thoracotomie est contre-indiquée.
- Un adénocarcinome du cardia jugé non résécable est traité par chimiothérapie ou par radiochimiothérapie. Un contrôle de la maladie peut être obtenu par ces 2 traitements de façon durable.
- En cas de nouvelle progression ou d’absence de réponse complète après radiochimiothérapie, il peut se discuter une chirurgie de rattrapage si celle-ci est à but curatif. Il n'y a pas de place pour une chirurgie palliative laissant en place des résidus macroscopiques. Cette chirurgie est risquée car la tumeur a reçu une dose de radiothérapie plus importante que pour un traitement préopératoire (50,4 Gy versus 41,4 Gy et toujours <55 Gy). Les tissus sont très remaniés.
- En cas de chimiothérapie première et de nouvelle progression, toutes les options sont possibles : reprise de chimiothérapie, radiochimiothérapie, et chirurgie de rattrapage précédée ou non d'un traitement néo-adjuvant.
- Nécessité d'un état général conservé : patient ambulatoire, OMS 0-2.
- Nutrition entérale si amaigrissement >15 %.
- Mise en état dentaire.
- Évaluation nutritionnelle pour la chimiothérapie postopératoire.
- Clairance de la créatinine et créatininémie.
- Hémogramme avec plaquettes.
- Recherche d'un déficit en enzyme DPD par la mesure de l'uracilémie pour les chimiothérapies à base de fluoropyrimidines.
- Évaluation après 2 mois de traitement (scanner thoraco-abdominal avec injection avant et après chimiothérapie), transmettre les scanners à l'équipe chirurgicale si chimiothérapie préopératoire.
- Pour le détail des chimiothérapies, voir aussi le thésaurus.
postopératoire
- Abstention
- Chimiothérapie palliative
- Radiothérapie
- Radiochimiothérapie
- Si chirurgie R0 et pas de résidu tumoral, pas de traitement complémentaire.
- Traitement adjuvant par nivolumab en cas de résidu tumoral sur la pièce opératoire après radiochimiothérapie.
- Si maladie résiduelle après une radiochimiothérapie néo-adjuvante antérieure et une résection complète (R0 post-chirurgie), immunothérapie adjuvante par nivolumab dans les 4 à 16 semaines, pendant un an au plus.
(Lazarescu, 2013 ; Minsky, 2002)
- 60 à 64 Gy (traitement exclusif seulement si chimiothérapie contre-indiquée) et 45 à 50 Gy avec chimiothérapie concomittante.
- Rx de plus de 10 MV, dosimétrie sur scanner, étalement et fractionnement classiques : 1,8 à 2 Gy/fraction, 5 fractions/semaine.
- Dose maximale à la moelle 45 Gy.
- Simulation virtuelle avec histogrammes dose-volume.
- Recommandation (tiers inférieur de l'œsophage) : patient 3 heures à jeun avant le scanner dosimétrique et les séances de radiothérapie.
- Au moins 3 faisceaux.
- TEP-TDM au 18F-FDG pour préciser l'extension locale et ganglionnaire ainsi que les volumes cibles de la radiothérapie.
- Volume cible anatomo-clinique : tumeur avec marges de 3 à 5 cm de part et d'autre en hauteur et 1 à 2 cm latéralement et en antéropostérieur ; réduction du volume cible après 45 à 50 Gy ; marges adaptées avec l'aide du TEP-TDM.
- Nutrition 1 500 Kcal/jour par voie entérale (pose préalable d'une GEP ou d'une sonde nasogastrique si difficultés alimentaires).
- Radiothérapie Conformationnelle en Modulation d'Intensité (RCMI).
- Scanner 4D (en particulier pour les tiers inférieurs de l'œsophage).
- Prend en compte la situation tumorale et le risque ganglionnaire (Cf. schémas).
Siewert I
- CTV1 : tumeur macroscopique + ganglion à risque : groupes 10R, 10L, 8M, 8L, 9D, 15, 16, 17, 20.
- CTV2 : tumeur macroscopique + marge de 2 cm dans l'axe crânio-caudal et de 1 cm dans le sens transversal.
Siewert II
- CTV1 : tumeur macroscopique + ganglions à risque 10R, 10 L, 8M, 8L, 15, 16, 17, 18, 19, 20.
- CTV2 : tumeur macroscopique + marge de 2 cm dans l'axe crânio-caudal et de 1 cm dans le sens transversal.
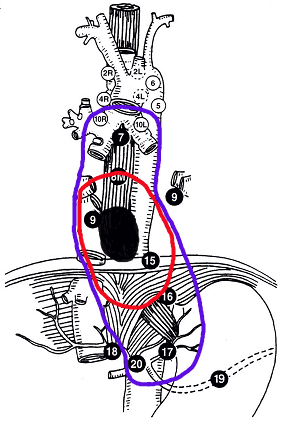
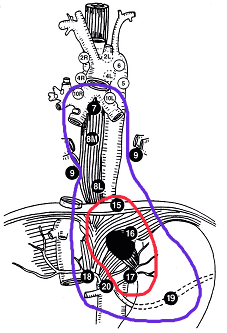
Vue antérieure des sites ganglionnaires de drainage des cancers de l'œsophage
(Schémas adaptés de Casson AG et Bosset JF)
- a) Tumeur de type Siewert I
- CTV1 : contourage violet
- CTV2 : contourage rouge
- b) Tumeur de type Siewert II
- CTV1 : contourage violet
- CTV2 : contourage rouge
(Van Hagen, 2012 ; Van Heijl, 2008)
- 41,4 Gy en 23 fractions (5 fractions/semaine) chaque semaine pendant 5 semaines :
- paclitaxel 50 mg/m² avec prémédication
- carboplatine AUC 2.
- Adaptation de doses :
- selon hémogramme au jour du traitement : si leucocytes <1 000/mm3 ou plaquettes <50 000/mm3, report d'une semaine jusqu'à récupération
- si neutropénie fébrile ou hémorragie sévère ou transfusion plaquettaire, arrêt de la chimiothérapie
- mucite ou vomissements : report d'une semaine.
- Suivie d'une immunothérapie adjuvante par nivolumab en cas de résection R0 et de résidu tumoral sur la pièce opératoire.
- Support nutritionnel >1 500 calories/jour
- 50,4 Gy ; 1,8 Gy/fraction ; 5 fractions/semaine
- 1 seul CTV
- CTV1 36 à 40 Gy ; 1,8 Gy/fraction ; 5 fractions/semaine
- CTV2 50,4 Gy ; 1,8 Gy/fraction ; 5 fractions/semaine
- ECG préalable et évaluation du risque cardiovasculaire
- 5-Fluorouracile en perfusion continue + cisplatine ou oxaliplatine (Cf. protocole correspondant)
- Hémogramme, créatinine avant chaque cure.
- La recherche systématique de métastases à distance n'a pas d'intérêt démontré.
- Surveillance clinique : poids, examen clinique, dysphagie tous les 6 mois pendant 5 ans.
- Sevrage tabagique.
- Autres examens complémentaires seulement si signes d'appel ou facteurs de risque.
- Surveillance d'un endobrachyœsophage résiduel (le cas échéant).
- En cas de radiochimiothérapie exclusive à visée curative avec réponse complète : examen clinique tous les 4 mois avec fibroscopie et scanner thoraco-abdominal pendant 1 an, puis même surveillance tous les 6 mois l’année suivante. Après 24 mois, on revient aux modalités de surveillance habituelles.
- En première intention :
- FLOT
- En seconde intention :
- DCF
- Ou, à défaut FOLFOX
- 4 cycles préopératoires et 4 cycles postopératoires toutes les 2 semaines
|
Docétaxel : 50 mg/m² IV dans 250 mL NaCl 0,9 % en 1 heure à J1 (précédé et suivi d'une prémédication[1]) Acide folinique 200 mg/m2 IV dans 250 mL NaCl 0,9 % en 30 min à J1 Reprise à J15 |
↑ Prémédication : par exemple prednisolone orodispersible 20 mg : 50 mg matin et soir pendant 3 jours à débuter la veille du traitement (J0), et à J1 et J2.
- Les facteurs de croissance ont été recommandés en prophylaxie secondaire chez les patients présentant une neutropénie fébrile ou des interruptions de traitement en raison de la neutropénie ou de la leucopénie (risque de 5 % sur 128 patients inclus dans la phase II randomisée).
- Adaptation de doses :
- Neutropénie fébrile ou thrombopénie avec saignements : réduire de 25 % les doses de docétaxel et d'oxaliplatine après prescription de G-CSF. Réduire les doses de 50 % si récidive.
- Toxicité > grade 2 (diarrhée ou mucite en particulier) : réduire de 25 % les doses pour et de 50 % si les toxicités ont lieu après une première réduction de dose.
- Toxicité neurologique : en cas de paresthésies ou de dysesthésies persistantes entre les cycles, réduire de 25 % l'oxaliplatine. En cas de paresthésies ou de dysesthésies accompagnées de douleurs ou d'une insuffisance fonctionnelle, réduire de 50 % l'oxaliplatine (si durée entre 7 et 14 jours) ou est supprimé dans d'autres cycles jusqu'à récupération (si toxicité persistante entre les cycles).
Référence :
- Al-Batran SE, Homann N, Pauligk C et al.
Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial.
Lancet. 2019 Apr 10. pii: S0140-6736(18)32557-1.
| Docétaxel : 75 mg/m² IV en 1 heure à J1 (précédé et suivi d'une prémédication[1]) Cisplatine : 75 mg/m² IV J1 en 1 à 3 heures (avec hyperhydratation) 5-Fluorouracile : 750 mg/m²/j IV en perfusion continue de J1 à J5 Reprise à J22
|
- ↑ Prémédication : par exemple SOLUPRED® orodispersible 20 mg : 50 mg matin et soir pendant 3 jours à débuter la veille du traitement (J0), et à J1 et J2.
Prophylaxie par G-CSF hautement souhaitable (risque de neutropénie fébrile >20 %).
Surveillance étroite de l'hémogramme conseillée.
Il faut 1 500 PNN/mm³ et 100 000 plaquettes/mm³ pour reprendre la cure.
Référence
- Van Cutsem E, Moiseyenko VM, Tjulandin S et al.
Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer : a report of the V325 Study Group.
J Clin Oncol. 2006; 24: 4991-7
| Irinotécan : 180 mg/m² à J1 en 90 min, Acide folinique 400 mg/m², J1 en 2h en perfusion en Y (pendant la perfusion d'irinotécan) 5-Fluorouracile : en bolus de 400 mg/m² à J1 juste après l'acide folinique, suivi de 5-Fluorouracile en continu à 2,4 mg/m² au total sur 46 heures, soit 1,2 g/m² à J1 et J2 Reprise à J15
|
Référence
- Bouché O, Raoul JL, Bonnetain F et al.
Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (LV5FU2), LV5FU2 plus cisplatin, or LV5FU2 plus irinotecan in patients with previously untreated metastatic gastric cancer : a Federation Francophone de Cancerologie Digestive Group Study--FFCD 9803.
J Clin Oncol 2004;22:4319-28.
| Irinotécan : 80 mg/m² sur 30 min suivi par acide folinique 500 mg/m² sur 2 heures puis 5-Fluorouracile : 2 000 mg/m² sur 22 heures. Schéma hebdomadaire J1=J8, 6 semaines, puis une semaine de repos |
Référence
- Dank M, Zaluski J, Barone C et al.
Randomized phase III study comparing irinotecan combined with 5-fluorouracil and folinic acid to cisplatin combined with 5-fluorouracil in chemotherapy naive patients with advanced adenocarcinoma of the stomach or esophagogastric junction.
Ann Oncol. 2008; 19: 1450-7
- Indications : adénocarcinomes métastatiques de l'estomac ou de la jonction œsogastrique avec surexpression de HER 2 (IHC3+ ou IHC2+ et FISH+) non prétraités (1ère ligne).
- Durée d'une cure : 5 jours ; intervalle entre 2 cures : 3 semaines (J1=J22)
| J1 Trastuzumab : 8 mg/kg (J1C1, dose de charge) puis 6 mg/kg (J1C2 et suivantes) en perfusion IV de 90 min (dose de charge), de 30 min (administrations ultérieures), contemporaine de la préhydratation Cisplatine : 80 mg/m² en en perfusion IV de 60 min, précédée et suivie d'une hyperhydratation J1 à J5 5-Fluorouracile : 800 mg/m²/j en perfusion IV continue (infuseur ou pompe) J6 à J21 inclus Pas de traitement. |
| Oxaliplatine 85 mg/m² en 2 h à J1 Acide folinique 200 mg/m² (ou Acide L-folinique 100 mg/m²) en 2 h en perfusion en Y puis 5-Fluorouracile bolus 400 mg/m² puis 5-Fluorouracile 600 mg/m² en perfusion continue de 22 h à J1 et J2 Reprise à J15 12 cures en adjuvant |
Traitement associé
- Afin de limiter la neurotoxicité, il est recommandé d'injecter une perfusion de gluconate de calcium 1 g et de sulfate de magnésium 1 g en 15 minutes avant et après la perfusion d'oxaliplatine.
Adaptation de doses
- Selon toxicité dans l'intercure
- Toxicité neurologique
- FOLFOX 4 : échelle spécifique de neurotoxicité
Grade 1 : dysesthésies/paresthésies de courte durée avec régression complète avant le cycle suivant
Grade 2 : dysesthésies/paresthésies persistant entre 2 cycles, sans gêne fonctionnelle
Grade 3 : gêne fonctionnelle - Grade 2 : réduire oxaliplatine à 75 mg/m²
Grade 3 ou paresthésies douloureuses : arrêter l'oxaliplatine
- FOLFOX 4 : échelle spécifique de neurotoxicité
- Autres toxicités de grade 3 ou 4 (par exemple neutropénie ou thrombopénie ou diarrhée ou mucite) :
Réduire l'oxaliplatine à 75 mg/m²
Réduire le 5-Fluorouracile bolus à 300 mg/m²
Réduire le 5-Fluorouracile continu/22 h à 500 mg/m² - Toxicité cutanée de grade 3-4 : réduire seulement le 5-Fluorouracile
- Toxicité cardiaque, cérébelleuse ou allergie de grade 3-4 : arrêt de la chimiothérapie.
- Toxicité neurologique
- Le jour de la reprise du cycle J1
- Il faut 1 500 PNN/mm et 100 000 plaquettes/mm pour reprendre le cycle.
Référence
- André T, Boni C, Mounedji-Boudiaf L et al.
Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer.
N Engl J Med 2004; 350 : 2343-51.
- 41,4 Gy en 23 fractions (5 fractions/semaine) avec chaque semaine pendant 5 semaines :
- Paclitaxel 50 mg/m² avec prémédication
- Carboplatine AUC 2
- Adaptation de doses :
- selon hémogramme au jour du traitement : si leucocytes <1 000/mm3 ou plaquettes <50 000/mm3, report d'une semaine jusqu'à récupération
- si neutropénie fébrile ou hémorragie sévère ou transfusion plaquettaire, arrêt de la chimiothérapie
- mucite ou vomissements : report d'une semaine
Référence
- Van Hagen P, Hulshof MC, van Lanschot JJ et al.
Preoperative chemoradiotherapy for esophageal or junctional cancer.
N Engl J Med. 2012; 366:2074-84.
|
Nivolumab 240 mg en 30 minutes toutes les 2 semaines pendant 16 semaines (8 doses),
Puis 480 mg en 30 minutes toutes les 4 semaines à partir de la semaine 17 pendant un an au total.
|
- Arrêt si récidive tumorale ou toxicité inacceptable.
- En cas de toxicité : pas d'adaptation de dose mais interruption ou report du traitement jusqu'à un maximum de 6 semaines.
Kelly RJ, Ajani JA, Kuzdzal J, et al.
Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer.
N Engl J Med. 2021;384(13):1191-1203.
- Radiochimiothérapie avec FOLFOX modifié
- radiothérapie 50,4 Gy + 6 cures de FOLFOX modifié à 14 jours d'intervalle (3 cures pendant la radiothérapie débutant à J1 et 3 cures après la radiothérapie)
- FOLFOX modifié :
| Oxaliplatine 85 mg/m² à J1 Acide folinique 200 mg/m² à J1 5-FU en bolus 400 mg/m2 à J1 5-FU continu 800 mg/m2/jour à J1 et J2 |
Référence
- Conroy T, Galais MP, Raoul JL et al.
Definitive chemoradiotherapy with FOLFOX versus fluorouracil/cisplatin in patients with oesophageal cancer: final results of a randomised, phase 2/3 intergroup trial (PRODIGE 5/ACCORD 17)
Lancet Oncol. 2014;15:305-14.
- Radiochimiothérapie avec 5-Fluorouracile et cisplatine
(Protocole du RTOG dit Herskovic, avec radiothérapie 50,4 Gy)
| 5-Fluorouracile 1 000 mg/m² en perfusion continue de 96 h de J1 à J4 Cisplatine 75 mg/m² à J1 (avec hyperhydratation et antiémétiques) en 1 à 2 heures (ou 1 mg/mn) Reprise à J29 ou à J22
|
- Schéma original d'Herskovic : chimiothérapie semaines 1, 5, 8 et 11
| Semaines | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Rayons | x | x | x | x | x | ||||||
| Chimiothérapie | x | x | x | x |
- Herskovic A, Martz K, al-Sarraf M et al.
Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus.
N Engl J Med 1992 ;326:1593-8.
- Variante de Minsky : essai INT 123 (même efficacité et moins de reports de traitement) : la chimiothérapie est effectuée au cours des semaines 1, 5, 9 et 12.
Référence
- Minsky BD, Pajak TF, Ginsberg RJ et al.
INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy.
J Clin Oncol 2002 ;20:1167-74.
ADAPTATIONS DE DOSES (selon publication de Minsky)
- Toxicité de grade 3-4 dans l'intercure
- Report d'une semaine
- Reprise lorsque la toxicité a diminué à un grade 2 ou moins.
- Modifications selon toxicité hématologique à la reprise de la cure
- Leucocytes >3 000/mm³ et plaquettes >75 000/mm³ : pleines doses
- Leucocytes entre 2 000/mm³ et 3 000/mm³ ou plaquettes entre 75 000/mm³ et 100 000/mm³ : demi dose de 5-Fluorouracile et de cisplatine (poursuite de la radiothérapie à l'identique)
- Leucocytes <2 000/mm³ ou plaquettes <75 000/mm³ : interruption de la chimiothérapie et de la radiothérapie.
- Toxicité hématologique dans l'intercure
- Si leucocytes <1 000/mm³ ou plaquettes <75 000/mm³ au nadir, réduction de dose de 25 % pour le 5-Fluorouracile et le cisplatine.
- Toxicité rénale
- Si clearance à la créatinine entre 55 et 65 mL/min ou créatininémie entre 16 mg/L (141 μmol/L) et 20 mg/L (177 μmol/L) : réduction de dose de 50 % du Cisplatine
- Si clearance à la créatinine <50 mL/min : arrêt du Cisplatine et du 5-Fluorouracile jusqu'à amélioration de la fonction rénale.
- Mucite sévère
- Réduction de 25 % du 5-Fluorouracile pour le cycle suivant
- Interruption du 5-Fluorouracile pour le cycle, s'il est en cours.
Voir la référence Estomac.
(Hébergement des Essais Cliniques et Thérapeutiques en Oncologie Régional) :

-
ASPEN-06 : étude de phase 2-3, évaluant l'évorpacept (ALX148), chez des patients ayant un adénocarcinome avancé gastrique ou de la jonction gastro-œsophagienne surexprimant HER2
- Statut : Ouvert (12-08-2021 - 31-08-2028)
- Promoteur : ALX Oncology Inc.
-
BGB-A317-305 : Etude de phase III visant à comparer l’efficacité et la sécurité d’emploi du Tislelizumab (BGB-A317) associé au platine et à la fluoropyrimidine en tant que traitement de 1ere ligne chez des patients atteints d’un adénocarcinome de l’estomac ou de la jonction gastro-œsophagienne métastatique ou localement avancé non résécable
- Status : Ouvert (06-01-2020 - 31-08-2022)
- Promoteur : BeiGene
-
BP29842 : Etude de phase Ia/Ib visant à évaluer la sécurité, la pharmacocinétique et l’activité thérapeutique du RO6874281, une immunocytokine, variante de l’interleukine-2 (IL-2V) ciblant la protéine d’activation des fibroblastes-α (FAP), administré en monothérapie (partie A) ou en association avec le trastuzumab ou le cétuximab (partie B ou C).
- Statut : Ouvert (29-01-2018 - 30-06-2021)
- Promoteur : Hoffmann-La Roche
-
DESTINY-Gastric04 : étude de phase 3, randomisée, évaluant le trastuzumab déruxtécan, chez des patients ayant un adénocarcinome de l’estomac ou de la jonction gastro-oesophagienne (JGO) métastatique et/ou non résécable, HER2 positif et ayant progressé pendant ou après un schéma thérapeutique contenant du trastuzumab
- Statut : Ouvert (21-05-2021 - 15-11-2024)
- Promoteur : Daiichi Sankyo, Inc.
-
EORTC-22114 TOP GEAR : Essai de thérapie préopératoire pour l'adénocarcinome gastrique et de la jonction œsogastrique. Un essai randomisé de phase II/III entre la chimioradiothérapie préopératoire et la chimiothérapie préopératoire pour le cancer gastrique résécable.
- Statut : Ouvert (01-09-2009 - 31-12-2026)
- Promoteur : EORTC
-
EPIC : Etude de phase III, randomisée, multicentrique, évaluant l’impact sur la survie globale d’une prise en charge palliative précoce chez des patients ayant un cancer métastatique du haut appareil digestif traité par une chimiothérapie de première ligne.
- Statut : Ouvert (10-10-2016 - 31-10-2022)
- Promoteur : Centre Oscar Lambret Centre de Lutte Contre le Cancer (CLCC) de Lille
-
ESOSTRATE - PRODIGE 32 : étude randomisée de phase 2-3 évaluant la chirurgie systématique par rapport à une surveillance simple pouvant être associée à une chirurgie de recours, chez des patients ayant un cancer de œsophage opérable en réponse clinique complète après une radio-chimiothérapie.
- Status : Ouvert (01-08-2015 - 30-03-2023)
- Promoteur : CHU Dijon
-
EXOMA : Etude exploratoire visant à évaluer l’impact d’une analyse du profil génétique par la technique « Next Generation sequencing » (NGS) à haut débit sur la décision thérapeutique chez des patients ayant une tumeur solide
- Statut : Ouvert (12-05-2016 - 26-06-2021)
- Promoteur : Centre Georges François Leclerc
-
FREGAT : Constitution d'une base de données clinico-biologique nationale française des cancers oeso-gastriques
- Status : Ouvert (01-06-2014 - 01-05-2027)
- Promoteur : CHU LILLE
-
GASTFOX-PRODIGE 51 : Essai de phase III randomisé évaluant le FOLFOX avec ou sans docetaxel (TFOX) en 1ere ligne de chimiothérapie des adénoarcinomes oeso-gastriques localement avancés ou métastatiques
- Status : Ouvert (22-05-2018 - 31-08-2022)
- Promoteur : FFCD
-
HERIZON-GEA-01 : étude de phase 3, randomisée, évaluant le zanidatamab en association avec une chimiothérapie avec ou sans tislelizumab, chez des patients ayant un adénocarcinome gastro-œsophagien localement avancé ou métastatique HER2-positif non résécable
- Statut : Ouvert (02-12-2021 - 31-07-2025)
- Promoteur : Zymeworks Inc.
-
KEYNOTE-585 : Étude de phase 3 randomisée comparant l’efficacité du pembrolizumab associé à une chimiothérapie (XP ou FP) avec celle d’un placebo associé à une chimiothérapie (XP ou FP) en traitement néoadjuvant et adjuvant chez des patients ayant un adénocarcinome de l’estomac ou un adénocarcinome de la jonction gastrooesophagienne.
- Status : Ouvert (09-10-2017 - 26-07-2023)
- Promoteur : BRISTOL MYERS SQUIBB
-
KEYNOTE-811 / MK 3475-811 : Etude de phase III randomisée comparant l’efficacité du pembrolizumab associé au trastuzumab et à une chimiothérapie par rapport au placébo associé au trastuzumab et à une chimiothérapie en première ligne de traitement chez des patients ayant un adénocarcinome de l’estomac ou de la jonction gastro-oesophagienne métastatique HER2 positif
- Status : Ouvert (05-10-2018 - 01-06-2023)
- Promoteur : Merck Sharp & Dohme
-
KEYNOTE 975 / MK3475-975 : Etude de phase III évaluant l'efficacité et l'innocuité du pembrolizumab (MK-3475) par rapport au placebo chez les patients atteints de cancer de l’œsophage recevant une chimiothérapie définitive
- Statut : Ouvert (11-03-2020 - 21-02-2026)
- Promoteur : Merck Sharp & Dohme
-
KUNLUN : Etude internationale de phase III, randomisée, à double insu, contrôlée par placebo, multicentrique, sur le durvalumab administré en même temps qu'une radiochimiothérapie définitive chez des patients atteints d'un carcinome épidermoïde oesophagien non résécable localement avancé
- Statut : Ouvert (19-10-2020 - 30-11-2026)
- Promoteur : AstraZeneca
-
MATTERHORN : Évaluation du durvalumab et de la chimiothérapie FLOT dans le cancer de la jonction gastrique et gastro-œsophagienne résécable
- Statut : Ouvert (17-11-2020 - 14-02-2025)
- Promoteur : AstraZeneca
-
METIMGAST : Association Capmatinib + Spartalizumab dans l'Adénocarcinome Oesogastrique Avancé
- Statut : Ouvert (22-03-2022 - 31-10-2025)
- Promoteur : Assistance Publique - Hôpitaux de Paris
-
MIME : Évaluation de la réponse d’imagerie métabolique multiorgane d’Abemaciclib
- Status : Ouvert (19-12-2018 - 15-10-2021)
- Promoteur : Institute Jules Bordet
-
MK-7902-014-01 / LEAP 14 : Etude randomisée de phase III évaluant l’efficacité et la sécurité du Pembrolizumab (MK-3475) plus Lenvatinib (E7080/MK-7902) plus chimiothérapie en comparaison avec le traitement standard comme traitement de première intention chez des participants atteints de carcinome métastatique de l'oesophage.
- Statut : Ouvert (30-12-2020 - 31-12-2024)
- Promoteur : MSD
-
ORIENT : Étude de phase III, multicentrique, randomisée, en double aveugle, visant à évaluer l’efficacité et la sécurité du sintilimab versus placebo, associé à une chimiothérapie, dans le traitement de première ligne du carcinome épidermoïde de l’œsophage métastatique, récidivant ou localement avancé non résécable (ORIENT-15)
- Statut : Ouvert (01-10-2018 - 30-06-2025)
- Promoteur : Innovent Biologics (Suzhou) Co., Ltd.
- OSAGE : Etude multicentrique de phase I/II de radiochimiothérapie (carboplatine, paclitaxel et radiothérapie) dans les cancers de l’œsophage du sujet âgé
-
PRODIGE 55 - SOCRATE : Etude de phase II randomisée évaluant l’efficacité d’une seconde ligne de chimiothérapie par du ramucirumab en association avec du paclitaxel ou non chez des patients âgés ayant un adénocarcinome de l’estomac ou de la jonction oeso-gastrique, métastatique ou localement avancé, non résécable.
- Statut : Ouvert (15-09-2018 - 15-12-2022)
- Promoteur : Fédération Francophone de Cancérologie Digestive (FFCD)
-
PRODIGE 59 - DURIGAST : Etude de phase II comparant l’efficacité d’une chimiothérapie dite FOLFIRI associé à du durvalumab, par rapport à du FOLFIRI associé à du durvalumab et du trémélimumab, comme traitement de 2ème ligne, chez des patients ayant un adénocarcinome gastrique ou de la jonction oesogastrique avancé
- Statut : Ouvert (07-05-2022 - 15-11-2023)
- Promoteur : Federation Francophone de Cancerologie Digestive
-
PRODIGE 62 - OESIRI : Etude de phase II randomisée comparant l’efficacité de l’Onivyde® en association avec de l’acide folique et du 5-fluorouracile par rapport à celle du paclitaxel en traitement de deuxième intention chez les patients ayant un carcinome épidermoïde métastatique de l'oesophage.
- Statut : Ouvert (11-04-2019 - 15-07-2022)
- Promoteur : Federation Francophone de Cancerologie Digestive
-
PRODIGE 67 - ARION : Association de radiochimiothérapie et immunothérapie pour le traitement du cancer de l’œsophage non résécable : un essai randomisé comparatif de phase II
- Statut : Ouvert (05-12-2018 - 01-09-2024)
- Promoteur : UNICANCER
-
REGIRI - PRODIGE 58 : Etude de phase II randomisée évaluant l’utilisation du REGorafenib associé à l’IRInotécan en deuxième ligne de traitement chez des patients atteints d’un adénocarcinome œsogastrique métastatique
- Status : Ouvert (05-07-2019 - 30-11-2022)
- Promoteur : UNICANCER
-
SAR408701 TED13751 : Etude de phase I/II, évaluant la tolérance, la pharmacocinétique et l'activité anti-tumorale de SAR408701, chez des patients ayant une tumeur solide avancée
- Statut : Ouvert (22-03-2018 - 31-03-2021)
- Promoteur : SANOFI
-
PRODIGE 55 - SOCRATE : Etude de phase II randomisée évaluant l’efficacité d’une seconde ligne de chimiothérapie par du ramucirumab en association avec du paclitaxel ou non chez des patients âgés ayant un adénocarcinome de l’estomac ou de la jonction oeso-gastrique, métastatique ou localement avancé, non résécable.
- Statut : Ouvert (15-09-2018 - 15-12-2022)
- Promoteur : Fédération Francophone de Cancérologie Digestive (FFCD)
-
SKYSCRAPER-07 : Une étude de l’atezolizumab avec ou sans tiragolumab chez des participants atteints d’un carcinome épidermoïde œsophagien non résécable dont les cancers n’ont pas progressé après une chimioradiothérapie concomitante définitive (SKYSCRAPER-07)
- Statut : Ouvert (28-12-2020 - 26-12-2025)
- Promoteur : Hoffmann-La Roche
- STELLAR-001 : Etude de phase I évaluant l'innocuité, la tolérance et l'activité antitumorale du IPH5401 associé à du durvalumab chez des patients adultes ayant des tumeurs solides avancées sélectionnées
-
XL 184-021 : Etude de phase 1b avec escalade de dose portant sur le CABOZANTINIB (XL184) administré seul ou en association avec l’atézolizumab chez des patients atteints de tumeurs solides localement avancées ou métastatiques.
- Statut : Ouvert (05-09-2017 - 31-12-2021)
- Promoteur : Exelixis
- Al-Batran SE.
Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial.
- Allum WH, Stenning SP, Bancewicz J et al.
Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer.
J Clin Oncol. 2009;27:5062-7.
- Alvarez Herrero L, Pouw RE, van Vilsteren FG et al
Risk of lymph node metastasis associated with deeper invasion by early adenocarcinoma of the esophagus and cardia: study based on endoscopic resection specimens.
Endoscopy. 2010 ;42:1030-6.
- Akiyama H, Tsurumaru M, Udagawa H et al.
Radical lymph node dissection for cancer of the thoracic esophagus.
Ann Surg. 1994;220:364-72
- Barbour AP, Rizk NP, Gonen M et al.
Adenocarcinoma of the gastrœsophageal junction: influence of esophageal resection margin and operative approach on outcome.
Ann Surg. 2007 ; 246 :1-8.
- Bonnetain F, Bouché O, Michel P, Mariette C, Conroy T, et al.
A comparative longitudinal quality of life study using the Spitzer quality of life index in a randomized multicenter phase III trial (FFCD 9102): chemoradiation followed by surgery compared with chemoradiation alone in locally advanced squamous resectable thoracic esophageal cancer.
-
Bories E, Barret M, Chaussade S et al.Traitement endoscopique des carcinomes épidermoïdes superficiels de l’œsophage
Acta Endosc, 2017.
- Bosset JF, F Lorchel, G Mantion et al.
Radiation and chemoradiation therapy for esophageal adenocarcinoma.
J Surg Oncol 2005;92:239-245.
- Bouché O, Raoul JL, Bonnetain F, et al. Fédération Francophone de Cancérologie Digestive Group.
Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (LV5FU2), LV5FU2 plus cisplatin, or LV5FU2 plus irinotecan in patients with previously untreated metastatic gastric cancer: a Federation Francophone de Cancerologie Digestive Group Study.
J Clin Oncol. 2004 Nov 1;22(21):4319-28.
-
Casson AG, Rusch VW, Zankowicz N .et alLymph node mapping of esophageal cancer.
Ann Thorac Surg 1994 ;58 :1560-70.
- Choi J, Kim SG, Im JPet al.
Comparison of endoscopic ultrasonography and conventional endoscopy for prediction of depth of tumor invasion in early gastric cancer.
Endoscopy. 2010;42:705-13.
- Conroy T, Galais MP, Raoul JL et al.
Phase III randomized trial of definitive chemoradiotherapy (CRT) with FOLFOX or cisplatin and fluorouracil in esophageal cancer (EC): Final results of the PRODIGE 5/ACCORD 17 trial.
J Clin Oncol. 2012;30,15 S, Part II, résumé LBA 4003.
- Dank M, Zaluski J, Barone C, et al.
Randomized phase III study comparing irinotecan combined with 5-fluorouracil and folinic acid to cisplatin combined with 5-fluorouracil in chemotherapy naive patients with advanced adenocarcinoma of the stomach or esophagogastric junction.
- Fumagalli U, Rosati R, Bona S, Chella B, Peracchia A.
A special instrument for a safe and effective laparoscopic esophageal myotomy.
- Gebski V, Burmeister B, Smithers BM et al.
Survival benefits from neoadjuvant chemoradiotherapy or chemotherapy in œsophageal carcinoma : a meta-analysis.
Lancet Oncol. 2007;8:226-34.
- Hofstetter W, Swisher SG, Correa AM et al.
Treatment outcomes of resected esophageal cancer.
Ann Surg. 2002;236:376-84
- Diagnostic de la Dénutrition de L’enfant et de L’adulte. Méthode.
Haute Autorité de Santé (HAS). Recommandations pour la pratique clinique, 2019, p. 2019-11.
- Herskovic A, Martz K, al-Sarraf M, et al.
Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus.
- Hulscher JB, van Sandick JW, de Boer AG et al.
Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus.
N Engl J Med. 2002 ;347:1662-9.
- Hvid-Jensen F, Pedersen L, Drewes AM .et al
Incidence of adenocarcinoma among patients with Barrett's esophagus.
N Engl J Med. 2011; 365:1375-83.
- Fléjou JF., Svrcek M.
Barrett's œsophagus - a pathologist's view.
Histopathology. 2007,50:3-14.
-
Kelly RJ, Ajani JA, Kuzdzal J, et al.
Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer.
N Engl J Med. 2021;384(13):1191-1203.
-
Kim, S., Fiteni, F., Paget-Bailly, S., et al.The impact of taxane-based preoperative chemotherapy in gastroesophageal signet ring cell adenocarcinomas.
-
Kim, S., Paget-Bailly, S., Messager, M., et al.
Perioperative docetaxel, cisplatin, and 5-fluorouracil compared to standard chemotherapy for resectable gastroesophageal adenocarcinoma.
European Journal of Surgical Oncology (EJSO), 2017, vol. 43, no 1, p. 218-225.
- Lazarescu I, Thureau S, Nkhali L et al.
Définiton du volume cible anatomoclinique pour l'irradiation des cancers de l'œsophage.
Cancer Radiother. 2013;17:453-60.
- Levine DS, Blount PL, Rudolph REet al.
Safety of a systematic endoscopic biopsy protocol in patients with Barrett's esophagus.
Am J Gastroenterol. 2000;95:1152-7.
- Lightdale CJ, Kulkarni KG.
Role of endoscopic ultrasonography in the staging and follow-up of esophageal cancer.
J Clin Oncol 2005;23:4483-9.
- Manner H, May A, Pech O et al.
Early Barrett's carcinoma with "low-risk" submucosal invasion: long-term results of endoscopic resection with a curative intent.
Am J Gastroenterol 2008;103:2589-97.
- Mariette C, Meunier B, Pezet D et al .
Hybrid minimally invasive versus open oesophagectomy for patients with oesophageal cancer: A multicenter, open-label, randomized phase III controlled trial, the MIRO trial.
J Clin Oncol 2015, 33(suppl 3; abstr 5).
- Mariette C, Castel B, Toursel H et al.
Surgical management of and long-term survival after adenocarcinoma of the cardia.
Br J Surg. 2002 ; 89 :1156-63.
- Mariette C, Piessen G, Triboulet JP.
Therapeutic strategies in œsophageal carcinoma : role of surgery and other modalities.
Lancet Oncol. 2007 ; 8 : 545-53.
- Mariette C, Castel B, Balon JM et al.
Extent of œsophageal resection for adenocarcinoma of the œsophagogastric junction.
Eur J Surg Oncol. 2003 ; 29 :588-93.
- Medical Research Council œsophageal Cancer Working Group.
Surgical resection with or without preoperative chemotherapy in œsophageal cancer : a randomised controlled trial.
Lancet 2002;359:1727-33
- Minsky BD, Pajak TF, Ginsberg RJ et al.
INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer : high-dose versus standard-dose radiation therapy.
J Clin Oncol 2002;20:1167-74.
- Nath J, Moorthy K, Taniere P et al.
Peritoneal lavage cytology in patients with oesophagogastric adenocarcinoma.
Br J. Surg. 2008; 95:721-6.
- Omloo JM, Lagarde SM, Hulscher JB et al .
Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of a randomized clinical trial.
Ann Surg. 2007 ; 246 : 992-1000
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T et al.
Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline.
Endoscopy. 2015 ;47:829-54.
- Rugge M, Pizzi M, Castoro C.
Definition of Barrett's Esophagus Dysplasia: Are We Speaking the Same Language ?
World J Surg. 2015;39:559-65.
- Sauvanet A, Mariette C, Thomas P et al.
Mortality and morbidity after resection for adenocarcinoma of the gastrœsophageal junction: predictive factors.
J Am Coll Surg. 2005 ;201:253-62.
- Sasako M, Sano T, Yamamoto S et al.
Japan Clinical Oncology Group (JCOG9502).
Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial.
Lancet Oncol. 2006 ; 7 : 644-51.
- Stein HJ, Hutter J, Feith M et al.
Limited surgical resection and jejunal interposition for early adenocarcinoma of the distal esophagus.
Semin Thorac Cardiovasc Surg. 2007 ; 19 : 72-8
- Stahl M, Kataja VV, Oliveira J ; ESMO Guidelines Task Force.
ESMO Minimal Clinical Recommendations for diagnosis, treatment and follow-up of esophageal cancer.
Ann Oncol 2005;16 Suppl 1:i26-7.
- Shaheen NJ, Sharma P, Overholt BF et al .
Radiofrequency ablation in Barrett's esophagus with dysplasia.
N Engl J Med. 2009;360:2277-88
- Sharma P, Dent J, Armstrong D et al
The development and validation of an endoscopic grading system for Barrett's esophagus: the Prague C & M criteria.
Gastroenterology. 2006 ;131:1392-9.
- Siewert JR, Feith M, Stein HJ.
Biologic and clinical variations of adenocarcinoma at the esophago-gastric junction : relevance of a topographic-anatomic subclassification.
J Surg Oncol. 2005;90:139-46.
- J. R. Siewert, H. J. Stein,
Carcinoma of the gastroesophageal junction - classification, pathology and extent of resection,
- Siewert JR, Hölscher AH, Becker K et al
Cardia cancer: attempt at a therapeutically relevant classification
Chirurg. 1987;58:25-32.
- Spechler SJ, Souza RF.
Barrett's esophagus.
N Engl J Med. 2014;371:836-45.
- The Paris endoscopic classification of superficial neoplastic lesions : esophagus, stomach, and colon : november 30 to december 1, 2002.
Gastrointest Endosc 2003 ; 58(6 Suppl):S 3-43
- Thirion PG, Michiels S, Le Maître A, Tierney J on behalf of the MetaAnalysis of Chemotherapy in Esophagus Cancer Collaborative Group.
Individual patient data-based meta-analysis assessing pre-operative chemotherapy in resectable œsophageal carcinoma.
J Clin Oncol. 2007;25, 18S (Suppl. Part I): résumé 4512
- Thomas CR, Berkey BA, Minsky BD et al.
Recursive partitioning analysis of pretreatment variables of 416 patients with locoregional esophageal cancer treated with definitive concomitant chemoradiotherapy on Intergroup and Radiation Therapy Oncology Group trials.
Int J Radiat Oncol Biol Phys. 2004;58:1405-10.
- Van Cutsem E, Moiseyenko VM, Tjulandin S, et al.
Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group.
- Van Hagen P, Hulshof MC, Van Lanschot JJ et al.
Preoperative chemoradiotherapy for esophageal or junctional cancer.
N Engl J Med. 2012;366:2074-84.
- Van Heijl M, Van Lanschot JJ, Koppert LB et al.
Neoadjuvant chemoradiation followed by surgery versus surgery alone for patients with adenocarcinoma or squamous cell carcinoma of the esophagus (CROSS).
BMC Surg. 2008 Nov 26;8:21.
- Vazquez-Sequeiros E, Wiersema MJ, Clain JE et al.
Impact of lymph node staging on therapy of esophageal carcinoma.
Gastroenterology 2003;125:1883-6.
- WHO classification of tumours. Tumours of the digestive system.
IARC press.
- Wong RK, Malthaner RA, Zuraw L et al
Combined modality radiotherapy and chemotherapy in nonsurgical management of localized carcinoma of the esophagus: a practice guideline.
Int J Radiat Oncol Biol Phys. 2003;55:930-42.